INTRODUÇÃO
Amyloidose é uma doença de deposição causada pelo acúmulo extracelular de fibrilas cuja fonte consiste em proteínas com uma estrutura instável que se dobram, agregam e sofrem deposição.1 Tal deposição pode alterar a estrutura dos tecidos e prejudicar a função de vários órgãos e sistemas.2
Fibrilas miiloides são insolúveis e resistentes à proteólise e são tipicamente coradas pelo vermelho Congo, mostrando intensa birefringência amarelo-esverdeada sob luz polarizada.3 Mais de 30 proteínas podem causar deposição amilóide, mas apenas 5 causam deposição significativa no tecido cardíaco1:
- –
Correntes leves, que causam amiloidose primária (AL).
- –
Transthyretin (TTR), que causa amiloidose TTR (ATTR).
- –
Apolipoproteína A.
- –
Fibrinogênio.
- –
Soro amiloidoproteína A, que produz amiloidose secundária.
Amiloidose primária e ATTR são as formas mais comuns de amiloidose cardíaca, sendo a forma AL historicamente considerada mais comum nos países desenvolvidos.3
A maior parte da informação sobre amiloidose cardíaca tem sido baseada na AL. Entretanto, embora o número de pacientes com AL tenha permanecido estável, o número de diagnósticos de ATTR aumentou recentemente e pensa-se agora que ATTR pode ser muito mais prevalente que AL.2
A amiloidose de transtiretina tem sido muito frequentemente objecto de diagnósticos errados ou atrasos significativos até ao seu correcto diagnóstico. As razões incluem heterogeneidade em suas formas, necessidade de confirmação histológica, escassez de equipamentos especializados e crenças errôneas entre alguns cardiologistas de que é uma doença rara sem opções de tratamento.2,3
No entanto, estes aspectos estão mudando. O diagnóstico tem implicações no tratamento dos pacientes. Foram desenvolvidas terapias específicas que podem retardar ou estabilizar o depósito e que são mais eficazes nos estágios iniciais. O diagnóstico precoce é, portanto, crucial. Esta revisão descreve avanços recentes significativos no diagnóstico e tratamento do ATTR, oferecendo esperança aos pacientes com esta condição.
AMILOIDOSE DE TRANSTITRETINA CARDIÁRIA
Transthyretin é uma proteína plasmática tetramérica responsável pelo transporte de tiroxina e proteína ligada ao retinol. É sintetizada principalmente no fígado e secundariamente no plexo coróide e no epitélio do pigmento retinal.4
Transthyretin tende a se dissociar de dímeros e monômeros, os quais se desmancham em fibrilas e sofrem deposição. Mutações pontuais ou o efeito da idade podem aumentar esta tendência, dando origem às 2 formas clínicas de ATTR: mutante (ATTRm) e tipo selvagem (ATTRwt).
MUTANT TRANSTHYRETIN AMYLOIDOSISE
Mais de 120 mutações são atualmente conhecidas por causar ATTRm. Estas mutações exibem um padrão de herança autossômico dominante, com penetração variável.4 Devido à sua ampla diversidade geográfica, é difícil estabelecer a prevalência de ATTR, mas é considerada uma doença rara com prevalência inferior a 1/100 000 habitantes2 (Tabela 1).
Principais Características Clínicas e Diagnósticas de Mutante e Selvagem…Tipo Transthyretin Amiloidose Cardíaca
| ATTRwt | ATTRm | |
|---|---|---|
| Prevalência | Desconhecido. Aparentemente muito frequente | |
| Estudo genético | Ausência de mutações em TTR | >Mutação em TTR |
| Idade típica na apresentação | > 60 anos | >Variável de acordo com a mutação causal |
| Sexo | Predominância masculina. 80% pacientes | Predominância masculina, com fenótipo mais agressivo |
| Manifestações extracardíacas | – Síndrome do túnel do carpo (33%-49%) – Estenose espinal lombar – Ruptura traumática do tendão do bíceps (32%) |
– Polineuropatia sensorial-motora bilateral ascendente – Disautonomia: hipotensão ortostática, diarréia-constipação, disfunção erétil – Envolvimento ocular: glaucoma, deposição intravitreal, pupilas com vieira |
| Deficiência cardíaca | Constante | >Variável de acordo com a mutação causal |
| – Débito cardíaco | – Insuficiência cardíaca (53%-86%) – Distúrbios de condução – FA (43%-67%) – AoS degenerativo |
– Distúrbios de condução – Insuficiência cardíaca – AF pouco frequente (10%) |
| Técnicas de diagnóstico | ||
| ECG | – Padrão de pseudoinfarto (63%-66%) – Baixa tensão (22%-33%) – Sokolow LVH (6%-13%) |
– Padrão de pseudoinfarto (18%-69%) – Baixa tensão (2%-25%) – Sokolow LVH (3%-8%) |
| > ECHO | – Hipertrofia moderado-severa – FEVE moderado-moderada deprimida (30%) |
– Hipertrofia moderada – FEVE moderada, tipicamente preservado |
| RM cardíaca | – Realce tardio – Elevado nativo T1 e EV |
|
| 99mTc DPD cintilografia | – Grau 2-3 | >- Grau 0: portadores assintomáticos – Grau 1: envolvimento cardíaco inicial – Grau 2-3: envolvimento cardíaco significativo |
AF, fibrilação atrial; AoS, estenose aórtica; ATTRm, amiloidose de transtítina mutante; ATTRwt, amiloidose de transtítina do tipo selvagem; ECG, eletrocardiograma; ECO, ecocardiograma; VE, volume extracelular; FEVE, fração de ejeção ventricular esquerda; HVE, hipertrofia ventricular esquerda; TTR, transtiretina.
As primeiras mutações da TTR foram relatadas como polineuropatia amilóide familiar (ou doença de Andrade), e consequentemente a ATTRm tem sido considerada até recentemente uma doença neurológica. Entretanto, achados recentes mostram envolvimento cardíaco em mais da metade dos casos.3
Existe uma forte correlação genótipo-fenótipo, com mutações associadas a doença puramente neurológica ou doença puramente cardíaca.3 Entretanto, a divisão do ATTRm em doença cardíaca ou neurológica pode ser uma simplificação excessiva, pois há considerável sobreposição entre as 2 formas clínicas no espectro da doença.
A mutação Val30Met (agora conhecida como Val50Met após 20 posições terem sido adicionadas ao nome da mutação tradicional no ATTRm) é a mutação mais frequente em todo o mundo e é endêmica em Portugal, Japão e Suécia. A sua incidência estimada em Portugal é de 1 por 538 habitantes.2 Mallorca (Espanha) e Valverde del Camino (Huelva, Espanha) também são consideradas áreas em que o ATTRm é endémico. A prevalência estimada em Maiorca em pacientes sintomáticos é de 3/100 000 habitantes.5
A mutação Val30Met causa uma condição predominantemente neurológica com polineuropatia sensorial-motora simétrica, que se inicia nos membros inferiores e segue um padrão ascendente. Pode estar associada a disautonomia com hipotensão ortostática, disfunção erétil, incontinência urinária e sintomas gastrointestinais. Normalmente começa no final da segunda ou terceira década de vida, e até 43% dos pacientes têm envolvimento cardíaco que é uma causa freqüente de morte4 (Tabela 1).
De particular relevância é a mutação Val122Ile (p. Val142Ile), que está presente em 3% a 4% da população negra norte-americana.3 Embora sua penetração seja incompleta,3 esta mutação tem sido associada a um risco aumentado de 47% de desenvolver insuficiência cardíaca (IC).6 Um estudo recente mostrou que a amiloidose Val122Ile foi a quarta causa mais comum de IC na população afro-caribenha britânica.7 Embora até 30% dos pacientes com esta mutação possam ter características de neuropatia leve,6 o fenótipo clínico é geralmente semelhante ao da ATTRwt.4 A Val122Ile não deve ser considerada uma mutação exclusiva da população negra, pois também pode estar presente na população branca. Por exemplo, identificamos esta mutação em 4 famílias espanholas brancas sem ascendência negra.
AMILOIDOSE DE TRANSTRETINO-TIPO DE SOLDAGEM
A amiloidose transtiretina do tipo selvagem foi descrita pela primeira vez em 1876. Anteriormente chamada amiloidose senil, mas seu diagnóstico em pacientes entre 40 e 60 anos de idade tornou este termo obsoleto. De interesse, o primeiro caso conhecido desta mutação foi encontrado em um paciente americano de 47 anos.8
A prevalência exata de ATTRwt permanece desconhecida. Entretanto, estudos sugerem que ela é subdiagnosticada e que pode ser a forma mais frequente de amiloidose cardíaca.2,3 Os seguintes resultados suportam esta hipótese:
- –
Em pacientes com mais de 80 anos de idade, a prevalência de deposição da ATTR é de 25% na autópsia.3
>
- –
Em pacientes com IC com fração de ejeção preservada (FEFH), a deposição do TTR moderadamente severa é de 5% na autópsia.9
- –
Em pacientes com mais de 60 anos de idade admitidos para FHF e hipertrofia ventricular esquerda (HVE) ≥ 12mm, nosso grupo recentemente encontrou uma prevalência de 13%.10
ATTRm não semelhante, a ATTRwt é uma doença esporádica que tipicamente começa após os 70 anos de idade.4 É encontrada principalmente em homens e as séries publicadas relataram taxas que variam de 89% a 98%.11,12 Entretanto, em uma série recente de pacientes diagnosticados com ATTRwt em 2 hospitais (Madri, Espanha e Bolonha, Itália), nosso grupo constatou que 20% eram mulheres. Além disso, outros estudos de autópsia também sugeriram que a ATTRwt em mulheres pode estar mais disseminada do que anteriormente relatado. Portanto, o sexo feminino não deve diminuir a suspeita clínica de ATTRwt (Tabela 1).13
Autopsia mostra que o depósito de TTR está disperso em diferentes órgãos na ATTRwt. Entretanto, o depósito é muito maior no coração devido ao tropismo cardíaco da TTR, sendo o envolvimento cardíaco a principal manifestação clínica.4 Os pacientes podem apresentar sintomas de depósito extracardíaco da TTR, como estenose do canal lombar, ruptura atraumática do tendão do bíceps ou “sinal de Popeye”, e síndrome do túnel do carpo (STC)3 (Figura 1). Todas essas características podem ajudar a orientar e estabelecer prontamente o diagnóstico. A TTC pode acompanhar outros subtipos de amiloidose, mas é mais comum na ATTRwt. A deposição pode preceder as manifestações cardíacas por vários anos.6 Pode ser usada como indicação em pacientes idosos com HVE, especialmente se tiverem STC bilateral não associada a atividades ocupacionais específicas e estiverem na classe funcional da New York Heart Association ≥ II (dados não publicados).
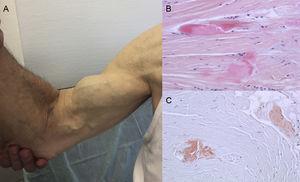
Sinais e sintomas de amiloidose de transtiretina. A: rotura não traumática do tendão do bíceps direito (“signo de Popeye”). B e C: coloração com hematoxilina-eosina (B) e vermelho Congo (C), ambos ×200, de amostra de ligamento carpal mostrando feixes densos de colágeno com material não celular. Cortesia da Dra Clara Salas Antón.
DIAGNÓSTICO DE TRANSTRETINA AMIDOSISCLÍNICA Apresentação
Amyloid pode infiltrar-se em qualquer estrutura cardíaca.1 Tipicamente, a deposição aumenta a espessura da parede ventricular, o que causa uma diminuição gradual da distensibilidade levando a disfunções diastólicas graves. A ATTR tem sido, portanto, tradicionalmente incluída como causa de cardiomiopatia restritiva.
No entanto, o espectro clínico da ATTR é muito mais amplo e heterogêneo. O sintoma mais comum do ATTR é a IC. Como mencionado, um estudo publicado pelo nosso grupo em 2015 sugeriu que um protocolo baseado no ácido 99mTc-3,3-difosfono-1,2-propanodicarboxílico (99mTc-DPD) cintilográfico pode ser útil para o diagnóstico de ATTRwt em uma proporção significativa (13%) de pacientes com mais de 60 anos admitidos para a HFpEF.10 Com base nesse resultado, a cintilografia 99mTc-DPD foi incluída nas diretrizes européias de 2016 sobre IC como uma ferramenta útil para a identificação de pacientes com ATTR.14 Entretanto, a ATTR não deve ser suspeitada exclusivamente em pacientes com HFpEF porque, à medida que a deposição amilóide avança, a função contrátil piora e, consequentemente, a ATTR pode estar associada a diferentes graus de disfunção sistólica.
A amiloidose de transtiretina é uma fenocópia da cardiomiopatia hipertrófica (HCM) e pode ser confundida com ela. Um recente estudo francês multicêntrico relatou que 5% dos pacientes com CMH (HCM) têm ATTRm.15 No entanto, nossos resultados não estão de acordo com esta alta taxa, que poderia estar relacionada à grande população negra na França.
Anormalidades de condução cardíaca podem ser a primeira manifestação de ATTR. A infiltração amiloide dos nós sinusal e atrioventricular1 pode indicar a necessidade de implante de marcapasso (Tabela 1). O estudo anteriormente mencionado, realizado na Espanha e Itália, constatou que as anormalidades de condução foram a primeira manifestação da ATTRwt em 7% dos pacientes com esta doença.13
As arritmias atriais também são muito comuns em pacientes com ATTRwt13 (Figura 2A), sendo que a primeira manifestação da doença pode ser acidente vascular cerebral.4 De fato, o grupo da Mayo Clinic sugeriu recentemente que a ATTRwt deve ser descartada no estabelecimento de um diagnóstico de fibrilação atrial não-valvar (FA) em pacientes idosos.8 Em contraste, a FA é muito menos comum em pacientes com ATTRm (Tabela 1).
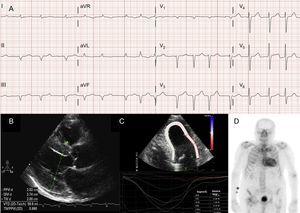
Técnicas de diagnóstico em amiloidose cardíaca de transtítina (ATTR). A: eletrocardiograma de um paciente com amiloidose de transtiretina do tipo selvagem (ATTRwt), mostrando fibrilação atrial e padrão de pseudoinfarto em eletrodos inferiores. B: ecocardiograma de paciente com amiloidose transtíretínica mutante com mutação Val30Met, com hipertrofia concêntrica ventricular esquerda acentuada e derrame pericárdico discreto. C: tensão regional longitudinal do paciente com ATTRwt, mostrando valores preservados no segmento apical e valores deprimidos nos segmentos basal e midventricular. D, 99mTc-DPD (99mTc-3,3-difosfono-1,2-propanodicarboxílico) escaneamento de um paciente com ATTRwt, mostrando captação biventricular superior à captação óssea, correspondente ao Perugini grau 3.
Finalmente, notamos que o ATTR e a estenose aórtica degenerativa podem coexistir no mesmo paciente. Em 2016, vários estudos chamaram a atenção para esta possibilidade e um estudo prospectivo relatou que o ATTRwt tinha uma prevalência de 6% em pacientes com mais de 65 anos que foram submetidos à substituição da valva aórtica.16 Este estudo sugeriu que pacientes com ambas as entidades tiveram um prognóstico pós-operatório muito pior do que aqueles sem ATTRwt (mortalidade de 50% vs 6,9% após um seguimento mediano de 2,3 anos).16 Outro estudo recente com cintilografia 99mTc-DPD em 43 pacientes com estenose aórtica de baixo fluxo/baixo grau identificou 5 pacientes com ATTRwt (prevalência de 12%). 17 Pacientes com estenose aórtica grave e ATTRwt compartilham o mesmo perfil demográfico, e o tratamento adequado para pacientes com ambas as doenças ainda está por ser determinado.
Utilidade das Técnicas de Diagnóstico
O diagnóstico de ATTR é um desafio na prática clínica diária. Embora a eletrocardiografia e a ecocardiografia desempenhem um papel no diagnóstico, novas técnicas não invasivas adquiriram um papel fundamental na avaliação de pacientes com ATTR.
Eletrocardiograma
A associação entre baixa voltagem e amiloidose cardíaca há muito tem sido considerada indiscutível.3 Os critérios mais utilizados na prática clínica são a amplitude QRS 1 Embora as baixas tensões eletrocardiográficas no estabelecimento da HVE devam estabelecer suspeita, a prevalência em uma série contemporânea de ATTR foi tão baixa quanto 20% a 25%.3,4,13 A prevalência também varia de acordo com os critérios aplicados. Por exemplo, o uso do critério Sokolow (onda S no chumbo V1 + onda R no chumbo V5 ou V6
1,5 mV) pode aumentar a prevalência calculada entre 46% e 58%.13 A razão entre a espessura da parede ventricular esquerda e a tensão QRS total tem sido recomendada para melhor avaliar as disparidades entre os resultados das 2 técnicas.2,3 Entretanto, até 20% dos pacientes com ATTR podem atender aos critérios eletrocardiográficos para HVE.2,3
Na maioria das séries de pacientes com amiloidose cardíaca, o padrão pseudoinfarto é o achado eletrocardiográfico mais comum2,3,13 (Figura 2A). Devido ao possível envolvimento do sistema de condução, bloqueios de ramos completos ou incompletos também são comuns.3
Equocardiografia
Embora o ecocardiograma seja a pedra fundamental do diagnóstico inicial da ATTR, nenhum achado é específico.3 A amiloidose de transtiretina tem sido tipicamente associada a um ventrículo esquerdo normal ou pequeno com hipertrofia concêntrica.3 O 10º Simpósio Internacional de Amiloides e Amiloidose realizado em 2004 estabeleceu o critério ecocardiográfico de doença cardíaca devido à AL na ausência de outras causas de HVE como a presença de HVE com um corte de 12 mm para espessura da parede interventricular.4 Este critério foi posteriormente extrapolado para outras formas de amiloidose (Figura 2B), o que conferiu um alto grau de especificidade, mas baixa sensibilidade.
Apesar da HVE concêntrica ter sido classicamente descrita, as séries atuais sugerem que cerca de 20% têm HVE assimétrica.13
Embora a associação clássica entre uma fração de ejeção do ventrículo esquerdo (FEVE) normal ou levemente diminuída e a amiloidose cardíaca2 , a faixa da FEVE é altamente variável.8 Em estudo recente realizado na Mayo Clinic, uma FEVE 8 enquanto em nossa série uma FEVE 13 Além disso, o uso da FEVE na avaliação da função sistólica na amiloidose cardíaca é limitado, pois valores ligeiramente deprimidos já são indicativos de doença cardíaca relevante. Essa limitação pode ser superada pelo uso de velocidades de Doppler tecidual, strain imaging e fração de contração miocárdica, que têm sido propostos como índices mais apropriados para avaliar a função cardíaca.2
Outros sinais ecocardiográficos clássicos são hipertrofia ventricular direita, dilatação biatrial, derrame pericárdico leve, espessamento da valva atrioventricular, espessamento da parede do septo atrial e aspecto granular cintilante do miocárdio.3,6 Entretanto, como algumas dessas características foram observadas em uma série altamente selecionada de pacientes em estágios avançados da doença, nem todas elas precisam estar presentes para estabelecer suspeita.1
As imagens de tensão regional é uma técnica muito útil para o diagnóstico precoce de pacientes com ATTR. Em pacientes com ATTR, a deformação longitudinal é deprimida nos segmentos basal e midventricular, mas é preservada nos segmentos apicais18 (Figura 2C). Este padrão típico pode ser útil no diagnóstico diferencial do ATTR de outras doenças cardíacas.4
Biomarcadores
Existem menos dados sobre o papel do prohormônio N-terminal do propeptídeo natriurético cerebral (NT-proBNP) e da troponina no ATTR do que na AL.4 Os níveis de NT-proBNP na ATTR são tipicamente menores do que na AL,4 refletindo 2 mecanismos fisiopatológicos diferentes: toxicidade direta da cadeia de luz na AL versus dano induzido pelo tecido por protofibrilas na ATTR.
Recentemente, o grupo da Mayo Clinic propôs um sistema de estratificação semelhante ao que está em vigor para a AL. Em uma coorte de 360 pacientes com ATTRwt, ambos os biomarcadores foram mostrados como preditores de mortalidade. Pacientes do estágio III (NT-proBNP > 3000 pg/mL e troponina T > 0,05 ng/mL) tiveram uma sobrevida mediana de 20 meses, enquanto pacientes dos estágios I e II tiveram uma sobrevida mediana de 66 meses e 40 meses (sem biomarcador ou apenas 1 biomarcador acima dos pontos de corte estabelecidos, respectivamente).
Ressonância Magnética Cardíaca
Ressonância Magnética Cardíaca (RMC) pode ser usada para obter informações estruturais e funcionais e caracterizar a composição do tecido miocárdico.3 A RMC é essencial na identificação precoce do ATTR e no seu diagnóstico diferencial de outras doenças cardíacas.
A caracterização do tecido pela RMC baseia-se nas seguintes características:
- –
Aprimoramento tardio: Um padrão subendocárdico global é virtualmente patognomônico da amiloidose cardíaca, mas está presente apenas em cerca de um quarto dos pacientes. Outros padrões, tais como transmural (o mais comum) ou remendo, também são compatíveis (Figura 3). Apesar de sua alta sensibilidade e especificidade, deve-se levar em conta que pode haver uma possível ausência de realce tardio (15% dos pacientes) e, em nossa experiência, uma porcentagem não negligenciável de falsos negativos por razões técnicas.3 O padrão de realce transmural está associado a pior prognóstico e é um preditor independente de mortalidade.19
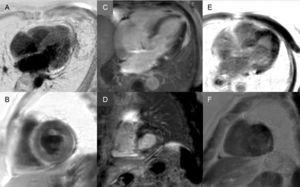 Figure 3.
Figure 3.Diversidade dos padrões de realce tardio por ressonância magnética cardíaca na amiloidose de transtiretina. A e B: seqüências de realce tardio, plano de 4 câmaras e eixo curto no nível médio, respectivamente, de um paciente com amiloidose de transtiretina mutante (ATTRm), mostrando deposição difusa de gadolínio transmural patológico. C e D: seqüências de realce tardio, nível basal de 4 câmaras e eixo curto, respectivamente, de pacientes com ATTRm mostrando deposição patológica de gadolínio com padrão remendado, com área focal inferior inferoseptal e inferolateral basal. E e F, seqüências de realce tardio, plano de 4 câmaras e eixo curto a nível apical, respectivamente, de pacientes com ATTRm, mostrando deposição transmural patológica extensa, exceto nos segmentos basal e ântero-lateral médio. Cortesia do Dr. Jesús González Mirelis.
(0.15MB).- –
T1 longo: O mapeamento T1 é uma técnica na qual um sinal miocárdico quantitativo é medido antes (nativo T1) ou após a administração de contraste. Os tempos nativos T1 são muito longos na amiloidose cardíaca.3 O mapeamento T1 não requer a administração de contraste e por isso pode ser usado em insuficiência renal. Os tempos T1 podem até mesmo ser anormais antes da HVL ser observada.3 Os tempos T1 são mais longos em ATTR do que em HCM e controles (1097ms ± 43 ms vs 1026ms ± 64 ms vs 9,67ms ± 34ms, respectivamente; P
ms ± 68 ms; P = 0,01).20
- –
A administração de contraste pode ser usada para calcular o volume extracelular (ECV) e avaliar aumentos do espaço extracelular. Os valores de ECV na amiloidose cardíaca são maiores que em outras cardiopatias, exceto em zonas de infarto do miocárdio.21 Em 2016, nosso grupo, em colaboração com outros centros nacionais, relatou que a quantificação de ECV pode identificar o envolvimento cardíaco no ATTRm e, pela primeira vez, correlacionou-o com o grau de comprometimento neurológico, apoiando o uso desta técnica no diagnóstico precoce e rastreamento do ATTRm.22
As técnicas quantitativas de mapeamento T1 e de cálculo do ECV podem ser muito úteis no ATTR para diagnóstico precoce, acompanhamento clínico e avaliação da resposta ao tratamento (Figura 4).
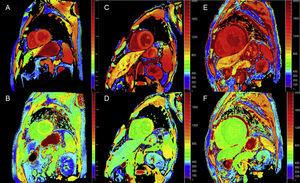 Figure 4.
Figure 4.MapaT1, antes e depois do contraste, com MOLLI (Modified Look-Locker Inversion-recovery) em ressonância magnética cardíaca 3T em controle saudável, paciente com amiloidose de transtiretina, e paciente com amiloidose primária de cadeia de luz. A e B: mapeamento T1 nativo e volume extracelular (EV), respectivamente, em um controle saudável, mostrando valores normais (EV = 0,214). C e D: mapeamento T1 nativo e EV, respectivamente, em um paciente com amiloidose de transtiretina mutante com dano neurológico e envolvimento cardíaco incipiente, T1 nativo elevado e EV levemente elevado (0,361). E e F: mapeamento T1 nativo e EV, respectivamente, em um paciente com amiloidose cardíaca de transtiretina tipo selvagem, T1 nativo elevado e EV muito elevado (0,626), refletindo infiltração amilóide maciça. Cortesia do Dr. Jesús González Mirelis.
(0,68MB).Cintilografia Cardíaca
Nos anos 80, a observação da captação cardíaca de vários traçadores de difosfonatos ósseos estava histologicamente correlacionada com a presença de amiloidose cardíaca.23 O mecanismo de captação não é bem caracterizado, mas pode estar relacionado ao teor de cálcio dos depósitos amilóides.
Um estudo precoce do grupo de Bolonha com 99mTc-DPD encontrou captação cardíaca em 15 pacientes com ATTR e sua ausência em 10 pacientes com TA, usando um escore baseado na captação biventricular igual ou superior à captação óssea (escore Perugini)24 (Figura 2D). Achados semelhantes foram posteriormente relatados pelo nosso grupo e por outros.25 A captação leve (escore 1) e moderada (escore 2) podem ser encontradas em 30% e 10% dos pacientes com TA, respectivamente.24
Da sua alta sensibilidade e especificidade, esta técnica é extremamente útil para estabelecer um diagnóstico de ATTR e pode mostrar envolvimento cardíaco mesmo quando os achados ecocardiográficos e de RM ainda estão normais. De fato, após cintilografia para indicações oncológicas ou reumatológicas, achados incidentais de ATTR não são incomuns.26
O Tc-DPD não está disponível nos Estados Unidos, mas resultados semelhantes foram relatados usando imagens de 99mTc-PYP (pirofosfato).27
Outros radiotracadores estão atualmente em estudo. Por exemplo, o 18F-florbetapir, que já foi aprovado para a imagem beta-amilóide cerebral4 , foi estudado em pacientes com AL e ATTR. Os resultados mostram que o 18F-florbetapir pode detectar depósitos de AL e ATTR miocárdicos.28 Embora os dados disponíveis tenham sido obtidos em estudos de casos29 e o alto custo desse radiotraçador limite seu uso, vários estudos estão em andamento sobre a potencial vantagem de seu uso sobre o do Tc-DPD como técnica de triagem para os 2 tipos mais comuns de amiloidose.
Diagnóstico Invasivo
O diagnóstico definitivo do ATTR é baseado na demonstração histológica das fibrilas amilóides. Embora possa haver deposição extracardíaca, a probabilidade de demonstração da amiloide pela histologia varia de órgão para órgão.2 Há poucos estudos sobre a relação custo-efetividade da biópsia extracardíaca (por exemplo, gordura abdominal, gengival, glândula salivar, gastrointestinal) na ATTR, que é maior na ATTRm do que na ATTRwt. Entretanto, uma biópsia negativa de um órgão clinicamente não afetado não exclui o diagnóstico de ATTR.4
Como na ATTRwt, a biópsia endomiocárdica está indicada em pacientes sem envolvimento extracardíaco ou com doença cardíaca isolada.3,4 A biópsia endomiocárdica é um procedimento de baixo risco (especialmente em centros experientes) e erros de amostragem são improváveis.6
Após confirmação histológica da amiloidose, que às vezes pode requerer interpretação por pessoal treinado,6 a classificação correta do subtipo é crucial.4 Atualmente, a classificação depende de uma combinação de imunohistoquímica, análise genética e proteômica:
- –
A imunohistoquímica é baseada no uso de anticorpos específicos contra proteínas amilóides conhecidas. Embora os resultados desta técnica sejam tipicamente definitivos, ela é menos sensível no reconhecimento de cadeias de luz.4
- –
Esta limitação pode ser superada pelo uso da espectrometria de massa, que fornece resultados definitivos e é o critério padrão na confirmação do subtipo amilóide.2 Embora esta técnica só esteja disponível em centros especializados, é especialmente útil em casos inconclusivos ou positivos para vários anticorpos em imunohistoquímica, o que em nossa experiência ocorre em cerca de 20% a 30% dos casos. 4
- –
Porque as técnicas clínicas ou histológicas não conseguem distinguir o ATTRm do ATTRwt, os estudos genéticos são recomendados em todos os casos de ATTR. O achado de uma mutação causal pode ser importante para oferecer aconselhamento genético e acompanhamento a portadores assintomáticos, 4,30 que poderiam se beneficiar de terapias futuras que retardam ou mesmo previnem o início da doença.31
Diagnóstico não-invasivo
Até recentemente, estudos histológicos eram considerados essenciais no diagnóstico do ATTR.3 Entretanto, para facilitar o diagnóstico, em 2016 um estudo multicêntrico internacional propôs um novo algoritmo para o diagnóstico não-invasivo do ATTR.32
O estudo analisou os resultados de 1217 pacientes. A presença de sinais clássicos de amiloidose cardíaca usando técnicas de imagem, grau 2 ou 3 de captação de Tc-DPD/PYP na cintilografia, e a ausência de uma proteína monoclonal teve uma especificidade e valor preditivo positivo para ATTR de 100%32 (Figura 5).
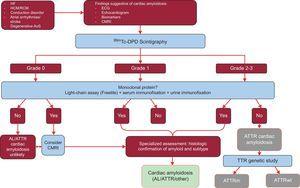 Figure 5.
Figure 5.Algoritmo de diagnóstico para pacientes com suspeita de amiloidose cardíaca. Sistema de classificação cintilográfica 99mTc-DPD: grau 0, sem captação cardíaca; grau 1, captação ligeiramente inferior à óssea; grau 2, captação moderada igual à captação óssea; grau 3, captação severa superior à captação óssea. VCA, AVC; AL, amiloidose primária da cadeia de luz; AoS, estenose aórtica; ATTR, amiloidose de transtiretina; ATTRm, amiloidose de transtiretina mutante; ATTRwt, amiloidose de transtiretina do tipo selvagem; RMC, ressonância magnética cardíaca; ECG, eletrocardiograma; CMH, cardiomiopatia hipertrófica; IC, insuficiência cardíaca; RCM, cardiomiopatia restritiva; TTR, transtiretina.
(0.32MB).Uma característica chave deste algoritmo é a ausência de uma proteína monoclonal que poderia causar AL no ensaio de cadeia sérica (Freelite, The Binding Site, UK) e na electroforese por imunofixação do sangue e da urina. A presença de uma proteína monoclonal é uma indicação para biópsia endomiocárdica para distinguir entre ATTR e AL.32 Até 5% da população com mais de 65 anos tem gamopatia monoclonal de significado indeterminado.2 Em indivíduos idosos, um aumento moderado nas cadeias leves circulantes não deve levar diretamente ao diagnóstico de AL. Tem sido relatado que até 10% dos pacientes idosos com ATTRwt e gamopatia monoclonal de significado indeterminado em centros de referência tinham recebido anteriormente um diagnóstico errado de AL.3,33 Um diagnóstico correto é necessário para evitar quimioterapia inadequada. De interesse, nosso hospital documentou 2 casos de pacientes com mieloma múltiplo e ATTRwt concomitante na espectrometria de massa.
TREATAMENTO DA AMILOIDOSE DE TRANSTHIRETINA CARDIÁRIA
O tratamento de pacientes com ATTR tem 2 objetivos: dar apoio médico e, se possível, parar ou retardar a deposição amilóide através do uso de tratamentos específicos.
Tratamento médico
As seções seguintes descrevem os cuidados cardíacos de suporte para pacientes com ATTR.
O tratamento da insuficiência cardíaca
Euvolemia deve ser mantida em pacientes com amiloidose cardíaca. Dieta e medidas de estilo de vida são muito importantes. Os diuréticos são fundamentais para o tratamento da IC no ATTR. Entretanto, como o uso excessivo de diuréticos pode levar à hipotensão (freqüentemente devido à disfunção autonômica) e piorar a situação clínica, especialmente na ATTRm, deve-se ter extremo cuidado no seu manejo.
No tratamento da IC na ATTR, deve-se levar em conta que a disfunção diastólica prejudicada e a redução do volume do AVC levam à taquicardia compensatória para manter o débito cardíaco. Portanto, os beta-bloqueadores devem ser usados com cuidado e individualizados para cada paciente. A prática padrão é removê-los na ausência de dificuldades no controle da freqüência cardíaca. Esta abordagem é ainda mais importante, se possível, na ATTRwt devido à presença frequente de distúrbios de condução.6 Antagonistas do cálcio e da digoxina podem se ligar a fibrilas amilóides e, portanto, estão contra-indicados na ATTR devido ao risco de toxicidade mesmo em doses terapêuticas.6
Em contraste com a IC com disfunção sistólica devido a outras etiologias, não há evidências em apoio a um benefício prognóstico devido ao uso de beta-bloqueadores, inibidores da enzima conversora da angiotensina, ou antagonistas dos receptores da angiotensina II na amiloidose cardíaca. De fato, seu uso pode levar a piora clínica devido à hipotensão e baixo débito: uma publicação recente relatou pior prognóstico no ATTRm e um efeito neutro no ATTRwt.34
Gerenciamento de Arritmias Atriais
O manejo da FA no ATTR é um desafio. A manutenção do ritmo sinusal a longo prazo é difícil. No entanto, a cardioversão elétrica pode ser tentada porque pode levar a uma melhora clínica.
O risco tromboembólico em pacientes com ATTR é muito alto. Além disso, a infiltração amilóide crônica pode levar a disfunção atrial mecânica, que pode ser a causa subjacente do desenvolvimento de trombo atrial em alguns pacientes sem FA. A terapia anticoagulante no ATTR não deve ser baseada no escore CHADS2-VASC e deve ser terapia padrão na FA. Os eventos de sangramento são menos comuns do que na AL e, portanto, alguns hospitais recomendam a terapia anticoagulante em pacientes em ritmo sinusal se houver má função atrial de acordo com as velocidades de Doppler transmitral. Embora não existam estudos comparativos sobre a eficácia dos anticoagulantes orais diretos versus antagonistas da vitamina K, nosso hospital tem administrado anticoagulantes orais diretos a pacientes selecionados.
Role of Devices
As recomendações atuais para implante de marcapasso são as mesmas no ATTR e na população em geral. Entretanto, alguns grupos favorecem o implante profilático, especialmente em pacientes com ATTRm e distúrbios de condução.35 Não favorecemos esta estratégia preventiva e não encontramos uma taxa tão alta de distúrbios de condução que justifique o implante profilático em pacientes com ATTRm.
O papel do uso de cardioversor-desfibrilador implantável (CDI) no ATTR não está bem estabelecido. Em uma pequena série, o implante de CDI não melhorou significativamente a sobrevida, embora tenha tido um efeito apropriado em múltiplos pacientes durante os primeiros 2 anos.36
Transplante de CDI
Transplante de CDI tem tido um papel menor no ATTR porque o ATTRm pode envolver vários órgãos e o ATTRwt tipicamente afeta pacientes idosos. Entretanto, a ausência de envolvimento extracardíaco em pacientes com ATTRwt os torna bons candidatos para o procedimento. A literatura fornece exemplos de sucesso de transplante em pacientes com menos de 70 anos com ATTRwt ou com ATTRm e envolvimento cardíaco predominante.4
Specific Treatment of Transthyretin Cardiac Amyloidosis
No momento, não há terapia aprovada para o tratamento específico da amiloidose cardíaca ATTR, embora o transplante hepático (TxH) sozinho ou em combinação com transplante cardíaco tenha sido usado no ATTRm desde a década de 1990 como forma de eliminar a principal fonte de TTR precursor.4
Transplante hepático
O Familial Amyloidotic Polyneuropathy World Transplant Registry37 relatou que mais de 2000 pacientes com ATTRm foram submetidos a TxH em 20 países.4 Pacientes com a mutação Val30Met e um quadro clínico predominantemente neurológico têm uma taxa de sobrevida de mais de 50% aos 20 anos.3 Esses resultados promissores são baseados na seleção rigorosa dos pacientes de acordo com a idade, tipo de mutação e estágio da doença. A indicação mais comumente aceita para TxH é a combinação de idade jovem, a mutação Val30Met, e estágios iniciais da doença.
Porém, as principais limitações desta técnica são a escassez de doadores, a necessidade de imunossupressão crônica, idade avançada no momento da apresentação, e piores resultados obtidos em pacientes com mutações que não a mutação Val30Met.
A necessidade de compreender melhor a patogênese da TTR e as limitações da TxH tem estimulado o desenvolvimento de várias drogas.
Estes novos compostos atuam em diferentes pontos da cascata de amiloidogênese da TTR (Figura 6). O tratamento envolverá sempre a redução da proteína precursora, embora evitar a deposição e eliminar as deposições existentes será igualmente importante. Portanto, acreditamos que, no futuro, a abordagem desta doença será na forma de tratamento combinado.
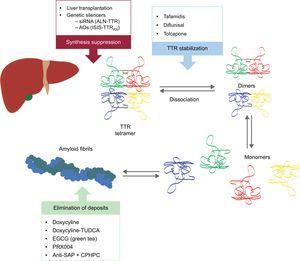 Figure 6.
Figure 6.Terapias específicas na amiloidose cardíaca de transtiretina e principais alvos. AntiSAP + CPHPC, anti-soro amilóide componente P + (R)-1–6-oxo-hexanoyl]pirrolidina-2 ácido carboxílico; AOs, oligonucleotídeos antisenso; EGCG, epigalocatequina-3 galato; siRNA, pequeno RNA interferente; TTR, transtiretina; TUDCA, ácido tauroursodeoxicólico.
(0.27MB).>Supressão da Síntese da Transthyretin;
Duas linhas de pesquisa estão em curso sobre a inibição da expressão hepática do TTR: o uso de pequenos RNA interferentes (siRNA) e o uso de drogas oligonucleotídicas antisensas (AO).
- –
Os siRNA são moléculas de RNA de dupla cadeia que silenciam as sequências de RNA mensageiro, ligando-se especificamente a elas, impedindo a formação de proteínas. Patisiran (ALN-TTR02) reduziu a produção de TTR em 80%.38 Em pacientes com ATTRm, a redução de TTR foi de 87%.39 Um estudo fase 2 mostrou resultados promissores, demonstrando parâmetros ecocardiográficos, funcionais e analíticos estáveis aos 12 meses e 24 meses.40 Os resultados do estudo neurológico fase 3 em pacientes com ATTRm e uma subanálise de pacientes com envolvimento cardíaco são esperados em 2017 (Tabela 2). Outro medicamento, o revusiran (ALN-TTR01), é administrado por via subcutânea e difere do partisiran nas nanopartículas lipídicas que encapsulam o siRNA. Este fármaco foi objecto de um ensaio clínico fase III em pacientes com ATTRm que têm doença cardíaca. O estudo foi interrompido no ano passado devido a um aumento inesperado da mortalidade no grupo de tratamento (Tabela 2).
Tabela 2.Principais Ensaios Clínicos em Curso em Amiloidose Cardíaca Transthyretin®
>
Mecanismo de ação Complexo Teste Desenho Patientes (N) e subtipo ATTR Intervenção Pontos finais primários Situação/resultados Supressão da síntese de TTR Patisiran (ALN-TTR02) NCT01961921 Estudo fase II, multicêntricos >
27
ATTRm (11 envolvimento do coração)Patisiran 0.30 mg/kg IV a cada 3 semanas durante 2 anos Segurança a longo prazo. Desfechos secundários: efeito sobre distúrbios neurológicos e parâmetros cardíacos Fármaco com perfil de segurança semelhante no fenótipo neurológico e cardíaco
Troponina I, NT-proBNP e dados ecocardiográficos permaneceram estáveis em 12 mo e 24 moNCT01960348 (APOLLO) Fase III, aleatório, duplo-cego, controlado por placebo, multicêntrico 225
ATTRm com envolvimento neurológicoInfusão anti-parasitária IV vs placebo 2:1 Alterações no mNIS+7 Expectativa Novembro 2017
Subanálise de pacientes com envolvimento cardíaco previstoNCT02510261 Estudo de extensão doAPOLLO Infusão intra-uterina IV vs placebo 2:1 para 52 wk Segurança e efeitos adversos a longo prazo Em curso Revusiran (ALN-TTR01) NCT02319005 (ENDEAVOUR) Fase III, randomizado, duplo-cego, controlado por placebo 206
ATTRm com envolvimento cardíacoRevusiran 500mg 5 d, então semanalmente por 2 y vs placebo Alterações no teste de caminhada de 6 m e nos valores de TTR de plasma Continuação devido ao aumento da mortalidade no braço revusirano ISIS-TTRRX NCT01737398 Fase II/III, randomizado, duplo-cego, controlado por placebo, multicêntrico 172
ATTRm com neuropatia; 50% de envolvimento cardíaco concomitanteISIS-TTRRRX 300mg SC a cada 12 h por 1 wk, então semanalmente para 64 wk vs placebo Alterações no questionário de qualidade de vida mNIS+7 e Norfolk Setembro esperado 2017
Casos de trombocitopenia grave e sangramento relatados
Análise dos parâmetros ecocardiográficos e NT-proBNP esperado em pacientes sem hipertensão com HVL > 12 mmTratamento da cardiomiopatia TTR com oligonucleotídeo antisenso específico da TTR Fase II, open-label, não-randomizado 20
ATTRm com envolvimento cardíaco e ATTRwtISIS-TTRRRX 300mg SC a cada 12 h/sk Parâmetros ecocardiográficos e RM cardíaca vs controles históricos Sem deterioração da tensão e diminuição da massa do VE de cerca de 5%
6 pacientes completaram 12 meses; 15 pacientes 6 mo; 1 paciente TxC>
NCT02627820 FASE II, open-label, não-randomizado >50
ATTRwtISIS-TTRRRX 300mg SC a cada 12 h por 1 wk, então 1 wk para 18 wk Alterações na deformação medida pelo rastreamento de manchas Cancelado sem iniciar o recrutamento de pacientes Estudo FASE III com ISIS-TTRRRX para o tratamento da cardiopatia amilóide TTR Fase III, aleatório, duplo-cego, controlado por placebo, multicêntrico 490
ATTRwt e ATTRm com envolvimento cardíacoISIS-TTRRRX 300mg SC a cada 12 h por 1 wk, depois semanalmente por 16 wk com placebo, então semanalmente por 24 mo Morte, TxC, ou admissão por causas cardiovasculares Em espera Estabilização do TTR Tafamidis NCT01994889 Fase III, randomizado, duplo-cego, controlado por placebo, multicentro >441
ATTRwt e ATTRm com envolvimento cardíacoTafamidis 20mg ou 80mg oralmente a cada 24 h para 30 mo vs placebo Tudo-causar mortalidade e hospitalização cardiovascular Fevereiro de 2018 NCT02791230 Extensão Fase III NCT01994889 330
ATTRwt e ATTRm com envolvimento cardíacoTafamidis 20 mg ou 80 mg por via oral a cada 24 h durante 60 mo Todos-causar mortalidade e incidência de efeitos adversos Expectativa Dezembro 2021 NCT00935012 Fase II, open-label, ensaio de eficácia e segurança 31
ATTRwt ou ATTRm p.Val122Ile com envolvimento cardíacoTafamidis 20mg oralmente Segurança e eficácia Em curso até Dezembro de 2021 Diflunisal NCT00294671 Fase III, aleatorizado, duplo-cego, placebo-controlado, multicêntrico 130
ATTRm com fenótipo neurológico (50% com envolvimento cardíaco)Diflunisal 250mg por via oral a cada 12 h vs placebo acima de 24 mo NIS+7 a 24 mo NIS+7 diflunisal vs placebo 16.3 (P Sem redução da espessura ou tensão ventricular em pacientes com comprometimento cardíaco vs placebo Eliminação de depósitos Doxiciclina + TUDCA/UDCA NCT01171859 Fase II, aberto, não-randomizado, prospectivo 40
ATTR (25 ATTRm, 13 ATTRwt, e 2 receptores de transplante de dominó)Doxiciclina 100 mg cada 12 h + TUDCA 250 mg cada 8 h por 12 mo, então 6 mo sem terapia Increase 14 pacientes retiraram
Reações cutâneas adversas, 16 pacientes
68% dos 25 pacientes avaliados cumpriram o desfecho primário
Aumento geral da tensão a 12 mo e piora após 6 mo sem terapiaNCT01855360 Fase II, amiloidose ATTR cardíaca (27 ATTRwt e 3 ATTRm), não randomizada, prospectiva vs controles históricos 30
Amiloidose ATTR cardíaca (27 ATTRwt e 3 ATTRm). Controles históricos, 14 pacientes ATTRwtDoxiciclina 100 mg a cada 12 h + TUDCA 250 mg a cada 8h por 18 mo Alterações na deformação longitudinal a cada 6 mo 22 pacientes completaram o estudo e foram avaliados
Maior deterioração da deformação no grupo controle vs. grupo tratamento
ProBNP não aumentado no grupo tratamento; não medida nos controlesNCT01677286 Fase II, open-label, não-randomizado, prospectivo >
25
Amiloidose sistémica (6 ATTRwt e 3 ATTRm)Doxiciclina 100 mg a cada 12 h por 12 mo Segurança da droga
Resposta dos órgãos afectadosPiorização do NT-proBNP e função renal
Sem melhoria em outros parâmetros estudados
60% dos pacientes tiveram complicações cutâneas e 30% retiraram-se devido a problemas cutâneos ou gastrointestinaisNCT01171859 Fase II, aberto, não-randomizado, prospectivo 45
35 com envolvimento do coração; 25 ATTRm; 5 ATTRm com TxH; 13 ATTRwt; e 2 receptores de transplante de dominó fígadoDoxiciclina 100 mg a cada 12 h + TUDCA 250 mg a cada 8 h por 12 mo
Fase subseqüente de acompanhamento sem tratamento por 6 moResposta drogada definida como uma Resposta cardíaca avaliada em 25 pacientes
68% tiveram resposta cardíaca
TN-ProBNP e deterioração da deformação durante o seguimento sem tratamento
Alto número de retiradas devido a efeitos adversos
14 retiradas na fase de tratamento e 5 descontinuadas na fase sem tratamentoEfeito da doxiciclina + UDCA no ATTR Fase II, rótulo aberto, não-randomizado, prospectivo >28
ATTR com envolvimento cardíaco (27 ATTRm e 1 ATTRwt)Doxiciclina 200 mg/d por 4 wk, depois suspensa por 2 wk, então UDCA 750 mg/d para 12 mo
Fase subseqüente de acompanhamento sem tratamento para 6 moAlterações na pontuação NT-proBNP e Kumamoto Só 14% completaram o estudo e 36% completaram 12 mo
Não há alterações na NT-proBNP a 6 mo e piorando a 12 mo
Stable LVH
Piorando a pontuação do Kumamoto a 12 moEGCG NCT01171859 Fase II, aberto, não randomizado, prospectivo 25
ATTRwt600 mg, EGCG para 12 mo Alterações em ECHO e RM cardíaca (n = 14) Massa diminuída do VE 6% por RM cardíaca (P = 0.03)
LVEF, espessura miocárdica e MAPSE por ECHO inalteradosAntiSAP + CPHPC NCT03044353 Fase II, marca aberta, aleatorizada >40
Cort 1: amiloidose ATTR cardíaca
Cort 2: amiloidose primária após 6 mo de quimioterapiaAnti-SAP + CPHPC mensal por 6 mo Carga amilóide reduzida por RM cardíaca e ECHO Início em 2017 Anti-SAP + CPHPC, antiserum amilóide P componente + (R)-1–6-oxo-hexanoyl]pirrolidina-2 ácido carboxílico; ATTRm, amiloidose transtiretina mutante; ATTRwt, amiloidose transtiretina tipo selvagem; BNP, peptídeo natriurético cerebral; ECHO, ecocardiograma; EGCG, epigalocatequina-3 galato; IV, intravenoso; VE, ventrículo esquerdo; FEVE, fração de ejeção do ventrículo esquerdo; HVE, hipertrofia ventricular esquerda; MAPSE, excursão sistólica do plano anular mitral; mNIS, Modified Neuropathy Impairment Score; RM, ressonância magnética; NIS, Neuropathy Impairment Score; NIS-LL, pontuação de neuropatia dos membros inferiores; NT-proBNP, amino-terminal pró-cérebro natriurético; SC, subcutâneo; TTR, transthyretin; TUDCA, ácido tauroursodeoxicólico; TxC, transplante cardíaco; TxH, transplante hepático; UDCA, ácido ursodeoxicólico.
- –
Os AOs são fios curtos de oligonucleótidos que se ligam especificamente ao RNA, impedindo a tradução e a síntese protéica alvo.4 ISIS-TTRRRX é uma AO subcutânea, com reduções demonstradas dose-dependentes nos valores de TTR de 75% a 90% em voluntários saudáveis.4 O ensaio da fase III em pacientes com ATTRm e fenótipo neurológico terminou em março de 2017 e seus resultados são esperados até o final de 2017. Entretanto, a US Food and Drug Administration adiou o início de um ensaio fase III em pacientes com ATTRwt e ATTRm com doença cardíaca devido a casos de trombocitopenia grave no estudo neurológico (Tabela 2). Como 50% dos participantes do estudo neurológico tinham doença cardíaca, os resultados deste subestudo cardíaco determinarão se o ensaio da fase III será retomado. Por outro lado, existem dados preliminares de um ensaio de fase II com marca aberta. Neste estudo, 22 pacientes com ATTRwt e ATTRm com doença cardíaca receberam uma injeção semanal de ISIS-TTRRRX. Segundo o relato, o perfil de segurança do medicamento é muito favorável e os dados intermediários da progressão da doença cardíaca por RMC, NT-proBNP e testes de 6 minutos são positivos.41
Estabilização da transtiretina
Dissociação do tetrâmero TTR em subunidades é um passo crucial na formação do fibrilador ATTR. Diflunisal e tafamidis são 2 estabilizadores TTR com eficácia demonstrada na polineuropatia ATTRm.
- –
Tafamidis é uma pequena molécula administrada oralmente que se liga à TTR em sítios de ligação T4 estabilizando a proteína e prevenindo a sua dissociação. Após a publicação dos resultados de um ensaio aleatório duplo-cego em 125 doentes com ATTRm e a mutação Val30Met nas fases iniciais da doença neurológica42 , a Agência Europeia do Medicamento aprovou a sua utilização em 2011 como medicamento órfão para retardar a progressão neurológica. Dados recentes demonstram a eficácia do medicamento para alcançar a estabilidade neurológica em pelo menos 60% dos participantes após mais de 4 anos de acompanhamento. Até à data, tem uma utilização limitada em ATTR e doenças cardiológicas. Um estudo fase II em 21 pacientes com ATTRm e diferentes mutações mostrou que os parâmetros NT-proBNP e ecocardiográficos permaneceram estáveis aos 12 meses.43 Dados de um estudo de coorte de 5 anos confirmaram que a droga foi bem tolerada na dose de 20 mg, embora poucos pacientes com ATTRwt tenham permanecido estáveis aos 3,5 anos.44 O ensaio ATTR-ACT é um ensaio fase III de 30 meses que avalia a eficácia, segurança e tolerabilidade das doses de 20 mg e 80 mg de tafamidis vs placebo em 440 pacientes com ATTRm, ATTRwt e HF. O desfecho primário inclui mortalidade hospitalar e admissão. Seus resultados são esperados em 2018,3,27
- –
Diflunisal é um agente antiinflamatório não esteróide que estabiliza as moléculas de TTR in vitro. Não está disponível em Espanha, mas pode ser solicitado clinicamente do estrangeiro para uso compassivo. Um estudo fase III de ATTRm em pacientes com envolvimento predominantemente neurológico, mais da metade dos quais tinham doença cardíaca, não encontrou diferenças significativas nos parâmetros ecocardiográficos durante o período do estudo (Tabela 2).45 Seu potencial para efeitos adversos gastrointestinais, insuficiência renal, retenção de água e hipertensão arterial o tornam inadequado para pacientes com doença cardíaca. As evidências sobre diflunisal em pacientes com ATTR são muito limitadas. Há um estudo, mas foi limitado por ter um desenho de um único centro não randomizado com pouco seguimento e poucos pacientes (n = 13). Não houve admissão para IC descompensada, mas houve piora significativa da função renal.46
- –
Mais recentemente, um grupo espanhol demonstrou que o tolcapone (um inibidor oral de catecol-O-metiltransferase utilizado no tratamento da doença de Parkinson) tem a capacidade de se ligar in vitro ao TTR de pacientes com ATTRwt e Val122Ile com maior afinidade que outros estabilizadores.47
Eliminação dos Depósitos de Amiloides
Os depósitos de Amiloides são muito estáveis e parece que o organismo humano tem pouca capacidade de os eliminar. No entanto, tratamentos que impedem a produção de novos amilóides, como a quimioterapia na AL, podem eliminar gradualmente os depósitos a diferentes taxas específicas do órgão. A depuração cardíaca é especialmente baixa e até agora as evidências de regressão são escassas. Várias moléculas estão atualmente sob investigação para acelerar a depuração cardíaca amilóide em ATTR:
- –
Doxiciclina (um antibiótico comumente usado) perturba a formação de fibrilas amilóides. O efeito sinérgico da combinação de doxiciclina e ácido biliar tauroursodeoxicólico (TUDCA), que é usado no tratamento de doenças hepáticas, foi demonstrado para eliminar depósitos de TTR em modelos animais. Um estudo fase II com 20 pacientes não mostrou progressão cardíaca ou neurológica após 1 ano de tratamento com doxiciclina/TUDCA, com um perfil de segurança e tolerabilidade aceitável.4 Outros estudos fase II tentaram confirmar esses achados usando doxiciclina combinada/TUDCA, doxiciclina/ ácido tauroursodeoxicólico ou doxiciclina isoladamente.48-50 Os resultados preliminares de um desses estudos sugerem um efeito protetor, com menor piora da função cardíaca devido à tensão no grupo de tratamento. Outro destes estudos obteve resultados semelhantes em 40 pacientes com ATTR: NT-proBNP, classe funcional, FEVE e parâmetros de espessura miocárdica, entre outros, permaneceram estáveis aos 12 meses (Tabela 2). Entretanto, todos esses estudos tiveram uma alta taxa de desistência (35%-44%), principalmente devido aos efeitos adversos, particularmente hipersensibilidade solar e queixas gastrointestinais (até 30%).48-50
- –
O EGCG (galato de epigalocatequina-3) é a catequina mais abundante no chá verde, tendo sido demonstrado in vitro e em modelo murino inibir a formação de amilóide e eliminar depósitos existentes.4 A CMRI mostrou que a administração diária de 600mg de EGCG foi associada à estabilização da massa ventricular esquerda em um grupo de 25 pacientes (Tabela 2).51
- –
O PRX004 é um anticorpo monoclonal que age ligando-se a epitopos específicos de monômeros e TTR dobrado incorretamente. Assim, ele provoca a eliminação de depósitos ativando a fagocitose.52 A base do seu mecanismo de ação é semelhante ao de um anticorpo usado na AL. Estudos de Fase II sobre este anticorpo estão mostrando resultados promissores. Um estudo da fase I-II deste novo anticorpo está previsto para começar em 2017.
- –
Independentemente do tipo de proteína precursora amilóide, todos os depósitos contêm soro componente amilóide P (SAP). Usando esta molécula como um alvo, os anticorpos anti-SAP têm demonstrado que provocam uma reação macrofágica e dependente do complemento que causou grande eliminação de depósitos amilóides viscerais em um modelo murino. O composto bis-D CPHPC pode neutralizar o SAP plasmático, e a co-administração com anti-SAP IgG permite que o anticorpo atinja depósitos contendo SAP no tecido.53 Um estudo fase I publicado em 2015 demonstrou a eliminação de depósitos hepáticos em 15 pacientes com amiloidose sistêmica sem envolvimento cardíaco, com poucos efeitos adversos.53 Um estudo fase II de pacientes com amiloidose cardíaca ATTR e AL está programado para começar em 2017 (Tabela 2).
CONCLUSÕES
A amiloidose cardíaca de transtiretina é diagnosticada com frequência crescente. A cintilografia 99mTc-DPD e a RMC são exemplos de técnicas que podem ser utilizadas para a identificação simples e precoce de pacientes com ATTR.
Fármacos específicos para ATTR estão atualmente nas fases finais da pesquisa. Portanto, acreditamos que em breve a amiloidose cardíaca ATTR será considerada uma entidade tratável e não uma doença fatal.
FUNDANDO
Este trabalho foi realizado com assistência parcial do Instituto Carlos III de Saúde e da Sociedade Espanhola de Cardiologia (bolsa de investigação 2016 a E. González-López). A assistência do Instituto de Saúde Carlos III é financiada pelo Fundo Europeu de Desenvolvimento Regional “Outra Forma de Fazer Europa”.
CONFLITOS DE JURO
E. González-López tem participado como orador em actividades organizadas pela Pfizer. P. Garcia-Pavia recebeu pagamentos como orador em actividades organizadas pela Pfizer e como consultor da Alnylam, Prothena, e Pfizer. E. González-López, A. López-Sainz, e P. Garcia-Pavia declaram que Pfizer financiou projetos de pesquisa por sua instituição.
- –
- –