Como vimos, nossa dieta inclui muitos carboidratos, e você pode se perguntar se existe uma maneira de analisar uma amostra para dizer se é sacarose, ou um dos adoçantes sintéticos como sorbitol ou xarope de milho com alto teor de frutose, ou mesmo um composto como a vitamina C, que é sintetizada a partir de açúcares e como eles, contém apenas C, H e O. Existe essa forma, e é uma das formas mais importantes de análise, chamada análise elementar. É um dos primeiros métodos utilizados pelos pesquisadores para identificar um novo composto.
Até agora obtivemos todas as razões estequiométricas a partir dos coeficientes das equações químicas balanceadas. As fórmulas químicas também indicam quantidades relativas de substância, entretanto, e as razões estequiométricas também podem ser derivadas a partir delas. Por exemplo, a fórmula CO2 nos diz que não importa o tamanho da amostra de dióxido de carbono que tenhamos, sempre haverá 2 mol de átomos de oxigênio para cada mol de átomos de carbono. Ou seja, a partir da fórmula CO2 temos a razão estequiométrica
>
Também podemos determinar que para o CO2
>
>
>
>(Os recíprocos dessas razões estequiométricas também são válidos para o CO2.)
Razões estequiométricas derivadas de fórmulas em vez de equações estão envolvidas no procedimento mais comum para determinar as fórmulas empíricas de compostos que contêm apenas C, H, e O. Uma quantidade pesada da substância a ser analisada é colocada em um trem de combustão e aquecida em um fluxo de O2 seco. Todo o H no composto é convertido em H2O(g) que é preso seletivamente em um tubo de absorção previamente pesado. Todo o C é convertido em CO2(g) e este é absorvido seletivamente em um segundo tubo. O aumento de massa de cada tubo indica, respectivamente, quanto H2O e CO2 foram produzidos pela combustão da amostra
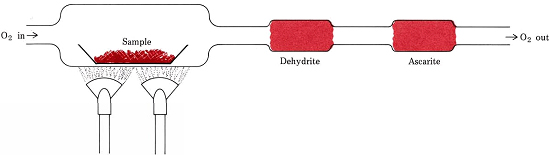
>
Figure {1}(PageIndex{1}) Um trem de combustão. H2O e CO2, produzidos pela combinação de O2 com H e C na amostra, são seletivamente absorvidos por tubos contendo desidrita e ascarita (NaOH no amianto).
Exemplo \\(\PageIndex{1}}): Empirical Formula of Ascorbic Acid
A amostra de 6,49-mg de ácido ascórbico (vitamina C) foi queimada em um trem de combustão. Foram formados 9,74 mg de CO2 e 2,64 mg de H2O. Determinar a fórmula empírica do ácido ascórbico.
Solução Precisamos saber a quantidade de C, a quantidade de H, e a quantidade de O na amostra. A proporção destes dá os subscritos na fórmula. As duas primeiras podem ser obtidas a partir das massas de CO2 e H2O usando as massas molares e as razões estequiométricas
>
>
Assim
O composto também pode ter contido oxigênio. Para ver se contém, calcular as massas de C e H e subtrair da massa total da amostra
>
>
>
>
> Assim temos
>
>
>
>
>
>
>As proporções das quantidades dos elementos em ácido ascórbico são portanto
>
>
>
>
>>
>>
>>
>Desde nC:nH:nO é 3 mol C:4 mol H:3 mol O, a fórmula empírica é C3H4O3.
Um desenho de uma molécula de ácido ascórbico é mostrado aqui. Você pode determinar contando os átomos que a fórmula molecular é C6H8O6-exatamente o dobro da fórmula empírica. É também evidente que há mais a saber sobre uma molécula do que apenas quantos átomos de cada tipo estão presentes. No ácido ascórbico, como em outras moléculas, a forma como os átomos estão ligados entre si e a sua disposição no espaço tridimensional são bastante importantes. Uma imagem mostrando que átomos estão ligados a que se chama uma fórmula estrutural. As fórmulas empíricas podem ser obtidas a partir de experiências de composição percentual ou de combustões, e, se o peso molecular for conhecido, as fórmulas moleculares podem ser determinadas a partir dos mesmos dados. Experiências mais complicadas são necessárias para encontrar fórmulas estruturais. No Exemplo 2, obtemos a massa de O subtraindo as massas de C e H da massa total da amostra. Isto supôs que apenas C, H e O estavam presentes. Algumas vezes essa suposição pode estar incorreta. Quando a penicilina foi isolada e analisada pela primeira vez, o facto de conter enxofre foi omitido. Este erro não foi descoberto durante algum tempo porque o peso atómico do enxofre é quase o dobro do peso do oxigénio. Dois átomos de oxigênio foram substituídos por um átomo de enxofre na fórmula.
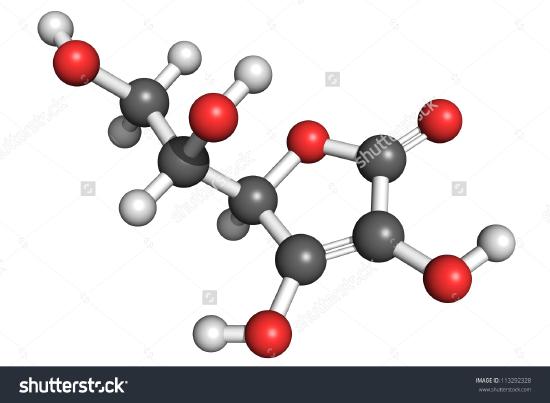
>
Figure \(\PageIndex{2}) Uma representação 3D do Ácido L-Ascórbico 1
De ChemPRIME: 3.4: Análise de Compostos