Um adduct (do latim adductus, “atraído para” alternativamente, uma contração de “produto de adição”) é um produto de uma adição direta de duas ou mais moléculas distintas, resultando em um único produto de reação contendo todos os átomos de todos os componentes. O produto resultante é considerado uma espécie molecular distinta. Exemplos incluem a adição de bissulfito de sódio a um aldeído para dar um sulfonato. Pode ser considerado apenas como um único produto resultante da combinação direta de diferentes moléculas que compreende todos os átomos das moléculas reagentes.
Adducts frequentemente se formam entre os ácidos Lewis e as bases Lewis. Um bom exemplo é a formação de adutos entre o borano ácido de Lewis e o átomo de oxigênio nas bases de Lewis, o tetrahidrofurano (THF): BH3-O(CH2)4 ou éter dietílico: BH3-O(CH3CH2)2. Muitos ácidos de Lewis e bases de Lewis reagindo na fase gasosa ou em solventes não aquosos para formar adutos têm sido examinados no modelo ECW. Trimethylboron, cloreto de trimetilestanho e bis(hexafluoroacetonato)cobre(II) são exemplos de ácidos Lewis que formam adutos que exibem efeitos estéreis. Por exemplo: o cloreto de trimetilestanho, quando reage com éter dietílico, exibe repulsão estéril entre os grupos metilo no Sn e os grupos etilo no oxigénio. Mas quando a base de Lewis é tetrahidrofurano, a repulsão estéril é reduzida. O modelo ECW pode fornecer uma medida destes efeitos estéreis.
-
>
THF
-
BH3 molécula
-
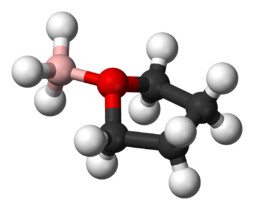
Lewis adduct entre BH3 e THF
Compostos ou misturas que não podem formar um adduct por causa de impedimento estéreo são chamados de pares Lewis frustrados.
Adducts não são necessariamente de natureza molecular. Um bom exemplo da química de estado sólido são os adutos de etileno ou monóxido de carbono de CuAlCl4. Este último é um sólido com uma estrutura de malha estendida. Após a formação do aduto, forma-se uma nova fase estendida na qual as moléculas de gás são incorporadas (inseridas) como ligandos dos átomos de cobre dentro da estrutura. Esta reacção também pode ser considerada uma reacção entre uma base e um ácido de Lewis com o átomo de cobre na função de recepção de electrões e os electrões pi da molécula de gás na função de dádiva de electrões.


