O princípio mais geral que rege a força ácida pode ser afirmado assim: ácidos fortes têm bases conjugadas relativamente estáveis. Em geral, quanto mais estável for a base conjugada, mais forte será o ácido. Uma coisa importante a lembrar é que a estabilidade e a reatividade são inversas. Quanto mais estável é uma substância, menos reativa ela é, e vice-versa. Portanto, outra forma de afirmar a regra acima é dizendo que ácidos fortes têm bases conjugadas fracas. HCl e H3O+ são ácidos fortes. Consequentemente, as bases conjugadas correspondentes, Cl- e H2O, são fracas (muito estáveis). O íon cloreto é estável porque a carga negativa reside em um átomo muito electronegativo. A molécula da água é uma das substâncias mais estáveis conhecidas.
Como sabemos qual protão é o mais ácido de uma molécula (como o ácido acético) que contém mais de um tipo de protão? Lembre-se que quanto maior o grau de caráter positivo no próton, mais ácido ele é. O exame de uma tabela pKa revela algumas tendências para prótons ácidos. As seguintes diretrizes podem ser usadas para prever a acidez.
1. Hidrogênios diretamente ligados a átomos muito eletronegativos como oxigênio, enxofre e os halógenos carregam um grau substancial de acidez.
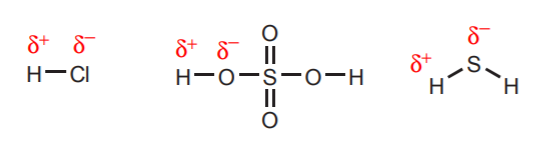
2. Hidrogênios ligados a um nitrogênio, oxigênio ou enxofre com carga positiva são ácidos. A alta eletronegatividade desses átomos os torna desconfortáveis com a carga positiva. Eles procuram difundir a carga entre os átomos vizinhos, retirando-lhes a densidade de elétrons. Isto pode ser demonstrado pelo desenho de estruturas de ressonância como mostrado.
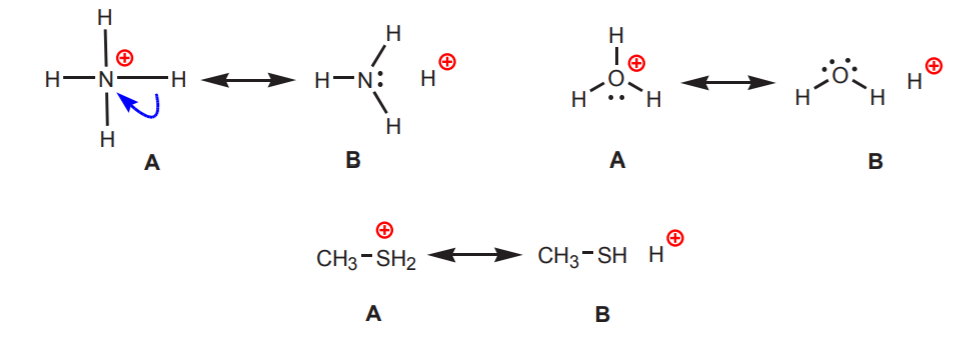
Em todos os casos a estrutura B revela o caráter positivo do hidrogênio e, portanto, sua natureza ácida.
3. Como evidenciado pelos valores de pKa de alcanos e alcenos, os hidrogênios ligados ao carbono são de muito baixa acidez. Tais substâncias não são normalmente consideradas ácidos de todo. No entanto, alguns hidrocarbonetos podem ser fracamente ácidos se as suas bases conjugadas forem iões estáveis. Isto pode acontecer nos seguintes casos.
a) Existe um ou mais átomos electronegativos perto do protão em consideração. O efeito indutivo destes átomos electronegativos deixa os hidrogênios nas proximidades privados de densidade de elétrons, e portanto com caráter parcialmente positivo.
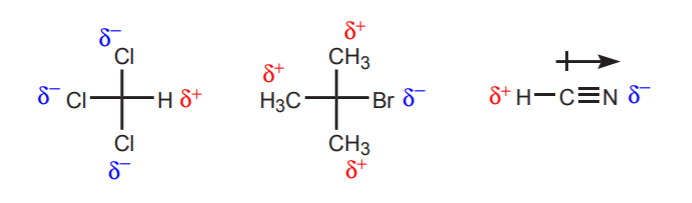
b) Um átomo de hidrogênio ligado a um carbono que por sua vez está ligado a outro carbono que carrega uma carga positiva parcial ou total é ácido.
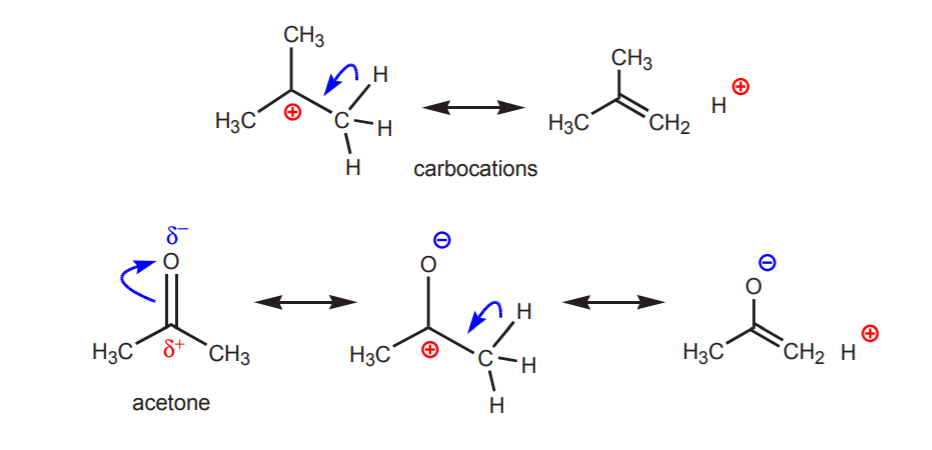
> A acidez dos prótons mostrados torna-se aparente nas reações de eliminação (capítulo 6) e na química dos enóis (capítulo 22), quando a presença de uma base leva à formação de alcenos ou íons enolados através de um passo envolvendo uma transferência de prótons.
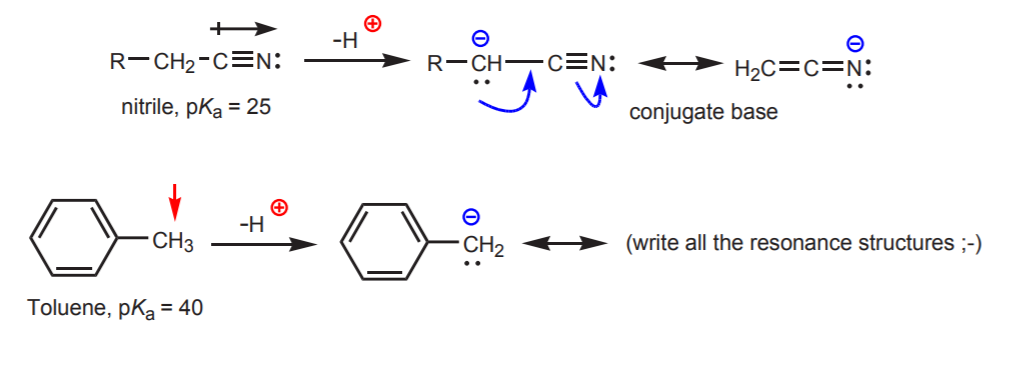
c) A base conjugada é estabilizada por ressonância. Este efeito é mais importante quando existe outro factor que aumenta a acidez, como a presença de um átomo dipolo ou electronegativo (como no grupo funcional nitrilo, -CN). Caso contrário a estabilização por ressonância por si só não é suficiente para aumentar drasticamente a acidez de um hidrogênio ligado ao carbono (como no tolueno, onde o pKa é apenas 40).
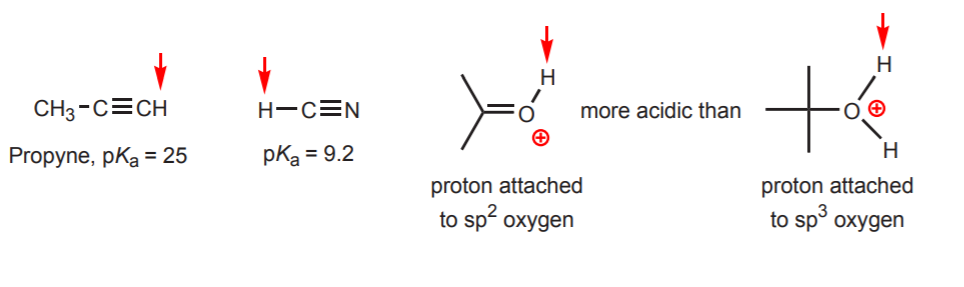
d) O hidrogênio é ligado a um carbono espiral-hibridizado. Os efeitos da hibridização sobre a acidez são discutidos no capítulo 9. As tendências da hibridação podem ser estendidas ao oxigênio e nitrogênio além do carbono, como no exemplo à direita.
>