Introdução
Talvez a primeira referência na história humana à absorção de ferro e álcool remonte a 1200 AC, uma lenda da Tessália conta como Apolodoro de Ífigo, de pé num campo a observar o seu pai a castrar cordeiros, foi ameaçado pelo mesmo castigo; quando se tornou adulto, Apolodoro era impotente. Um feiticeiro chamado Melampus, inspirado por um abutre, curou Apolodorus fazendo-o beber num copo de vinho a ferrugem da faca com que o seu pai castrava os cordeiros e com que tinha sido ameaçado.
Numerosa é a população de doentes alcoólicos atendidos no nosso hospital, bem como os que necessitam de hospitalização, tendo em conta todas as entidades mórbidas que a acompanham.
O nosso objectivo através desta comunicação é recordar uma das patologias hematológicas presentes no alcoolismo que muitas vezes pode regredir com abstinência apenas: a anemia sideroblástica e a hemossiderose.
Bjorkman em 1956 descreveu quatro pacientes com anemias refratárias crônicas e anéis sideroblásticos com coloração azul da Prússia de células da medula óssea.
A primeira evidência de que esses anéis sideroblastos estavam associados ao álcool foi proposta por Mac Gibbon e Mollin em 1965, desde quando o alcoolismo se tornou a causa mais comum dessa patologia.
Em 1969 Hines (substituindo o i por um 1) descreveu no alcoolismo crônico a ocorrência de uma anemia sideroblástica reversível devido à abstinência.
Efeitos do álcool
Os múltiplos efeitos patológicos do álcool(substituir por 2) no tecido hematopoiético podem ser divididos em
Das resultantes do efeito direto do álcool
Das resultantes de efeitos secundários a deficiências nutricionais
Das causadas por doenças hepáticas
Anemia é uma causa comum em alcoólicos.(substituir por 3) Destes, os mais comuns são a anemia megaloblástica e a anemia sideroblástica.
Esta última estaria relacionada a fatores nutricionais e distúrbios no metabolismo da vitamina B6.
Diminuição da capacidade de conversão da piridoxina em fosfato piridoxal, a forma ativa da vitamina B6, tem sido demonstrada como resultado da inibição da atividade da eritrocite piramidoxal fosfoquinase.
Também tem sido sugerido que o etanol pode atuar como estimulante da fosfatase alcalina da membrana acelerando a degradação do fosfato piramidal piridoxal (substituir por 4). Esta alteração no metabolismo da piridoxina é corroborada por uma diminuição na excreção urinária do ácido piridóxico 4 piridóxico, que é um metabolito da piridoxina, e uma diminuição do fosfato sérico piridoxal.
O fosfato piridoxal também atua como fator adjuvante na síntese do ácido delta-aminolevulínico, que é um dos precursores da fração da hemoglobina contendo ferro, ou seja, a hemoglobina.
Outros estudos têm demonstrado que o etanol age não apenas diretamente, mas também através de seu metabolito acetaldeído. O acetaldeído também tem sido creditado com o aumento da degradação do fosfato piridoxal, levando a uma diminuição do fosfato piridoxal sérico e piorando a formação do fosfato piridoxal nos glóbulos vermelhos humanos in vitro, acelerando a degradação dos compostos fosforados de vitamina B6.
Quando são utilizados métodos de coloração com ferro (azul da Prússia e pérolas), grânulos metálicos não contendo ferro heme, presumivelmente na forma de hemossiderina ou ferritina tendem a formar um anel em torno do núcleo de eritroblastos. Estes são chamados anéis sideroblastos ou anéis sideroblastos.
A microscopia eletrônica mostrou que estes sideroblastos têm os depósitos de ferro ao nível das mitocôndrias ou corpos citoplasmáticos.
Essas anormalidades morfológicas estão associadas a todas as características da eritropoiese ineficaz: hiperplasia eritróide, aumento da absorção de ferro pelos precursores eritróides da medula óssea, incorporação subnormal de ferro na hemoglobina circulante com refluxo de ferro na circulação, causando hiperferremia, destruição intra-marticular de normoblastos, anemia e reticulocitopenia.
A frequência do anel sideroblástico na medula eritróide é mais freqüente no paciente crônico, e em pacientes alcoólicos desnutridos.
Provas clínicas e experimentais sugerem que um fator nutricional é importante na patogênese da anemia sideroblástica em pacientes alcoólicos.
A administração crônica experimental de álcool em voluntários humanos tem produzido alterações sideroblásticas na medula óssea.
Quando o álcool era administrado com piridoxina e folato dietéticos baixos, anéis de
sideroblastos desenvolveram-se após várias semanas na maioria dos sujeitos estudados.
Em 1970 Hines and Cowan mencionam uma alteração na fosforilação da piridoxina para fosfato piridoxal, confirmando assim a desordem no metabolismo da piridoxina por três linhas de pesquisa:
Fosfato piridoxal e anéis sideroblásticos desencarnados foram produzidos em 2 de 3 sujeitos que foram mantidos em dietas de baixo teor de folato com suplementação de álcool. Em seguida, mostraram uma resposta hematológica após a administração de fosfato piridoxal, mas não com ácido fólico ou terapêutica com piridoxina.
Após a administração de piridoxina em alcoólatras cronicamente doentes, há uma deficiência na formação de fosfato piridoxal em comparação com os controles.
Descrevem uma redução in vitro da conversão da piridoxina em fosfato piridoxal por uma enzima eritrócita em sujeitos alcoólicos. Isto leva a postular a supressão direta da piridoxina fosforilase de eritrócitos pelo álcool. Entretanto, uma explicação alternativa para a diminuição do fosfato piridoxal sugere que o acetaldeído, o principal metabolito do álcool, estimula a atividade da fosfatase da membrana e também reduz a quantidade de fosfato piridoxal transferido do glóbulo vermelho para o compartimento plasmático.
No entanto, independentemente do mecanismo, o resultado é o mesmo, todos levando a um aumento na quantidade de Fe contidos nos eritroblastos (sideroblastos)
Sideroblastose envolve má incorporação de ferro nos glóbulos vermelhos resultando em hipocromia, eritropoiese ineficaz, e aumento da sideremia.
Hemossiderose em alcoólicos(substituir por 5) Uma grande variedade de causas de sobrecarga de ferro em alcoólicos tem sido implicada sozinha ou coletivamente, incluindo o aumento significativo de ferro de algumas bebidas alcoólicas(especialmente vinhos), aumento da secreção gástrica de ácido clorídrico, hemólise, perda de sangue gastrointestinal, deficiência de ácido fólico, aumento da absorção intestinal devido a lesão hepática e dano pancreático, aumentando ainda mais a sideremia e resultando em hemossiderose.
Estudos transversais documentam aumento dos níveis de ferritina sérica em pacientes alcoólicos, refletindo o aumento das reservas de ferro.
Após a administração de quelantes de ferro, como a desferroxamina e posterior mensuração da siderúria, as reservas de ferro podem ser avaliadas de forma semi-quantitativa. Em alcoólicos a excreção de ferro após esses quelantes também é aumentada em relação aos controles.
Entretanto, outros estudos mostram em pacientes alcoólicos hospitalizados que as concentrações séricas de ferro e/ou ferritina estão dentro dos limites normais ou menos comumente elevadas. Estas diferenças podem ser devidas à escolha dos pacientes incluídos no estudo; se os pacientes têm sangramento gastrointestinal devido a varizes esofágicas, podem ter esgotado as reservas de ferro, mesmo se antes do sangramento eram superiores ao normal.
Finalmente, vale ressaltar que na maioria dos estudos realizados para medir o ferro sérico, sempre se constatou que estes estavam elevados em alcoólicos, com correlação entre os depósitos de ferro e a quantidade de álcool consumida, sugerindo que este elemento é a causa da siderose.
Absorção de ferro
Apenas 5 a 15 mg de ferro ingerido diariamente, apenas 10% é absorvido.
Factores que influenciam a absorção de ferro podem intervir a três níveis: intraluminal, mucosa e geral.
A nível intraluminal, sabe-se que a absorção do ferro depende da interacção de diferentes alimentos, de modo que alguns, como os aminoácidos, facilitam a absorção e outros podem diminuí-la. A ausência de secreções digestivas pode ser um fator que modifica a absorção.
Numa tentativa de explicar a hemossiderose, pensou-se inicialmente que a dieta dos pacientes alcoólicos era muito rica neste elemento. Esta observação foi baseada no que é chamado de hemossiderose bantus ou bantus haemosiderosis. Estudos realizados por sul-africanos sobre estas tribos descobriram que uma bebida que eles preparavam chamada kefir, uma espécie de cerveja, era fabricada em recipientes de ferro, com um teor de ferro de 30 a 100 mg por litro. O teor alcoólico da bebida era muito baixo, e consumiam grandes quantidades da mesma, até 1000 mg de ferro por dia. O fabrico do kefir já não se faz com o consequente desaparecimento da hemossiderose nesta tribo.
As quantidades de ferro presentes nas diferentes bebidas alcoólicas são muito variáveis, atingindo em alguns casos até 350 mg por litro (Roménia), embora em geral se possa considerar que o vinho (branco, claret ou tinto) é rico neste metal.
Mas também há muitos alcoólicos cuja principal bebida não é o vinho, mas o whisky, a cerveja ou outros, que contêm quantidades insignificantes de ferro.
Por outro lado, apesar do estudo sobre o bantus, um excesso de ferro na dieta não é razão suficiente para desenvolver a hemossiderose. Assim, na Etiópia, a base da dieta é o teff, uma semente que contém uma grande quantidade de ferro, com uma ingestão diária de 300 a 500 mg deste metal. Apesar desta ingestão, os depósitos não aumentam e a frequência da anemia por deficiência de ferro não é diferente da população em geral.
É óbvio então que a quantidade de ferro nos alimentos não tem valor.
Até agora parece que o álcool não desempenha qualquer papel a nível intraluminal na absorção do ferro.
A nível geral sabe-se que o estado das reservas de ferro irá condicionar a sua absorção; se estas forem diminuídas, a absorção aumenta e vice-versa. A eritropoiese também está envolvida a este nível, aumentando a sua absorção quando ela aumenta. O álcool não parece acelerar a virada do ferro plasmático, o que poderia explicar o aumento da sua absorção.
Ao nível da mucosa, a quantidade de ferro contida na mucosa, bem como o nível de síntese de proteínas, pode influenciar a absorção de ferro. Foi demonstrado que a deficiência de ácido fólico após a ingestão de álcool pode ser responsável pelo aumento da absorção de ferro e subsequente siderose, o que agrava os efeitos nocivos do álcool no parênquima e mais especialmente no fígado.
Em estudos com animais foi demonstrado que a administração crônica de álcool pode ser acompanhada por um aumento na absorção intestinal de ferro, cujo mecanismo é desconhecido.
Foram demonstrados pelo menos três mecanismos envolvidos na translocação do ferro através da mucosa duodenal na última década:
Transportador-mediado (regulado)
Mecanismo passivo mediado por ácidos gordos nãoesterificados
(Não regulado) entrada paracelular
Estudos in vivo e in vitro mostraram aumento da permeabilidade intestinal em alcoólicos crónicos oferecendo um possível mecanismo de absorção de ferro intestinal.
Outros estudos sugerem que pode haver um aumento da capacidade intrínseca da mucosa intestinal de pacientes alcoólicos de ingerir ferro.
Foi observado que naqueles com aumento do ferro sérico, as medidas do ferro diminuíram durante a primeira semana de hospitalização com desenvolvimento de reticulócitos. Também foi observado que as alterações sideroblásticas foram reversíveis de acordo com outros autores. Os anéis característicos desapareceram da medula durante a primeira semana de hospitalização, embora alguns tenham persistido durante doze dias.
Recentemente (substituir por 6) foram encontrados níveis aumentados de asialotransferrina sérica em pacientes com alcoolismo crônico; isso mostra uma maior capacidade de liberar ferro para os tecidos, especialmente hepatócitos, em comparação às variantes normais de transferrina.
Tem sido apontado que também pode haver uma forte relação entre alterações sideroblásticas e deficiências de folato. Sugere-se que essa deficiência pode ser a condição prévia necessária para a expressão de alterações sideroblásticas em alcoólicos, embora outros autores discordem, pois apesar de marcada anemia não apresentavam alterações megaloblásticas na medula e nenhuma macrocitose ou hipersegmentação neutrofílica no sangue periférico e as concentrações séricas e de folato eritrócito eram normais.
É importante notar que em pacientes alcoólicos, a anemia de doenças crônicas por tuberculose, doenças malignas ou insuficiência renal está freqüentemente associada à anemia sideroblástica, que é muito comum nessa população.
Em resumo, a ingestão de álcool juntamente com uma dieta inadequada é susceptível de levar ao desenvolvimento de anemia sideroblástica e hemossiderose cuja patogénese ainda não está estabelecida e os factores prováveis incluem:
Efeito tóxico do álcool em uma ou mais etapas da síntese da hemorragia.
Associação com mau estado nutricional levando ao esgotamento do fosfato em piridoxal e catabolismo acelerado causado por acetaldeído, doença hepática ou ambas
Falta de folato exacerbado e onde a retirada e reposição nutricional desempenham um papel importante.
Caso Clínico:
Paciente do sexo masculino, 55 anos, admitido com edema dos membros inferiores (1/6 suprapatellar, 2/6 infrapatellar) e sacro de consistência mole, distensão abdominal, palidez da mucosa, astenia e adinamia progressiva de três meses de duração.
História:
Alcoolismo crônico (2 ou 3 litros de vinho e/ou cerveja por dia) e tabagismo (40 cigarros por dia), ambos nos últimos 30 anos.
Resultados dos estudos realizados na enfermaria:
Raio-X do tórax: derrame do seio costodiafragmático direito. Índice cardiotorácico ligeiramente aumentado.
Paracentese: características exsudativas.
Transfusões: Devido à transfusão HTO. de 2 unidades de hemácias desplasmadas indicadas.
Diagnóstico presuntivo:
Etiológico: Etilismo crônico. Tabagismo.
Patofisiológico: Síndrome ascitico-edematosa. Síndrome ascítico-edematosa. Mancha ascítico-edematosa. Anémica. Efusão pleural. Insuficiência hepática.
Anatomopatológico: Hepatomegalia. Cardiomegalia.
Resultados dos estudos realizados durante a hospitalização:
FEDA: Gastrite crônica.
Enema de duplo contraste no cólon: Trânsito intestinal preservado.
Equocardiograma: Efusão pericárdica moderada.
Ecopleural: Efusão pleural direita.
Ecoabdominal: Fígado compatível com fígado gorduroso.
Serologia: negativa para VDRL, Chagas, Hepatite B e C.
PAMO e BMO: Medula óssea com dispersões graves da série vermelha.
Perls: são observados grânulos de ferro intra e extracelular aumentados.
PBH: o material obtido foi pouco representativo para conclusão diagnóstica.
Laboratório
Hematócrito (%): variou de 11.8 a 19
Células de sangue vermelho (x10E12/l): apresentou uma variação de 1,1 a 1,94
Células de sangue branco (x10E9/l): apresentou uma variação de 7,7 a 9.2
Hemoglobina (g/dL): variou de 4,4 a 6.8
Platelets (x10E9/l): variou de102 a 346
Ferremia (mg/dl): variou de248 a 75
Ferritina (ng/dl): 594
TIBC (Capacidade Total de Ligação de Ferro) (mg/dl): 360
Porcentagem de Saturação da Transferrina: apresentou uma variação de 95 a 24
Total Bilirrubina (mg/dl): apresentou uma variação de 1.6 a 0,51
Bilirrubina Direta (mg/dl): mostrou uma variação de 1,92 a 0,18
Bilirrubina Indireta (mg/dl): mostrou uma variação de 2,99 a 0,33
Tratamento Médico:
Alimentação com hipossódio e baixa proteína. Restrição de água.
PHP a 21 gotas por minuto alternadamente. Albumina um frasco em paralelo a cada 8 horas, seguido de uma ampola de furosemida. Spironolactone um comprimido a cada 12 horas. Phytomenadione (Konakion) uma ampola a cada 12 horas.
Lactulose (Lactulon) uma colher de sopa a cada 6 horas. Vitamina B complexa um comprimido a cada 12 horas.
Devem ser respondidos pelo paciente, o tratamento médico oral com diuréticos e complexo B é continuado. A lactulose e fitomenadiona foram descontinuadas.
O paciente apresentou evolução clínica favorável ao seu estado edematoso ascítico, razão pela qual teve alta, sendo medicado com vitamina B e aconselhado a não ingerir álcool.
Continuação do seu controlo médico pelas clínicas ambulatórias da Clínica Médica do nosso Hospital e pelo Serviço de Hematologia do Hospital Álvarez…
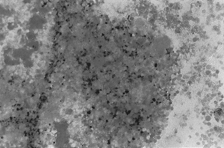
PAMO X 100
– Coloração Perls. Destaca-se um caroço medular com intensa deposição de ferro extracelular.
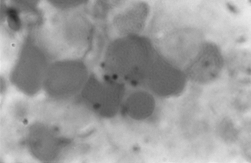
PAMO X 1000
– Coloração Perls. Observa-se a deposição de ferro intra-aritroblástico.
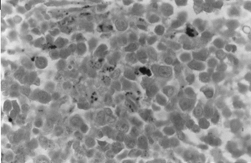
BMOX100
– Coloração Perls. Onde são observadas densas acumulações de ferro intra e extra-eritroblástico.
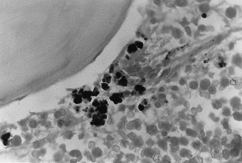
BMO X 1000
– Coloração Peris. Onde são observadas densas acumulações intra e extraitroblásticas de ferro.
O paciente teve uma boa evolução pós-internação. Aos sessenta dias fez um exame de sangue com os seguintes resultados: HTO 43%, GR 5,1 X 10E12/L, GB 8,7 X10E9/L, HB 13,9 g/di, Plaq.354 X10E9/L, apenas com adesão ao tratamento.
Após cento e vinte dias foi novamente monitorizado com os mesmos resultados dos exames de sangue.
Após cento e vinte dias foi novamente monitorizado com os mesmos resultados dos exames de sangue.
Após cento e vinte dias foi novamente monitorizado com os mesmos resultados dos exames de sangue.