Structure, Dynamics, and Function of Aquaporins
 2004 Winner of Visualization Challenge in Science and Engineering,
2004 Winner of Visualization Challenge in Science and Engineering, Organizowane przez National Science Foundation i Science Magazine. (Zobacz powiązany artykuł Science.)
Nasz film o przenikaniu wody i nagroda Nobla 2003 w dziedzinie chemii
Sztuka transportu wody w akwaporynach
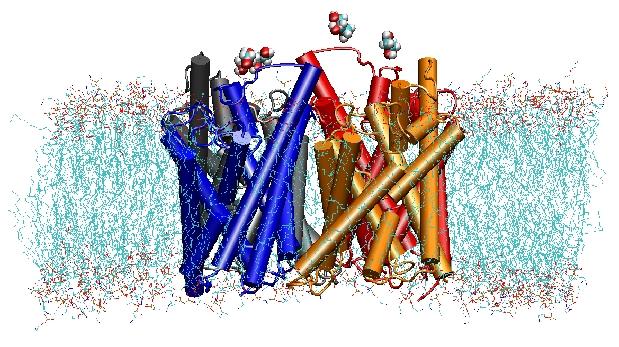
Akwaporyny są błonowymi kanałami wodnymi, które odgrywają kluczową rolę w kontrolowaniu zawartości wody w komórkach. Kanały te są szeroko rozpowszechnione we wszystkich królestwach życia, w tym u bakterii, roślin i ssaków. W organizmie człowieka znaleziono ponad dziesięć różnych akwaporyn, a kilka chorób, takich jak zaćma wrodzona i cukrzyca nefrogenna, jest związanych z zaburzoną funkcją tych kanałów. Tworzą one tetramery w błonie komórkowej i ułatwiają transport wody oraz, w niektórych przypadkach, innych drobnych rozpuszczalników przez błonę. Jednakże, pory wodne są całkowicie nieprzepuszczalne dla cząsteczek naładowanych, takich jak protony, co jest właściwością krytyczną dla zachowania potencjału elektrochemicznego błony, ale jednocześnie paradoksalną, ponieważ protony mogą być łatwo przenoszone przez cząsteczki wody. Wyniki naszych symulacji pozwoliły na nowe spojrzenie na mechanizm leż±cy u podstaw tej fascynuj±cej wła¶ciwo¶ci. Cz±steczki wody przechodz±ce przez kanał s± zmuszone, przez siły elektrostatyczne białka, do odwrócenia się w centrum kanału (zobacz animację), przełamuj±c w ten sposób alternatywny układ donor-akceptor, który jest niezbędny do translokacji protonów (przeczytaj cał± historię w naszej pracy naukowej).

Funkcjonalne implikacje osobliwej architektury białka
W 2000 r. laboratorium Strouda w UCSF zdołało rozwiązać pierwszą strukturę akwaporyny o wysokiej rozdzielczości za pomocą krystalografii rentgenowskiej. Badana struktura to struktura ułatwiacza wychwytu E. coliglycerol (GlpF), która jest akwagliceroporyną, tzn. kanał jest również przepuszczalny dla małych liniowych cząsteczek cukru, takich jak glicerol. Nanosekundowe symulacje MD tetramerycznego GlpF w uwodnionej łacie warstwy lipidowej POPE scharakteryzowały kompletny szlak przewodzenia substratów w kanale. Analiza oddziaływań substratu z wnętrzem kanału za pomocą wiązań wodorowych po raz pierwszy wyjaśniła, dlaczego kanały te zawierają w swojej architekturze dwie charakterystyczne pętle, zawierające niekorzystne energetycznie elementy struktury wtórnej, które są konserwowane w całej rodzinie akwaporyn (Jensen i in, Structure, 2001).
Energetics of Sugar Permeation
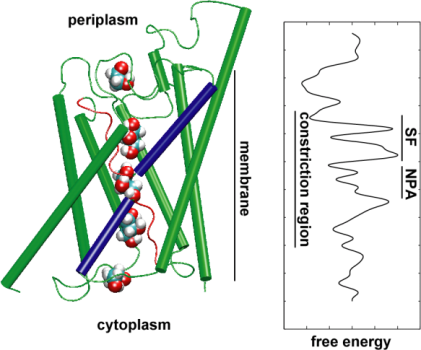
Następnie zbadaliśmy energetykę tego zdarzenia transportowego, aby zrozumieć, jakie bariery musi pokonać substrat podczas jego przejścia przez kanał. W celu opisania profilu energii swobodnej, obliczyliśmy potencjał średniej siły dla kompletnego zdarzenia przewodzenia z trajektorii, w których ruch glicerolu przez kanał został przyspieszony przez zastosowanie siły zewnętrznej. Technika ta, znana jako sterowana dynamika molekularna (SMD), pozwala na obserwację powolnych zdarzeń w dostępnej skali czasowej symulacji MD. Jednakże, ze względu na nierównowagową naturę trajektorii, przy analizie wyników pojawia się problem pracy nieodwracalnej, którą należy policzyć. Wykorzystując tożsamość Jarzinsky’ego, równość pomiędzy energią swobodną i pracą w układach nierównowagowych, mogliśmy w pełni opisać energetykę transportu glicerolu przez kanał. Obliczony potencjał średniej siły wychwytuje główne miejsca wiązania i bariery w kanale w ścisłej zgodności z wynikami równowagowych symulacji MD i strukturą krystaliczną. Ponadto, wykazuje on wyraźną asymetrię kształtu, co sugeruje, że asymetryczna struktura białka może być funkcjonalnie ważna dla efektywnego pobierania cząsteczek odżywczych z otoczenia. (Jensen, etal., PNAS, 2002).
What Makes an Aquaporin a Glycerol Channel
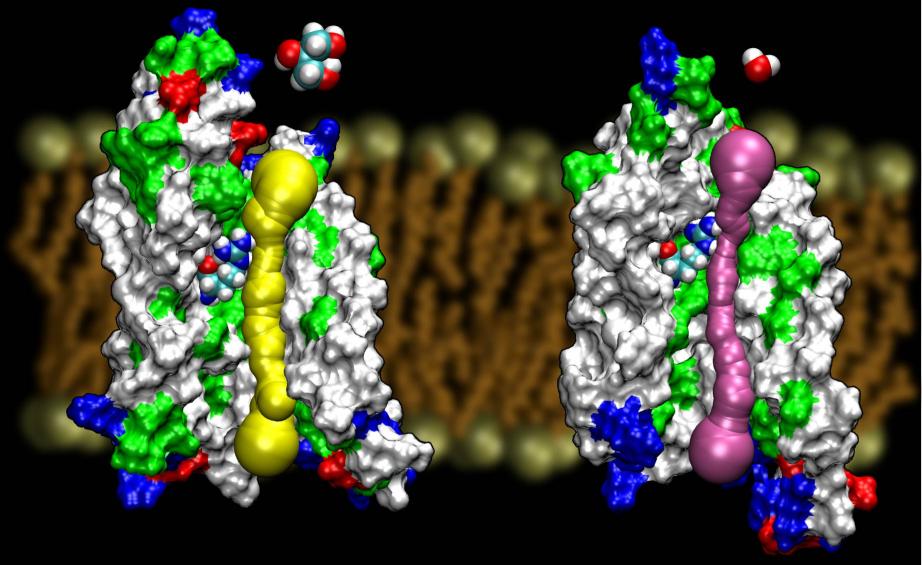
Akwaporyny są bardzo szczęśliwą rodziną białek błonowych, które są notorycznie oporne na określenie struktury. Mamy wysokiej rozdzielczości struktury kilku AQPs: GlpF, AQP1, AQP0, iAqpZ. Oczekuje się, że wkrótce pojawią się kolejne struktury. Dostępność struktur dwóch AQPs z E. coli, jednego będącego kanałem czystej wody (AqpZ) i drugiego będącego kanałem glicerolowym (GlpF) dała nam unikalną możliwość zrozumienia zasad selektywności stosowanych przez naturę w używaniu dwóch genetycznie i strukturalnie wysoce homologicznych kanałów do transportu błonowego różnych materiałów. Porównanie barier obliczonych dla przewodzenia glicerolu w tych dwóch kanałach wykazało, że AqpZ wykorzystuje bariery steryczne, aby utrudnić przejście glicerolu. W rzeczywistości, por jest w sumie węższy niż GlpF (patrz rysunek poniżej). Wygląda na to, że natura sięgnęła po bardzo podstawowy mechanizm, a mianowicie dostrajanie wielkości porów kanału, aby dwa białka z tej samej rodziny wykazywały różne właściwości przewodzenia. Przeczytaj całą historię w Wang, etal., STRUCTURE, 2005.
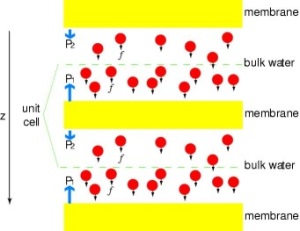
Putting Channels under Pressure
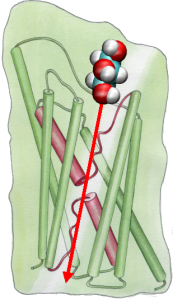
W celu bezpośredniego porównania wyników symulacji MD z biochemicznymi pomiarami przewodnictwa błonowych kanałów wodnych, w których osmotyczne gradienty ciśnienia są wykorzystywane do indukowania przepływu wody przez membranę, opracowaliśmy nową metodologię symulacji MD. Poprzez przyłożenie małych sił do cząsteczek wody w obszarze objętościowym (patrz rysunek), generowany jest gradient ciśnienia hydrostatycznego w poprzek membrany. Gradient ciśnienia indukuje szybkość przewodzenia, która może być badana za pomocą symulacji MD, które są zwykle ograniczone do kilku nanosekund. Metoda ta została zastosowana do symulacji przenikania wody przez GlpF i dała liniową korelację pomiędzy zastosowanym ciśnieniem a strumieniem (Zhu et al.,Biophys. J., 2002).
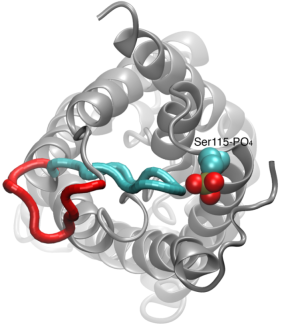
Gating of Water Channels
Przenikanie wody przez akwaporyny jest procesem pasywnym, który podąża za kierunkiem ciśnienia osmotycznego przez błonę. Chociaż wiele akwaporyn funkcjonuje jako kanały zawsze otwarte, podgrupa akwaporyn, szczególnie u roślin, rozwinęła wyrafinowany mechanizm molekularny, dzięki któremu kanał może być zamknięty w odpowiedzi na trudne warunki środowiska, w których wymiana wody może być szkodliwa dla organizmu. Przykładem takich warunków jest stres suszy i zalania, które wyzwalaj± okre¶lone sygnały komórkowe (deposforylacja i zmiana pH) powoduj±ce zamknięcie kanału. Niedawno rozwiązana struktura akwaporyny ze szpinaku była symulowana w różnych warunkach w celu zbadania molekularnego mechanizmu bramkowania w tych kanałach membranowych. Stwierdzono, że wydłużona pętla cytoplazmatyczna w akwaporynach zdolnych do bramkowania fizycznie zasłania wejście do porów wodnych w zamkniętym kanale i blokuje dostęp cząsteczek wody do porów. Przemieszczenie tej pętli w odpowiedzi na fosforylację, jak zaobserwowano w symulacjach, usuwa pętlę z cytoplazmatycznego wejścia do porów. Co więcej, hydrofobowy aminokwas, który jest konformacyjnie blisko sprzężony z tą pętlą, zostanie odciągnięty z kanału w wyniku przemieszczenia pętli. Razem, te wydarzenia molekularne prowadzą do powstania otwartego kanału, który jest przepuszczalny dla cząsteczek wody. Badanie ukazało się w Nature2006.

Gating and Ion Conductivity of the Tetrameric Pore
AQPs są ogólnie znane z ich wysokiej przepuszczalności dla wody. Jednakże sugeruje się ich zaangażowanie w inne funkcje komórkowe, w tym przenikanie małych cząsteczek innych niż woda, jak również w komunikację komórka-komórka. Tetrameryzacja jest wspólną cechą strukturalną AQPs. Fakt, że cztery monomery tworzą funkcjonalnie niezależne pory wodne, ale wymagają organizacji tetramerycznej do funkcjonowania, sugeruje synergistyczną korzyść z oligomeryzacji, a zatem zmusza do dalszej analizy potencjalnej roli centralnej pory w AQPs. Interesuj±c± propozycj± jest możliwy udział centralnego pora w przewodzeniu jonów po aktywacji cGMP. Wykorzystuj±c symulacje MD modeli AQP1 osadzonych w błonie, zbadali¶my tę wła¶ciwo¶ć AQP1, aby ustalić, w jaki sposób, w jakich warunkach konformacyjnych i hydratacyjnych, por centralny może przewodzić jony i jak regulowane jest to przewodnictwo. Jedna z pętli cytoplazmatycznych, mianowicie bogata w argininę pętla D, została zasugerowana w naszych symulacjach jako odgrywaj±ca kluczow± rolę w cGMP-mediowanej aktywacji centralnego pora. Sugerowana rola pętli D została zweryfikowana doświadczalnie przez zaprojektowany mutant pętli D wykazujący całkowitą utratę przewodnictwa jonowego ( Yu et al.,Structure, 2006 ) .
Cząsteczki gazu dojeżdżają do komórki
Każdego ranka wiele osób jedzie do pracy samochodem, podczas gdy inni mogą jeździć rowerem, autobusem lub metrem.Podobnie, różne biomolekuły w ludzkim ciele również docierają do miejsca przeznaczenia w różny sposób. Na przykład, aby przekroczyć błonę komórkową, małe hydrofobowe cząsteczki gazu dyfundują przez warstwę lipidową, podczas gdy cząsteczki wody przechodzą przez akwaporyny (AQPs).Co ciekawe, tak jak do pracy można dojechać zarówno autobusem, jak i samochodem, tak ostatnio odkryto, że niektóre cząsteczki gazu mogą mieć więcej niż jedną drogę do przekroczenia błony, tzn, Wykorzystując dynamikę molekularną przeprowadzoną za pomocą NAMD, zbadaliśmy przepuszczalność gazową AQP1 za pomocą dwóch komplementarnych metod (symulacja jawnej dyfuzji gazu i implicite ligandsampling). Wyniki symulacji sugerują, że podczas gdy czteromonomeryczne pory AQP1 funkcjonują jako kanały wodne, centralny por AQP1 może służyć jako droga dla cząsteczek gazu do przekroczenia błony (Wang et al., Journal of Structural Biology, 2007 ).
Molecular Obstacle Course
Komórki biologiczne chronią swoje wnętrze poprzez błony komórkowe, ale polegają na imporcie składników odżywczych. One ewoluowały dla tego importu szybkie kanały przewodzenia, które zawierają niezawodne punkty kontrolne rozróżniające związki pożądane i niepożądane. Punkty kontrolne tworzą istny tor przeszkód, który tylko właściwe związki mogą szybko pokonać. Zrozumienie budowy kanałów jest trudne ze względu na brak szczegółowych danych eksperymentalnych dotyczących dynamiki substancji odżywczych. Obecnie, najbardziej szczegółowe informacje pochodzą z obliczeniowego spojrzenia na dynamikę kanałów, począwszy od statycznych struktur krystalograficznych. Ostatnio badano, jak glicerole, małe cząsteczki odżywcze potrzebne niektórym bakteriom, przechodzą przez punkty kontrolne realizowane przez glicerolowy kanał GlpF. GlpF posiada cztery równoległe kanały, które były monitorowane obliczeniowo przy użyciu NAMD i nowego algorytmu, który bada energetykę kanałów na tyle szybko, że jest to metodologicznie wykonalne na współczesnych komputerach. Wyniki pokazują, jak fizyczne właściwości glicerolu, jego zdolność do tworzenia tzw. wiązań wodorowych, jego elektryczne momenty dipolowe, jego ruchliwość dyfuzyjna i wewnętrzna elastyczność są sondowane wzdłuż kanału (Henin et al., Biophysical Journal, in press ).
Our Aquaporin Research in the News
|
Zespół ds. akwaporyn
|
Publikacje
-.//W3C//DTD XHTML 1.0 Transitional//EN” „http://www.w3.org/TR/xhtml1/DTD/xhtml1-transitional.dtd”>Publications Database Diffusion of glycerol through Escherichia coli aquaglyceroporin GlpF.Jerome Henin, Emad Tajkhorshid, Klaus Schulten, and Christophe Chipot. Biophysical Journal, 94:832-839, 2008. Exploring gas permeability of cellular membranes and membrane channels with molecular dynamics.Yi Wang, Jordi Cohen, Walter F. Boron, Klaus Schulten, and Emad Tajkhorshid. Journal of Structural Biology, 157:534-544, 2007. Mechanism of gating and ion conductivity of a possible tetrameric pore in Aquaporin-1.Jin Yu, Andrea J. Yool, Klaus Schulten, and Emad Tajkhorshid. Structure, 14:1411-1423, 2006. Structural mechanism of plant aquaporin gating.S. Törnroth-Horsefield, Y. Wang, K. Hedfalk, U. Johanson, M. Karlsson, E. Tajkhorshid, R. Neutze, and P. Kjellbom. Nature, 439:688-694, 2006. What makes an aquaporin a glycerol channel: A comparative study of AqpZ and GlpF.Yi Wang, Klaus Schulten, and Emad Tajkhorshid. Structure, 13:1107-1118, 2005. Kinetic theory and simulation of single-channel water transport.Emad Tajkhorshid, Fangqiang Zhu, and Klaus Schulten. In S. Yip, editor, Handbook of Materials Modeling, Vol. I: Methods and Models, pp. 1797-1822. Springer, Holandia, 2005. Towards understanding membrane channels.Emad Tajkhorshid, Jordi Cohen, Aleksij Aksimentiev, Marcos Sotomayor, and Klaus Schulten. In Boris Martinac and Andrzej Kubalski, editors, Bacterial ion channels and their eukaryotic homologues, pp. 153-190. ASM Press, Washington, DC, 2005. Collective diffusion model for water permeation through microscopic channels.Fangqiang Zhu, Emad Tajkhorshid, and Klaus Schulten. Physical Review Letters, 93:224501, 2004. (4 strony). Computational studies of membrane channels.Benoit Roux and Klaus Schulten. Structure, 12:1343-1351, 2004.