Ponad 200 000 osób zostało poddanych przezcewnikowej wymianie zastawki aortalnej (TAVR), a każdego roku około 140 000 pacjentów otrzymuje chirurgiczną zastawkę bioprotetyczną.1,2 Pomimo tej rosnącej liczby pacjentów, optymalna strategia antykoagulacji po zabiegu jest często niejasna. W szczególności dwa pytania podkreślają trudności w podejmowaniu decyzji dotyczących tych powszechnych scenariuszy klinicznych:
- W początkowych miesiącach po wymianie zastawki bioprotetycznej, jakie powikłania staramy się zmniejszyć za pomocą antykoagulacji?
- Czy antykoagulacja powinna być podawana wszystkim pacjentom w celu zmniejszenia tych powikłań? Czy też powinniśmy stosować bardziej wybiórcze podejście oparte na czynnikach ryzyka?
Ryzyko zakrzepowe po wymianie zastawki bioprotetycznej
Tradycyjnie, uzasadnieniem dla stosowania antykoagulacji w ciągu pierwszych kilku miesięcy po chirurgicznej wymianie zastawki jest łagodzenie powikłań zakrzepowych, przypuszczalnie związanych z materiałem szwów i pierścieniem szyjącym, który nie jest jeszcze pokryty biofilmem i nie uległ endotelizacji.3,4 Możliwe późniejsze powikłania zakrzepowe są trojakiego rodzaju: zdarzenia zakrzepowo-zatorowe, jawna zakrzepica zastawki oraz subkliniczna zorganizowana skrzeplina, która może upośledzać długoterminową funkcję zastawki. Pomimo częstości wymiany zastawki bioprotetycznej dane dotyczące tych powikłań są ograniczone, częściowo dlatego, że zdarzenia te są pozornie rzadkie.
Dawna metaanaliza podkreśliła niski wskaźnik zdarzeń po wymianie zastawki bioprotetycznej. W tej analizie obejmującej 31 740 pacjentów, głównie z chirurgiczną wymianą zastawki aortalnej, wczesne zdarzenia zakrzepowo-zatorowe wystąpiły u 145 pacjentów (1%) przyjmujących antagonistów witaminy K i 262 pacjentów (1,5%) nieprzyjmujących antagonistów witaminy K (iloraz szans 0,96; 95% przedział ufności, 0,60-1,52).5 Jeśli przyjmiemy hipotezę, że u pacjentów nieprzyjmujących antagonistów witaminy K w pierwszych miesiącach po chirurgicznej wymianie zastawki aortalnej częstość powikłań zakrzepowo-zatorowych rzeczywiście wzrasta o 0,5%, to odpowiednio zasilone randomizowane badanie kontrolowane wymagałoby udziału około 15 500 pacjentów.6 Dotychczas przeprowadzono 2 badania z randomizacją, obejmujące łącznie 268 pacjentów.7,8 Biorąc pod uwagę tak małą liczbę pacjentów, brak statystycznie wykrywalnej różnicy w obu grupach nie jest zaskakujący.
Wobec braku dużych randomizowanych badań kontrolowanych klinicyści muszą sięgać do badań obserwacyjnych, takich jak analiza duńskiego Narodowego Rejestru Pacjentów.9 W tym badaniu obejmującym 4075 pacjentów z bioprotezową wymianą zastawki aortalnej odstawienie warfaryny wiązało się z częstszym występowaniem zdarzeń zakrzepowo-zatorowych i zgonów z przyczyn sercowo-naczyniowych 1-6 miesięcy po operacji. Co ciekawe, chociaż częstość udarów mózgu była zwiększona w pierwszych 3 miesiącach w grupie leczonej, liczba udarów mózgu między 3 a 6 miesiącem nie różniła się między pacjentami, którzy kontynuowali lub przerwali stosowanie warfaryny, chociaż w tym okresie wystąpiło tylko 21 zdarzeń. Ponadto nie było różnicy w zdarzeniach krwawienia między 3 miesiącami a 1 rokiem. Ta obserwacja jest sprzeczna z wcześniejszymi doniesieniami i doświadczeniem klinicznym, że pacjenci przyjmujący warfarynę częściej są hospitalizowani z powodu krwawienia.5 Dlatego wnioski autorów dotyczące śmiertelności z przyczyn sercowo-naczyniowych i zdarzeń zakrzepowo-zatorowych mogły być związane z resztkowymi zakłóceniami. W szczególności, mogło nie być różnicy w zdarzeniach krwawienia, ponieważ klinicyści byli mniej skłonni do rozpoczęcia lub kontynuowania antykoagulacji u pacjentów z grupy najwyższego ryzyka.
Niestety, w porównaniu ze zdarzeniami zakrzepowo-zatorowymi, opublikowane dane dostarczają jeszcze mniej wglądu we wnioskowanie o skojarzeniach dla zakrzepicy zastawki bioprotetycznej. Zgłaszano niewiele zdarzeń, a większość piśmiennictwa ogranicza się do serii przypadków i doświadczeń pojedynczych ośrodków.10 W związku z tym częstość występowania zakrzepicy zastawek bioprotetycznych nie jest dobrze określona, chociaż w jednym z badań tylko 8 z 4568 pacjentów z bioprotetycznymi zastawkami aortalnymi wymagało reoperacji z powodu zwężenia aorty związanego ze skrzepliną.11 Podobnie, rola niemej klinicznie zakrzepicy i możliwego przyspieszonego zwyrodnienia zastawki bioprotetycznej jest w dużej mierze nieznana.
Selective Anticoagulation After Bioprosthetic Valve Replacement
Based on an unclear magnitude of benefit and a well-accepted bleeding risk, universal anticoagulation after bioprosthetic aortic valve replacement is difficult to justify; this uncertainty is reflected by the Class IIb recommendation in the 2014 American College of Cardiology and American Heart Association (ACC/AHA) valvular heart disease guidelines.12 Mogą jednak wystąpić szczególne sytuacje kliniczne, w których należy bardziej zdecydowanie rozważyć zastosowanie antykoagulacji. Na przykład w niedawno przeprowadzonym badaniu case-control obejmującym 46 pacjentów z reoperacją z powodu zakrzepicy bioprotetycznej zastawki aortalnej wzrost >50% średniego gradientu dopplerowskiego w badaniu echokardiograficznym w stosunku do wartości wyjściowej, zwiększona grubość wypustek i nieprawidłowa ruchomość wypustek wiązały się z zakrzepicą zastawki.13 Dlatego u tych pacjentów można rozważyć próbę antykoagulacji i kontrolne badanie echokardiograficzne w celu oceny gradientów dopplerowskich,14 chociaż stopień, w jakim krótko- i długoterminowa funkcja zastawki jest modyfikowana przez antykoagulację, jest niejasny.
W dodatku pacjenci z bioprotetyczną zastawką mitralną wydają się być obarczeni większym ryzykiem zdarzeń zakrzepowo-zatorowych i zakrzepicy zastawki (patrz Ilustracja przypadku, z rycinami 1-2 i filmami 1-2, poniżej). Ponieważ wymiana bioprotetycznej zastawki mitralnej jest znacznie rzadsza niż wymiana zastawki aortalnej, dane na ten temat są jeszcze bardziej ograniczone. Jednak w jednoośrodkowym badaniu obejmującym 216 pacjentów z bioprotezoplastyką zastawki mitralnej u 10 (5%) w ciągu 6 miesięcy wystąpił udar niedokrwienny mózgu.15 Ponadto w innym badaniu obejmującym 149 kolejnych pacjentów u 9 (6%) wystąpiła zakrzepica bioprotezoplastyki zastawki mitralnej.16 Dlatego pacjenci z wymianą bioprotetycznej zastawki mitralnej wydają się być obarczeni większym ryzykiem, a rutynowa antykoagulacja powinna być rozważana przez 3-6 miesięcy, co ponownie odzwierciedla zalecenie klasy IIa w wytycznych ACC/AHA dotyczących chorób zastawkowych serca z 2014 roku.12
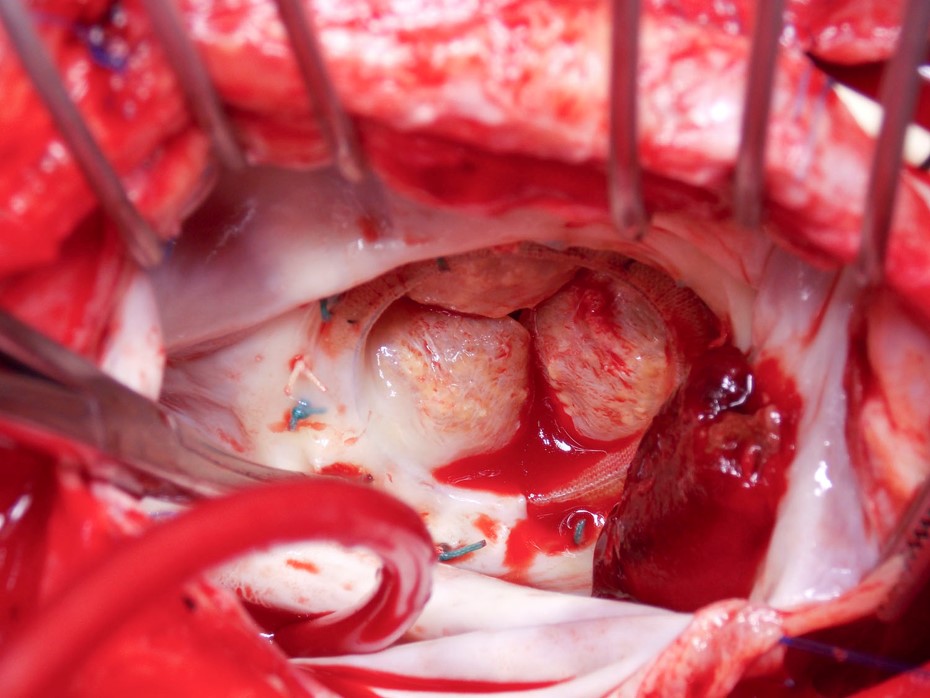
Przypadek ilustracyjny: Bioprosthetic Mitral Valve Thrombosis
A 71-letnia kobieta przedstawiła się z niewydolnością serca 8 miesięcy po wymianie bioprotetycznej zastawki mitralnej z powodu reumatycznego zwężenia zastawki mitralnej. Po operacji przez 3 miesiące była leczona kumadyną i nadal przyjmowała aspirynę. W wywiadzie nie występowało migotanie przedsionków, pacjentka była zdrowa, a wyniki posiewów krwi były ujemne.
Wideo 1
Rysunek 1
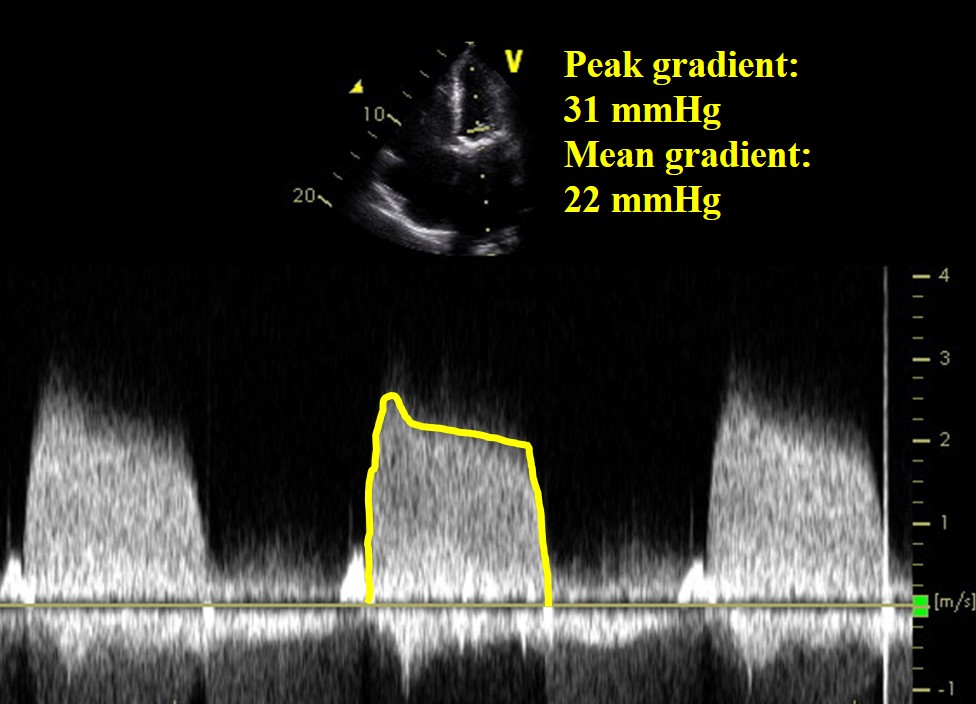
Wideo 2
Rysunek 2
Wreszcie, i być może najbardziej sporne, jest to, czy nasze podejście do antykoagulacji powinno się różnić w przypadku pacjentów, którzy mieli TAVR. Początkowo domyślnym postępowaniem było leczenie tych pacjentów aspiryną i klopidogrelem, ponieważ takie podejście stosowano w badaniach z randomizacją. Ostatnio, dzięki czterowymiarowej angiografii tomografii komputerowej (CTA) z bramkowaniem elektrokardiograficznym, opisano zmniejszoną ruchomość płatka bioprotetycznej zastawki aortalnej i hipoatenuowane pogrubienie płatka, co sugeruje zakrzepicę zastawki.17,18 Często pacjenci ci są bezobjawowi i mają prawidłowe gradienty Dopplera w badaniu echokardiograficznym, co sugeruje, że wyniki te mogą być subkliniczne. Co ważne, te nieprawidłowości w CTA mogą ustąpić po podaniu warfaryny, a brak początkowej antykoagulacji staje się możliwym czynnikiem ryzyka.19 Obecnie jednak te wyniki badań obrazowych mają niejasne znaczenie kliniczne.20 Na szczęście trwa randomizowane badanie GALILEO (Global Study Comparing a Rivaroxaban-Based Antithrombotic Strategy to an Antiplatelet-Based Strategy After Transcatheter Aortic Valve Replacement to Optimize Clinical Outcomes) porównujące rywaroksaban z leczeniem przeciwpłytkowym po TAVR, które powinno dostarczyć cennych spostrzeżeń.21 Jednak mimo szacowanej liczebności próby na poziomie 1520 pacjentów może ona nie mieć odpowiedniej mocy dla zdarzeń klinicznych.
Wnioski
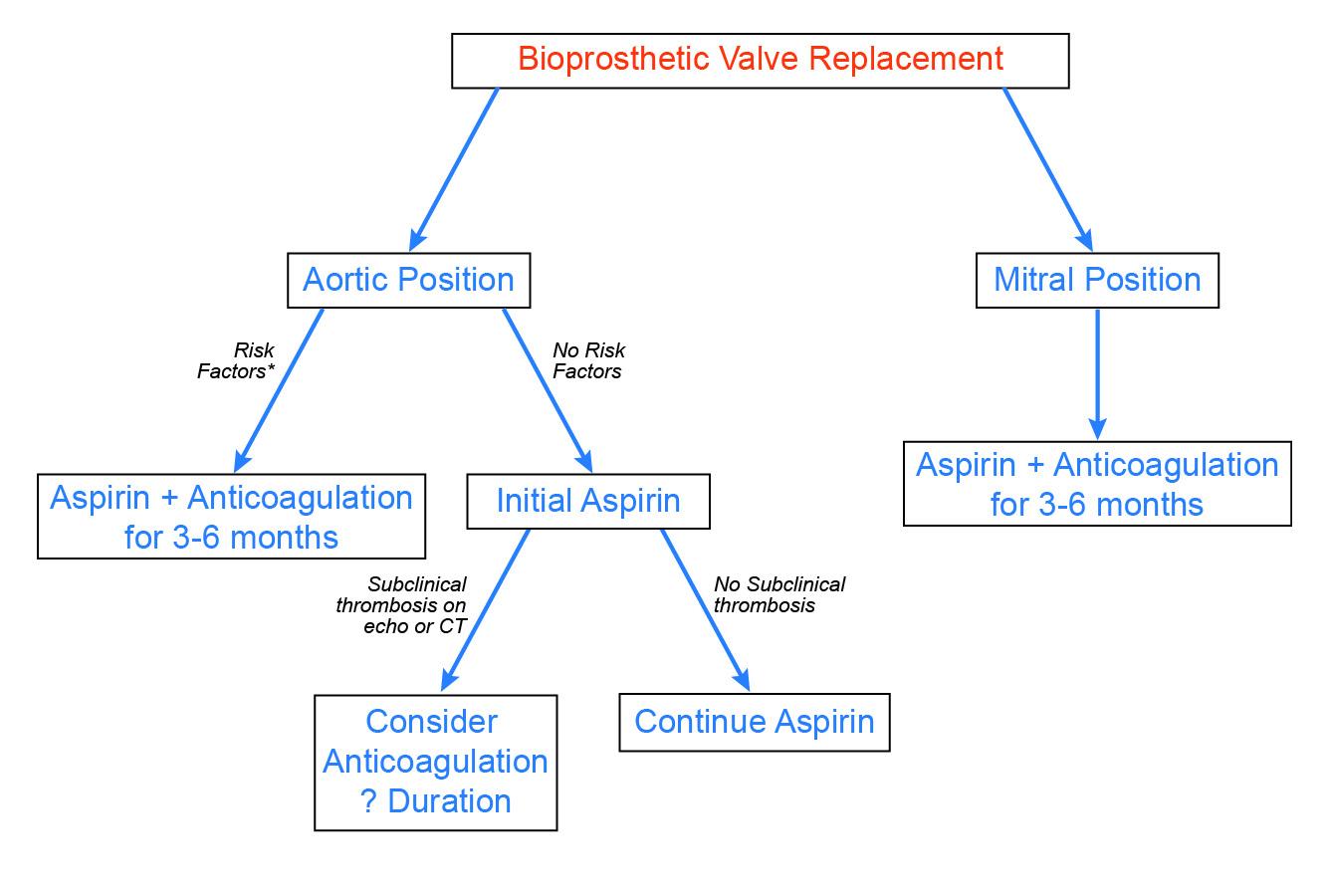
Ogółem, u pacjentów z zastawkami bioprotetycznymi, wczesne nieproceduralne zdarzenia zakrzepowo-zatorowe są rzadkie. Co więcej, częstość występowania jawnej zakrzepicy zastawki jest prawdopodobnie niska, a wpływ podostrej zakrzepicy na trwałość zastawki jest nadal przedmiotem badań. Biorąc pod uwagę te obserwacje oraz zwiększone ryzyko krwawienia związane ze stosowaniem warfaryny, opowiadamy się za wybiórczym podejściem do pooperacyjnej antykoagulacji (ryc. 3). U pacjentów z bioprotetycznymi zastawkami aortalnymi zaleca się antykoagulację przez 3-6 miesięcy u pacjentów z ustalonymi czynnikami ryzyka, takimi jak migotanie przedsionków. W oparciu o pojawiające się ostatnio dowody, należy rozważyć antykoagulację i ścisłą obserwację pacjentów z nieprawidłowymi wynikami badań echokardiograficznych lub CTA, takimi jak niewyjaśnione zwiększenie gradientu zastawki metodą Dopplera lub hipoattencyjne pogrubienie płatków. Wreszcie, mimo mniejszej liczby dostępnych danych, pacjenci z bioprotezami zastawek mitralnych wydają się być bardziej narażeni na powikłania zakrzepowe, dlatego zaleca się rutynową antykoagulację przez 3-6 miesięcy.
Figure 3: Proposed Approach to Anticoagulation After Bioprosthetic Valve Replacement
Ten artykuł zawiera materiały edukacyjne przeznaczone dla licencjonowanych pracowników służby zdrowia i jest przeznaczony do wykorzystania wyłącznie w celach edukacyjnych i informacyjnych. Chociaż treść może dotyczyć określonych zagadnień medycznych i opieki zdrowotnej, nie stanowi substytutu ani nie zastępuje spersonalizowanej porady medycznej i nie jest przeznaczony do wykorzystania jako jedyna podstawa do podejmowania zindywidualizowanych decyzji medycznych lub związanych ze zdrowiem. Wyrażone poglądy i opinie są poglądami autorów i redaktorów i nie muszą reprezentować poglądów ACC. Materiał nie ma na celu przedstawienia jedynych lub koniecznie najlepszych metod lub procedur w omawianych sytuacjach medycznych, ale raczej ma reprezentować podejście, pogląd, stwierdzenie lub opinię.
- Pibarot P, Dumesnil JG. Protetyczne zastawki serca: wybór optymalnej protezy i postępowanie długoterminowe. Circulation 2009;119:1034-48.
- Mack MJ, Douglas PS, Holmes DR. Shedding More Light on Valve Thrombosis After Transcatheter Aortic Valve Replacement. J Am Coll Cardiol 2016;67:656-8.
- Heras M, Chesebro JH, Fuster V, et al. High risk of thromboemboli early after bioprosthetic cardiac valve replacement. J Am Coll Caridol 1995;25:1111-9.
- Roudaut R, Serri K, Lafitte S. Thrombosis of prosthetic heart valves: diagnosis and therapeutic considerations. Heart 2007;93:137-42.
- Masri A, Gillinov AM, Johnston DM, et al. Anticoagulation versus antiplatelet or no therapy in patients undergoing bioprosthetic valve implantation: a systematic review and meta-analysis. Heart 2017;103:40-80.
- R Core Team (2015). R: A language and environment for statistical computing (R: Język i środowisko do obliczeń statystycznych). R Foundation for Statistical Computing; Wiedeń, Austria. Dostępne na: https://www.R-project.org/. (Using function power.prop.test α = 0.05 and β = 0.8)
- Aramendi JI, Mestres CA, Martinez-León J, Campos V, Muñoz G, Navas C. Triflusal versus oral anticoagulation for primary prevention of thromboembolism after bioprosthetic valve replacement (trac): prospective, randomized, co-operative trial. Eur J Cardiothorac Surg 2005;27:854-60.
- Colli A, Mestres CA, Castella M, Gherli T. Comparing warfarin to aspirin (WoA) after aortic valve replacement with the St. Jude Medical Epic heart valve bioprosthesis: results of the WoA Epic pilot trial. J Heart Valve Dis 2007;16:667-71.
- Mérie C, Køber L, Skov Olsen P, et al. Association of warfarin therapy duration after bioprosthetic aortic valve replacement with risk of mortality, thromboembolic complications, and bleeding. JAMA 2012;308:2118-25.
- Cremer PC, Rodriguez LL, Griffin BP, et al. Early Bioprosthetic Valve Failure: Mechanistic Insights via Correlation between Echocardiographic and Operative Findings. J Am Soc Echocardiogr 2015;28:1131-48.
- Brown ML, Park SJ, Sundt TM, Schaff HV. Early thrombosis risk in patients with biologicalic valves in the aortic position. J Thorac Cardiovasc Surg 2012;144:108-11.
- Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC guideline for the management of patients with valvular heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2014;63:e57-185.
- Egbe AC, Pislaru SV, Pellikka PA, et al. Bioprosthetic Valve Thrombosis Versus Structural Failure: Clinical and Echocardiographic Predictors. J Am Coll Cardiol 2015;66:2285-94.
- Stewart WJ. Thrombosis of Bioprosthetic Valves: Can We Afford to Ignore It? J Am Coll Cardiol 2015;66:2295-7.
- Russo A, Grigioni F, Avierinos JF, et al. Thromboembolic complications after surgical correction of mitral regurgitation incidence, predictors, and clinical implications. J Am Coll Cardiol 2008;51:1203-11.
- Butnaru A, Shaheen J, Tzivoni D, Tauber R, Bitran D, Silberman S. Diagnosis and treatment of early bioprosthetic malfunction in the mitral valve position due to thrombus formation. Am J Cardiol 2013;112:1439-44.
- Makkar RR, Fontana G, Jilaihawi H, et al. Possible Subclinical Leaflet Thrombosis in Bioprosthetic Aortic Valves. N Engj J Med 2015;373:2015-24.
- Pache G, Schoechlin S, Blanke P, et al. Early hypo-attenuated leaflet thickening in balloon-expandable transcatheter aortic heart valves. Eur Heart J 2016;37:2263-71.
- Hansson NC, Grove EL, Andersen HR, et al. Transcatheter Aortic Valve Thrombosis: Incidence, Predisposing Factors, and Clinical Implications. J Am Coll Cardiol 2016;68:2059-69.
- Laschinger JC, Wu C, Ibrahim NG, Shuren JE. Reduced Leaflet Motion in Bioprosthetic Aortic Valves–The FDA Perspective. N Engj J Med 2015;373:1996-8.
- Global Study Comparing a rivAroxaban-based Antithrombotic Strategy to an antipLatelet-based Strategy After Transcatheter aortIc vaLve rEplacement to Optimize Clinical Outcomes (GALILEO) (strona internetowa ClinicalTrails.gov). 2016. Dostępne na: https://clinicaltrials.gov/ct2/show/NCT02556203. Dostęp 11/29/2016.
Clinical Topics: Zarządzanie antykoagulacją, Arrhythmias and Clinical EP, Kardiochirurgia, Niewydolność serca i kardiomiopatie, Inwazyjna angiografia i interwencja sercowo-naczyniowa, Nieinwazyjne obrazowanie, Choroba zastawkowa serca, Zarządzanie antykoagulacją i migotanie przedsionków, Migotanie przedsionków/nadkomorowe zaburzenia rytmu serca, Chirurgia aorty, Kardiochirurgia i arytmie, Kardiochirurgia i niewydolność serca, Kardiochirurgia i VHD, Ostra niewydolność serca, Interwencje i obrazowanie, Interwencje i strukturalna choroba serca, Angiografia, Echokardiografia/Ultrasonografia, Obrazowanie jądrowe
Keywords: Aortic Valve, Aortic Valve Stenosis, Atrial Fibrillation, Aspirin, Bioprosthesis, Case-Control Studies, Angiography, Constriction, Pathologic, Echocardiography, Transesophageal, Electrocardiography, Heart Failure, Heart Valve Diseases, Heart Valve Prosthesis, Mitral Valve, Mitral Valve Stenosis, Reoperation, Risk Factors, Stroke, Sutures, Thrombosis, Ticlopidine, Transcatheter Aortic Valve Replacement, Vitamin K, Warfarin
< Back to Listings
.