14.1 Wprowadzenie do neuropeptydów i tlenku azotu
Klasyczne neuroprzekaźniki (np. glutaminian i ACh) działają poprzez kierunkowe przekazywanie informacji pomiędzy presynaptycznymi miejscami uwalniania a postsynaptycznymi skupiskami receptorów. Proces ten jest na ogół dobrze zorganizowany przestrzennie, z pewnym, ale bardzo ograniczonym „rozprzestrzenianiem się” przekaźnika pomiędzy sąsiednimi synapsami. Zupełnie inaczej wygląda sytuacja w przypadku przekaźnictwa mediowanego przez neuropeptydy i tlenek azotu (NO). Cząsteczki te ignorują kierunkowość przepływu informacji i zamiast tego oddziałują na pewien obszar od miejsca ich uwolnienia. Ta cecha jest luźno analogiczna do uwalniania hormonów peptydowych do krwiobiegu, które mogą być przenoszone do odległych miejsc, aby wywołać swoje efekty. Na przykład NO może być produkowany w neuronie postsynaptycznym i dyfundować z powrotem do neuronu presynaptycznego lub do innych sąsiednich neuronów, wpływając na późniejsze uwalnianie przekaźnika. Ta właściwość jest określana jako transmisja wsteczna, ponieważ sygnał przemieszcza się w przeciwnym kierunku (post- do pre-) w porównaniu z klasyczną kierunkowością neurotransmisji.
14.2 Neuropeptydy
Wiele neuropeptydów zostało pierwotnie opisanych jako hormony (np. somatostatyna i cholecystokinina), chociaż po scharakteryzowaniu zostały one później znalezione również w neuronach w obrębie OUN. Neuropeptydy zazwyczaj wywołują odpowiedzi neuronalne o powolnym początku i długim czasie trwania (rysunek 14.1), a każdy scharakteryzowany receptor neuropeptydowy należy do klasy GPCR (G-protein coupled receptor). Dla porównania, rysunek 14.1 przedstawia typowe odpowiedzi wywołane działaniem klasycznego neuroprzekaźnika (glutaminianu) działającego na receptor jonotropowy i neuropeptyd. Potencjał czynnościowy wywołany w neuronie 1 (na zielono), neuronie uwalniającym glutaminian, wytwarza szybki (5 msec) EPSP typowy dla transmisji synaptycznej pośredniczonej przez glutaminian. W przeciwieństwie do tego, potencjał czynnościowy wywołany w neuronie 2 (fioletowy), który uwalnia neuropeptyd, wytwarza EPSP o powolnym początku (5 sek. do szczytu) i długim czasie trwania (10 sek.). Te powolne EPSP są typowe dla działania neuropeptydów, ponieważ wszystkie receptory neuropeptydowe są sprzężone z białkiem G.
Rysunek 14.1
W dodatku, wiele neuropeptydów nie wytwarza oczywistej zmiany elektrofizjologicznej w neuronie postsynaptycznym. Na przykład, potencjał czynnościowy w neuronie 3 (Rysunek 14.1; kolor różowy) nie wywołuje żadnej odpowiedzi w neuronie postsynaptycznym, mimo że można potwierdzić za pomocą innych środków, że neuropeptydy zostały uwolnione. W neuronie postsynaptycznym zaszły jednak zmiany, co widać na przykładzie pokazanym w panelach oznaczonych literą „C”. Jeśli najpierw zmierzymy odpowiedź glutaminianową (C1) poprzez stymulację neuronu 1, zobaczymy typową odpowiedź. Stymulacja neuronu 3 nie wywołuje żadnej odpowiedzi (C2), tak jak poprzednio. Jednakże, jeśli neuron 1 jest ponownie stymulowany po stymulacji neuronu 3, EPSP mierzony w neuronie postsynaptycznym jest wzmocniony (C3) (oryginalny EPSP jest linią ciągłą, a EPSP po stymulacji neuronu 3 jest linią przerywaną). Tak więc neuropeptyd uwolniony z neuronu 3 zmienił odpowiedź neuronu postsynaptycznego na inny neurotransmiter. Mówi się, że te neuropeptydy są neuromodulatorami, ponieważ ich działanie polega na wzmacnianiu lub osłabianiu działania drugiego przekaźnika. Inne przykłady takiej heterosynaptycznej plastyczności są opisane w rozdziale 7, część 2.
14.3 Klasyfikacja peptydów według rodzin
Neuropeptydy można pogrupować w rodziny na podstawie podobieństw w ich sekwencjach aminokwasowych (tabele I i II).
Tabela I
Rodziny neuropeptydów
Tachykininy: substancja P, bombesyna, substancja
Insuliny: insulina, insulinopodobne czynniki wzrostu
Somatostatyny: somatostatyna, polipeptyd trzustkowy
Gastryny: gastryna, cholecystokinina
Opioidy: opiokortyny, enkefaliny, dynorfina
Na przykład opiaty są zgrupowane jako rodzina ze względu na identyczną sekwencję aminokwasową Tyr-Gly-Gly-Phe–(Tabela II) występującą na N-końcu każdego z nich.
| Tabela II Rodzina opiatów – identyczność sekwencji podana kursywą |
|
| Nazwa | Sekwencja aminokwasowa |
| Leu-enkefalinę | Tyr-Gly-Gly-Phe-Leu-OH |
| Met-enkefalinę | Tyr-Gly-Gly-Phe-Met-OH |
| Beta-.endorphin | Tyr-Gly-Gly-Phe-Met-Thr-Ser-Glu-Lys- Ser-Gln-Thr-Pro-Leu-Val-Thr-Leu- Phe-Lys-Asn-Ala-Ile-Val-Lys-Asn-Ala- His-Lys-Gly-Gln-His-OH |
| Dynorfina | Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile-Arg- Pro-Lys-Leu-Lys-Trp-Asp-Asn-Gln-OH |
14.4 Biosynteza i regulacja
Rys. 14.2
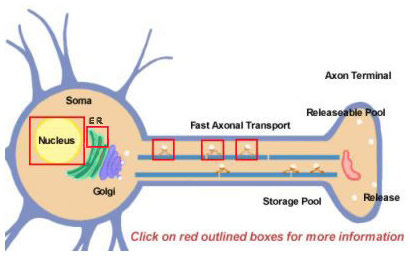
Neuropeptydy powstają z większych prekursorów w wyniku przetwarzania proteolitycznego. Wszystkie one są początkowo syntetyzowane w obrębie somy (rysunek 14.2). Prekursory są początkowo formowane przez translokację na polirybosomach przyczepionych do retikulum endoplazmatycznego w pobliżu ciała komórki. Stamtąd przechodzą przez aparat Golgiego, gdzie zachodzą dalsze modyfikacje, w tym glikozylacja. Następnie są pakowane do granulek wydzielniczych, które są transportowane do zakończeń szybkim transportem aksonalnym. Szybkość jest jednak pojęciem względnym i wynika ze stosunkowo dużych odległości, jakie muszą pokonać niektóre neuropeptydy. Uzupełnienie puli uwalnianego neuropeptydu może wymagać wielu godzin. Podczas transportu do terminalu nerwowego, proteazy, które są pakowane wewnątrz pęcherzyka zaczynają rozszczepiać prekursor neuropeptydu do jego ostatecznej dojrzałej formy. Przetwarzanie to jest niezbędne do aktywacji neuropeptydów, ponieważ prekursory są biologicznie nieaktywne. Wewnątrz pęcherzyków zachodzą co najmniej trzy rodzaje przetwarzania (rysunek 14.2; kliknij na ramki, aby uzyskać więcej szczegółów). Po pierwsze, endopeptydaza rozszczepia prekursor, generując dwa nowe produkty (pierwsza ramka w aksonie). W przypadku wielu prekursorów rozszczepienie to następuje po resztach podstawowych (takich jak Lys i Arg) i jest dokonywane przez proteazy podobne do trypsyny. Następnie, choć nie w przypadku każdego neuropeptydu, karboksypeptydaza rozcina reszty podstawowe na C-końcu nowego peptydu (drugie pole w aksonie). Wreszcie trzeci enzym przekształca grupę COOH (karboksylową) reszty Gly, występującej na C-końcu wielu neuropeptydów, w grupę NH2 (amidową), tworząc dojrzałą, aktywną formę neuropeptydu.
14.5 Wiele mechanizmów jest wykorzystywanych do produkcji różnorodności neuropeptydów
Większość białek jest produkowana z cząsteczek mRNA, które są splicingowane z prekursorowych RNA do ich ostatecznych form w jądrze. Różnicowanie splicing jest jednym ze sposobów, że neuron używa do różnicowania produkcji różnych typów neuropeptydów. Jednym z dobrze znanych przykładów jest mRNA substancji P, które normalnie zawiera również mRNA kodujące substancję K. Część mRNA kodująca substancję K może być różnie splicingowana, tak aby powstałe mRNA mogło produkować tylko substancję P (kliknij na ramkę nad jądrem na Rysunku 14.2)
Rysunek 14.3
Neuropeptydy są produkowane z dłuższego białka prekursorowego przez przetwarzanie proteolityczne. Doskonałym przykładem jest rodzina peptydów opioidowych (np. przetwarzanie proopiomelanokortykotropiny, POMC i enkefaliny; patrz Rysunek 14.3). Jak zauważono, przetwarzanie proteolityczne ma miejsce w obrębie pęcherzyków transportowych i najczęściej odbywa się poprzez rozszczepienie prekursora po N-końcowej stronie reszt zasadowych (argininy i lizyny), chociaż zidentyfikowano również inne miejsca rozszczepienia. W niektórych przypadkach, jak np. w przypadku białka prekursorowego Enkefaliny, występuje wiele kopii tego samego końcowego bioaktywnego peptydu. Jedna cząsteczka prekursora pokazana na górze Rysunku 14.3 zawiera sześć kopii Met-enkefaliny (ME) i jedną kopię Leu-enkefaliny (LE).
Różnorodność można zatem wytworzyć poprzez zmianę sekwencji miejsc rozszczepienia w wyniku różnicowego splicingu, poprzez wytwarzanie i/lub pakowanie różnych proteaz (rozpoznających różne sekwencje rozszczepienia) do pęcherzyków transportowych lub poprzez ukrycie miejsca proteolitycznego w wyniku modyfikacji potranslacyjnych. Przykładem tego ostatniego może być ukrycie specyficznego miejsca rozszczepienia przez dodanie łańcucha bocznego węglowodanów, który sterycznie blokuje dostęp proteazy do tego miejsca. Innym powszechnym odkryciem jest to, że pojedyncza cząsteczka prekursorowa zawiera kilka różnych neuropeptydów (patrz Rysunek 14.3), a zatem rodzaj zachodzącego przetwarzania ostatecznie decyduje o tym, który neuropeptyd jest uwalniany przez neuron. Białko prekursorowe POMC może być rozszczepione do postaci ACTH (kolor pomarańczowy) i β-lipoproteiny (kolor jasnoniebieski), które mogą być dalej rozszczepione w celu wytworzenia dodatkowych bioaktywnych neuropeptydów (Rysunek 14.3). Na przykład, β-lipoproteina (jasnoniebieski) może być dalej rozszczepiony do γ-lipoproteiny (zielone paski) i β-endorfiny (ciemnoniebieski). Ponownie, w zależności od przetwarzania, które ma miejsce, to samo białko prekursorowe może być modyfikowane w celu wytworzenia neuropeptydów o dramatycznie różnych reakcjach biologicznych.
14.6 Uwalnianie
Rysunek 14.4
Peptydy są uwalniane przez zależną od wapnia egzocytozę z pewnymi istotnymi różnicami w stosunku do uwalniania klasycznych neuroprzekaźników. Zazwyczaj pęcherzyki uwalniające neuropeptydy są znacznie większe niż te, które zawierają małocząsteczkowe neuroprzekaźniki (np. glutaminian) i nie wymagają presynaptycznej specjalizacji do uwalniania (patrz mikrograf elektronowy na ryc. 14.4). W przeciwieństwie do małych pęcherzyków, które zawierają glutaminian, duże pęcherzyki nie wydają się zadokowane w błonie. Ta obserwacja jest zgodna z ideą, że małe cząsteczki neuroprzekaźników wywołują krótkotrwałe, lokalne efekty (w połączeniach synaptycznych), podczas gdy neuropeptydy wywołują powolne, długotrwałe efekty, często obejmujące znaczny obszar wokół miejsca uwolnienia. Należy również pamiętać, że ponieważ neuropeptydy są syntetyzowane w somie komórki, a nie lokalnie w synapsie, jeśli ich zapas zostanie wyczerpany w wyniku długotrwałego uwalniania, może upłynąć kilka godzin, zanim zostaną uzupełnione pule możliwe do uwolnienia. Na przykład, neuron ruchowy, którego ciało komórkowe znajduje się w rdzeniu kręgowym, a synapsa w stopie, ma akson o długości jednego metra. Przy wykorzystaniu szybkiego transportu aksonalnego dotarcie nowo zsyntetyzowanego neuropeptydu z somy do tej synapsy zajęłoby potencjalnie więcej niż jeden dzień. Powinno być również oczywiste, że endogenne neuropeptydy zabijające ból, jak beta-endorfina, mogą być „zużywane” w czasie uporczywej stymulacji prowadzącej do sytuacji, w której ból nie może być dłużej kontrolowany przez mechanizmy endogenne.
Typowy dojrzały neuron będzie często uwalniał jeden neuroprzekaźnik o małej cząsteczce i jeden lub więcej neuropeptydów (jak w przykładzie pokazanym na rycinie 14.4). Jeśli uwalniany jest więcej niż jeden neuropeptyd, to najczęściej pochodzą one z tej samej pojedynczej cząsteczki prekursorowej. Przykładem jest współuwalnianie zarówno ACh, jak i peptydu związanego z genem kalcytoniny z neuronów ruchowych rdzenia kręgowego. CGRP aktywuje cyklazę adenylanową, podnosząc poziom cAMP, i potęguje siłę skurczu wywołaną aktywacją ACh przez nikotynowy receptor ACh. W tym przypadku neuropeptyd działa modulująco, jak opisano na rysunku 14.1. Jednak w tym przypadku efekt ten potęguje skurcz mięśnia, zamiast zwiększać wielkość EPSP. W obu przykładach, spotęgowana odpowiedź jest spowodowana zwiększoną wrażliwością systemu na stałą ilość uwolnionego neuroprzekaźnika.
14.6 Zakończenie działania
Neuropeptydy są powoli usuwane z przestrzeni zewnątrzkomórkowej; jest to cecha, która również przyczynia się do ich stosunkowo długotrwałego działania. Inaktywacja następuje zarówno poprzez dyfuzję, jak i rozkład przez proteazy zewnątrzkomórkowe. Nie znaleziono dowodów na ponowny wychwyt peptydów jako sposób zakończenia ich działania.
14.7 Receptory są wszystkie związane z białkiem G
Wszystkie znane receptory neuropeptydów wytwarzają swoje efekty poprzez zmianę poziomu wewnątrzkomórkowych drugich posłańców. Receptory te są siedmioma transmembranowymi białkami, które są połączone przez białka G (GPCRs), aby zmienić aktywację innych enzymów komórkowych. Ta właściwość jest zgodna z neuropeptydami wywołującymi wolniejszą odpowiedź i jest dobrze dostosowana do roli modulacyjnej. Ważnym rozróżnieniem pomiędzy małymi i neuropeptydowymi molekułami przekaźników jest to, że receptory neuropeptydowe mają wysokie powinowactwo do wiązania (nanomolarne) w przeciwieństwie do mikro- lub milimolarnych powinowactw mierzonych dla małych molekuł neuroprzekaźników (jak glutaminian). Ponieważ neuropeptydy nie są uwalniane kierunkowo do zamkniętej objętości synapsy, ich stężenia nie osiągają bardzo wysokich poziomów, a receptory muszą mieć wysokie powinowactwo, aby reagować na te małe stężenia. To wysokie powinowactwo spowalnia dysocjację neuropeptydu od jego receptora i również przyczynia się do trwałego działania tych cząsteczek. Tlenek azotu (NO)
14.8 Tlenek azotu (NO)
Tlenek azotu zyskał powszechną uwagę jako członek założyciel nowej klasy gazowych cząsteczek posłańca. NO jest aktywną cząsteczką, którą wytwarza podjęzykowa nitrogliceryna w celu zwiększenia rozszerzenia naczyń krwionośnych w łagodzeniu objawów dławicy piersiowej. Inne ważne efekty biologiczne NO są obecnie rozpoznawane. Na przykład, w układzie nerwowym, NO jest ważny w regulacji mózgowego przepływu krwi, w modulacji neurotransmisji i w toksyczności związanej z różnymi stanami patologicznymi.
14.9 Charakterystyka NO
Podsumowanie właściwości NO
- Gaz swobodnie dyfundujący przez błony
- Krótkożyciowy z czasem połowicznego rozpadu mierzonym w sekundach
- .życia mierzonym w sekundach
- Wysoko reaktywny wolny rodnik
- Toksyczny w wysokich stężeniach
NO jest krótko żyjącym gazem, którego nie należy mylić ze stosunkowo stabilnym gazem znieczulającym podtlenkiem azotu (gazem rozweselającym). NO jest w rzeczywistości wolnym rodnikiem i dlatego jest związkiem wysoce reaktywnym. Niektóre z jego toksycznych efektów są prawdopodobnie spowodowane tym, że NO reaguje z nadtlenkiem, tworząc niszczący rodnik nadtlenoazotan. NO jest uważany za niekonwencjonalny neuroprzekaźnik, ponieważ nie jest uwalniany przez egzocytozę, a jego działanie nie zachodzi poprzez konwencjonalne cząsteczki receptorowe.
Jak wspomniano wcześniej, typowy opis komunikacji neuronalnej uważa, że transmisja jest jednokierunkowa. Uwalniany jest neurotransmiter presynaptyczny, który wywołuje zmiany w neuronie postsynaptycznym. Niektóre związki (jak neuropeptydy i NO) produkowane w neuronach postsynaptycznych dyfundują do lokalnego środowiska i wpływają na otaczające je komórki. Ponieważ NO jest gazem swobodnie dyfundującym, ma potencjał do szybkiego przemieszczania się w dowolnym kierunku od miejsca produkcji. Na przykład, jeśli NO zostanie wytworzony w komórce postsynaptycznej w wyniku stymulacji receptora glutaminianowego, może zostać uwolniony do lokalnego środowiska i wysłać sygnał z powrotem do neuronu presynaptycznego (rysunek 14.5). Ten rodzaj aktywności jest określany jako sygnalizacja wsteczna, ponieważ sygnał wędruje w kierunku wstecznym od neuronu postsynaptycznego do presynaptycznego.
Rysunek 14.5
Rysunek 14.6
Rysunki 14.5, 14.6 i 14.7 podsumowują główne aspekty syntezy NO. W tym przykładzie, glutaminian jest uwalniany z terminala presynaptycznego, który wiąże się z receptorami NMDA na błonie postsynaptycznej, powodując ich otwarcie i umożliwiając napływ Ca2+. Ca2+ aktywuje kalmodulinę, która łączy się z enzymem syntazy tlenku azotu (NOS) i aktywuje go. Używając argininy jako substratu, NOS wytwarza NO i drugi produkt reakcji – cytrulinę. NO może następnie swobodnie dyfundować do środowiska i oddziaływać z terminalem presynaptycznym, który pierwotnie uwolnił glutaminian lub z jakąkolwiek inną komórką w lokalnym środowisku. Rozpoznaj, że każdy proces, który podnosi wewnątrzkomórkowe Ca2+ potencjalnie aktywuje NOS. Aktywacja glutaminianu przez receptory NMDA jest tylko jednym dobrze udokumentowanym przykładem.
Rysunek 14.7
14.10 Synteza przez syntazę tlenku azotu (NOS) i uwalnianie
NO jest produkowany przez enzym syntazę tlenku azotu (NOS). Enzym ten znajduje się w subpopulacji neuronów (1-2% neuronów w korze mózgowej) i występuje w większości wszystkich komórek śródbłonka. Przynajmniej jedna forma NOS w tych komórkach jest zależna od wapnia i kalmoduliny w celu aktywacji, jak pokazano na rysunkach 14.5, 14.6 i 14.7. Zawiera ona również kofaktory podobne do cytochromu P-450. Kofaktory te to NADPH (fosforan dinukleotydu nikotynamido-adeninowego), FAD (mononukleotyd adeninowy flawiny) i FMN (mononukleotyd flawiny). Kofaktory te są niezbędne do przeniesienia elektronów, w wyniku czego powstaje niestabilny i krótkożyciowy produkt NO. Substratem w tej reakcji jest powszechnie występujący aminokwas arginina, a produktami są cytrulina i NO (rysunek 14.5). Ze względu na krótki czas życia NO jest on niezwykle trudny do bezpośredniego pomiaru. Jednakże w preparatach doświadczalnych istnieje doskonała korelacja pomiędzy zastosowaniem NMDA, które zwiększa wewnątrzuronalne Ca2+ i aktywuje NOS, z produkcją dodatkowego produktu aktywności enzymatycznej NOS, cytruliny (patrz rysunek 14.8). Produkcja cytruliny jest wiarygodnym wskaźnikiem produkcji NO. Możliwe jest również zablokowanie produkcji cytruliny (i NO) poprzez podawanie komórkom niemetabolizowalnego substratu dla NOS określanego jako metyl arginina (rysunek 14.9), a takie związki były stosowane w celu zmniejszenia produkcji NO i zakończenia jego efektów biologicznych.
|
Rysunek 14.8 |
Rys. 14.9 |
14.11 „Receptory” dla NO
Rysunek 14.10
Jednym z głównych celów dla NO wydaje się być enzym cyklaza guanylowa. Odkrycia tego dokonano pośrednio poprzez monitorowanie akumulacji produktu NOS – cytruliny, przy jednoczesnym monitorowaniu produkcji cGMP, produktu enzymu cyklazy guanylowej (rysunki 14.8 i 14.9). W tym eksperymencie NMDA zostało dodane do preparatu neuronalnego w celu aktywacji NOS. NOS wykorzystuje argininę jako substrat do produkcji NO i jak wspomniano, jeśli do systemu zostanie dodany niehydrolizowalny analog, taki jak metylo-arginina, akumulacja cytruliny i cGMP zakończy się w sposób zależny od dawki. Te silne korelacje doprowadziły do odkrycia, że cyklaza guanylowa jest głównym celem NO.
Cyklaza guanylowa jest niezwykłym enzymem, ponieważ posiada pierścień hemowy z powiązaną cząsteczką żelaza jako część swojej struktury. NO aktywuje ten enzym poprzez wiązanie się z żelazem w hemie, inicjując produkcję cyklicznego GMP z GTP (Rysunek 14.10) poprzez zmiany konformacyjne w enzymie. cGMP następnie aktywuje kinazę białkową zależną od cGMP i inne enzymy opisane poniżej. Spektrum efektów wywoływanych przez aktywację kinazy białkowej zależnej od cGMP dopiero teraz staje się zrozumiałe.
14.12 Efekty biologiczne NO
NO wywołuje szeroką gamę efektów biologicznych. Niestety, jesteśmy szczególnie nieświadomi roli NO w modulowaniu procesów komórkowych w układzie nerwowym. Rola NO w regulacji naczyń krwionośnych jest dobrze udokumentowana i wydaje się, że odgrywa on podobnie ważną rolę w układzie nerwowym.
14.13 Czynnik rozszerzający naczynia krwionośne
Rysunek 14.11
Kliknij tutaj, aby zobaczyć powiększony widok tego obrazu.
W normalnych warunkach, NO przyczynia się do kontroli przepływu krwi przez naczynia mózgowe. Szybki mechanizm sprzężenia zwrotnego koniecznie istnieje by dostarczyć bardziej aktywne obszary mózgu z niezbędnymi składnikami odżywczymi. Mechanizm ten jest konieczny ze względu na słabe rezerwy energetyczne mózgu. NO jest produkowany w neuronach zawierających NOS, które są poddawane stałej aktywności. Warunki te sprzyjają aktywacji receptorów NMDA, o których wiadomo, że powodują produkcję NO. NO dyfunduje z tych zlokalizowanych obszarów wysokiej aktywności neuronów do otaczających je mikrokrążeni (rysunek 14.11), powodując rozszerzenie naczyń i zwiększenie przepływu krwi.
Chociaż dokładne mechanizmy, za pomocą których NO wytwarza wazodylatację, nie są jeszcze zdefiniowane, wiadomo, że aktywacja kinazy białkowej zależnej od cGMP w komórkach mięśni gładkich powoduje rozluźnienie naczyń. Ponieważ jednym z głównych celów NO jest cyklaza guanylowa (która produkuje cGMP i aktywuje kinazę białkową zależną od cGMP), przypuszcza się, że jedną z głównych dróg działania naczyniorozszerzającego NO jest droga poprzez kinazę białkową zależną od cGMP. Aktywacja tej kinazy prowadzi pośrednio do obniżenia poziomu Ca2+ w komórkach mięśni gładkich, a następnie do deposforylacji aparatu kurczliwego miozyny, co powoduje relaksację (rysunek 14.12). W komórkach mięśni gładkich NO wydaje się również bezpośrednio hiperpolaryzować komórki, prawdopodobnie poprzez aktywację kanałów K+, prowadząc do wtórnego zamknięcia kanałów Ca2+, co również powoduje relaksację mięśni. Podsumowując, jedną z głównych funkcji NO wydaje się być integracja poziomu aktywności neuronów z lokalnymi zmianami w mózgowym przepływie krwi w celu utrzymania odpowiedniej perfuzji metabolicznie aktywnej tkanki.
Rysunek 14.12
14.14 Neuromodulator
Uważa się, że NO działa również jako lokalnie dyfundujący posłaniec. Jest on wytwarzany przez każde działanie, które podnosi Ca2+ w komórkach zawierających NOS, takie jak stymulacja receptorów NMDA przez glutaminian. Poprzez następczą aktywację cyklazy guanylowej i produkcję cGMP, produkcja NO wpływa na szereg procesów wtórnych. Należą do nich: bezpośrednia modulacja kanałów jonowych, stymulacja kinazy białkowej zależnej od cGMP, a także wzrost lub spadek regulacji kinazy fosfodiesterazy cAMP. Efekty uboczne są następnie liczne i obejmują regulację w górę i w dół kanałów Ca2+, zwiększoną pobudliwość (zwiększa częstotliwość wypalania neuronów), zwiększone lub zmniejszone uwalnianie neuroprzekaźników oraz zmiany w morfologii neuronów.
14.15 Toksyczność
NO w nadmiarze jest toksyczny dla komórek. Jednak w przypadku toksyczności NO istnieje paradoks. Komórki, które produkują wysoki poziom NO są odporne na jego toksyczne działanie. Na przykład, toksyczność NO jest wykorzystywana przez makrofagi i neutrofile jako mechanizm do zabijania komórek nowotworowych i bakterii. Jednakże, żaden z typów komórek produkujących NO nie jest podatny na jego szkodliwe działanie. To stwierdzenie jest również prawdziwe dla neuronów w ośrodkowym układzie nerwowym. Nadmiar glutaminianu indukuje neurotoksyczność w mózgu i jest uważany za główną przyczynę śmierci neuronów w chorobach takich jak choroba Huntingtona czy Alzheimera lub po ostrym udarze czy urazie. Uważa się, że nadmierna produkcja NO odgrywa pewną rolę w tej utracie neuronów ze względu na jego toksyczność, gdy jest produkowany w nadmiarze. Co ciekawe, komórki, które barwią się pozytywnie na enzym NOS są oszczędzane w degenerujących się obszarach mózgu dotkniętych tymi chorobami. Odporność tych komórek wydaje się być podobna do odporności komórek odpornościowych opisanych powyżej.
Testuj swoją wiedzę
- Pytanie 1
- A
- B
- C
- D
- E
Neuropeptydy są obecne w zakończeniach synaptycznych, ponieważ są:
A. Syntetyzowane w terminalu.
B. Przenoszone przez szybki transport aksonalny
C. Przenoszone przez dyfuzję
D. Przenoszony przez wolny transport aksonalny
E. Pobierane z przestrzeni pozakomórkowej
Neuropeptydy są obecne w zakończeniach synaptycznych, ponieważ są:
A. Syntetyzowane w terminalu. Ta odpowiedź jest NIEPRAWIDŁOWA.
Maszyna syntetyczna niezbędna do syntezy peptydów i białek nie znajduje się w terminalu aksonalnym.B. Przenoszona przez szybki transport aksonalny
C. Przenoszone przez dyfuzję
D. Przenoszony przez wolny transport aksonalny
E. Pobierane z przestrzeni pozakomórkowej
Neuropeptydy są obecne w zakończeniach synaptycznych, ponieważ są:
A. Syntetyzowane w terminalu.
B. Przenoszone przez szybki transport aksonalny Ta odpowiedź jest PRAWDZIWA!
Neuropeptydy są syntetyzowane w ciele komórkowym i przetwarzane w pęcherzykach, które są transportowane do zakończeń aksonalnych wzdłuż mikrotubul przez szybki transport aksonalny.C. Przenoszone przez dyfuzję
D. Przenoszone przez wolny transport aksonalny
E. Pobierane z przestrzeni pozakomórkowej
Neuropeptydy są obecne w zakończeniach synaptycznych, ponieważ są:
A. Syntetyzowane w terminalu.
B. Przenoszone przez szybki transport aksonalny
C. Przenoszone przez dyfuzję Ta odpowiedź jest NIEPRAWIDŁOWA.
Dyfuzja jest również doskonałym mechanizmem przenoszenia cząsteczek na krótkie odległości (kilka mikronów), ale jest nieefektywna przy przenoszeniu cząsteczek na odległości, które zwykle oddzielają somę neuronu od zakończeń aksonu.D. Przenoszone przez powolny transport aksonalny
E. Pobierane z przestrzeni zewnątrzkomórkowej
Neuropeptydy są obecne w zakończeniach synaptycznych, ponieważ są:
A. Syntetyzowane w terminalu.
B. Przenoszone przez szybki transport aksonalny
C. Przenoszony przez dyfuzję
D. Przenoszone przez powolny transport aksonalny Ta odpowiedź jest NIEPRAWIDŁOWA.
Ważne jest również, aby jak najszybciej uzupełnić dostawy neuropeptydów do zakończeń. W tym przypadku szybciej znaczy lepiej.E. Pobierane z przestrzeni zewnątrzkomórkowej
Neuropeptydy są obecne w zakończeniach synaptycznych, ponieważ są:
A. Syntetyzowane w terminalu.
B. Przenoszone przez szybki transport aksonalny
C. Przenoszony przez dyfuzję
D. Przenoszony przez wolny transport aksonalny
E. Pobrane z przestrzeni zewnątrzkomórkowej Ta odpowiedź jest NIEPRAWIDŁOWA.
Nie jest znany mechanizm pobierania, który pozwalałby na usunięcie neuropeptydów z przestrzeni zewnątrzkomórkowej. Ich mechanizm działania jest zakończony przez dyfuzję i przez degradację enzymatyczną przez proteazy zewnątrzkomórkowe.
- Pytanie 2
- A
- B
- C
- D
- E
Tlenek azotu:
A. Ma długi czas życia
B. Jest przepuszczalny dla błon
C. Nie jest reaktywny
D. Jest również znany jako gaz rozweselający.
E. Jest nietoksyczny dla komórek.
Tlenek azotu:
A. Ma długi czas życia Ta odpowiedź jest NIEPRAWIDŁOWA.
NO ma okres półtrwania mierzony w sekundach i jest wysoce niestabilny.B. Jest przepuszczalny przez membranę.
C. Nie jest reaktywny
D. Jest również znany jako gaz rozweselający.
E. Nie jest toksyczny dla komórek.
Tlenek azotu:
A. Ma długi czas życia
B. Jest przepuszczalny przez błonę. Ta odpowiedź jest PRAWDZIWA!
NO jest swobodnie przepuszczalny przez błony i wpływa na wszystkie komórki w pewnym promieniu od miejsca jego wytwarzania.C. Jest niereaktywny
D. Jest również znany jako gaz rozweselający.
E. Nie jest toksyczny dla komórek.
Tlenek azotu:
A. Ma długi czas życia
B. Jest przepuszczalny dla błon
C. Jest niereaktywny Ta odpowiedź jest NIEPRAWIDŁOWA.
NO jest wysoce reaktywnym wolnym rodnikiem. Będzie reagować z białkami, lipidami i kwasem nukleinowym i ma szczególnie wysokie powinowactwo do zredukowanych metali (takich jak Fe2+ w grupie hemowej cyklazy guanylowej).D. Jest również znany jako gaz rozweselający.
E. Jest nietoksyczny dla komórek.
Tlenek azotu:
A. Ma długi czas życia
B. Jest przepuszczalny dla błon
C. Nie jest reaktywny
D. Jest również znany jako gaz rozweselający. Ta odpowiedź jest NIEPRAWIDŁOWA.
Gaz rozweselający to podtlenek azotu, a nie tlenek azotu. Jest on niereaktywny i nietoksyczny, ale ma wpływ na właściwości membran.E. Jest nietoksyczny dla komórek.
Tlenek azotu:
A. Ma długi czas życia
B. Jest przepuszczalny dla błon
C. Nie jest reaktywny
D. Jest również znany jako gaz rozweselający.
E. Nie jest toksyczny dla komórek. Ta odpowiedź jest NIEPRAWIDŁOWA.
NO jest wysoce toksyczny dla komórek, gdy jest produkowany w nadmiarze. W rzeczywistości, nadprodukcja NO jest uważana za przyczynę niektórych chorób neurodegeneracyjnych. NO jest również produkowany przez makrofagi jako toksyczny produkt do zabijania inwazyjnych bakterii.