Pierwiastek chemiczny wodór jest klasyfikowany jako niemetal. Może stać się metaliczny przy bardzo wysokich ciśnieniach. Został odkryty w 1766 roku przez Henry’ego Cavendisha.

Strefa danych
| Klasyfikacja | Wodór jest niemetalem. Może stać się metaliczny przy bardzo wysokich ciśnieniach. |
| Kolor | bezbarwny |
| Waga atomowa | 1.0079 |
| Stan | gaz |
| Temperatura topnienia | -259.14 oC, 14.01 K |
| Temperatura wrzenia | -252.87 oC, 20.28 K |
| Elektrony: | 1 |
| Protony: | 1 |
| Neutrony w najobficiej występującym izotopie: | 0 |
| Powłoki elektronowe | 1 |
| Konfiguracja elektronów | 1s1 |
| Gęstość @ 20oC | 0.0000899 g/cm3 |
Pokaż więcej, w tym: Ciepła, Energie, Utlenianie,
Reakcje, Związki, Promienie, Przewodności
| Objętość atomowa | 14.4 cm3/mol |
| Struktura | hcp: hexagonal close packed (jako ciało stałe w niskich temperaturach) |
| Twardość | – |
| Ciepło właściwe | 14.304 J g-1 K-1 |
| Ciepło topnienia | 0,117 kJ mol-1 H2 |
| Ciepło atomizacji | 218 kJ mol-1 |
| Ciepło parowania | 0.904 kJ mol-1 H2 |
| 1. energia jonizacji | 1312 kJ mol-1 |
| 2. energia jonizacji | kJ mol-1 |
| 3. energia jonizacji | 11815.0 kJ mol-1 |
| Powinowactwo elektronowe | 72.7711 kJ mol-1 |
| Minimalna liczba utleniania | -1 |
| Min. wspólna liczba utleniania | -1 |
| Maksymalna liczba utleniania | 1 |
| Max. wspólna liczba utleniania. | 1 |
| Elektronegatywność (skala Paulinga) | 2,18 |
| Objętość polaryzacji | 0.7 Å3 |
| Reakcja z powietrzem | energiczna, ⇒ H2O |
| Reakcja z 15 M HNO3 | brak |
| Reakcja z 6 M HCl | brak |
| Reakcja z 6 M NaOH | brak |
| Tlenek(i) | H2O |
| Wodorek(i) | H2 |
| Chlorek(s) | HCl |
| Promień atomowy | 25 pm |
| Promień jonowy (jon 1+) | -. |
| Promień jonowy (2+ jon) | – |
| Promień jonowy (3+ jon) | – |
| Promień jonowy (1- jon) | – |
| Promień jonowy (2- jon) | – |
| Promień jonowy (3- jon) | – |
| Przewodność cieplna | 0.1805 W m-1 K-1 |
| Przewodnictwo elektryczne | – |
| Temperatura zamarzania/topnienia: | -259,14 oC, 14,01 K |

Obraz NASA: Ogromne ilości wodoru w odległych galaktykach.

Theophrastus Paracelsus – Pierwsza osoba, która wygenerowała wodór: „Powietrze powstaje i wyrywa się jak wiatr.”
Odkrycie wodoru
Ulubionym szkolnym eksperymentem chemicznym jest dodanie metalu, takiego jak magnez, do kwasu. Metal reaguje z kwasem, tworząc sól i uwalniając wodór z kwasu. Wodór gazowy bąbelkuje z cieczy i studenci zbierają go w małych ilościach do dalszych eksperymentów, takich jak „pop-test.”
Pierwszy odnotowany przypadek wodoru wytworzonego przez człowieka był w pierwszej połowie 1500 roku, metodą podobną do tej stosowanej obecnie w szkołach.Theophrastus Paracelsus, lekarz, rozpuścił żelazo w kwasie siarkowym i zaobserwował uwalnianie gazu. Podobno powiedział o tym eksperymencie: „Powietrze powstaje i zrywa się jak wiatr”. Nie odkrył jednak żadnej z właściwości wodoru.(1)
Turquet De Mayerne powtórzył eksperyment Paracelsusa w 1650 roku i stwierdził, że gaz jest łatwopalny.(2) Ani Paracelsus, ani De Mayerne nie proponowali, że wodór może być nowym pierwiastkiem. W rzeczywistości Paracelsus wierzył, że istnieją tylko trzy pierwiastki – tria prima – sól, siarka i rtęć – i że wszystkie inne substancje są wykonane z różnych kombinacji tych trzech. (3) (Chemia wciąż miała długą drogę do przebycia!)
W 1670 roku angielski naukowiec Robert Boyle dodał żelazo do kwasu siarkowego. Wykazał, że powstały gaz (wodór) spalał się tylko wtedy, gdy obecne było powietrze i że ułamek powietrza (który teraz nazwalibyśmy tlenem) był zużywany podczas spalania.(4)
Wodór został po raz pierwszy uznany za odrębny pierwiastek w 1766 roku przez angielskiego naukowca Henry’ego Cavendisha, gdy przygotował go poprzez reakcję kwasu solnego z cynkiem. Opisał on wodór jako „palne powietrze z metali” i ustalił, że jest to ten sam materiał (poprzez jego reakcje i gęstość) niezależnie od tego, jakiego metalu i jakiego kwasu użył do jego wytworzenia.(1) Cavendish zaobserwował również, że kiedy substancja ta jest spalana, wytwarza wodę.
Francuski naukowiec Antoine Lavoisier później nazwał pierwiastek wodorem (1783). Nazwa pochodzi od greckiego „hydro” oznaczającego wodę i „genes” oznaczającego formowanie – wodór jest jednym z dwóch pierwiastków tworzących wodę.
W 1806 r., kiedy wodór był już dobrze ugruntowany jako pierwiastek, angielski chemik Humphry Davy przepuścił przez oczyszczoną wodę silny prąd elektryczny.
Stwierdził, że powstał wodór i tlen. Eksperyment wykazał, że elektryczność może rozdzielić substancje na ich elementy składowe. Davy zdał sobie sprawę, że substancje są połączone zjawiskiem elektrycznym; odkrył prawdziwą naturę wiązania chemicznego.(5)
Odwiedź stronę Chemicool’s Cool Hydrogen Facts Page.

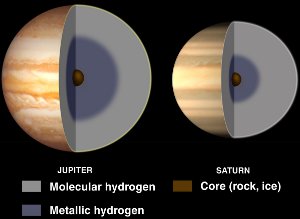
Wnętrza Jowisza i Saturna, z ciekłym metalicznym wodorem. Dzięki uprzejmości NASA/JPL-Caltech.

Nasa: Zewnętrzny zbiornik paliwa promu kosmicznego (pomarańczowy) wypełniony ciekłym wodorem i tlenem.

Samochody na wodór emitują wodę zamiast zanieczyszczeń.

Laboratoryjna elektroliza wody. Energia elektryczna jest wykorzystywana do rozszczepiania wody. W jednej probówce gromadzi się wodór, w drugiej tlen.
Wygląd i właściwości
Szkodliwe działanie:
Wodór jest wysoce łatwopalny i ma prawie niewidoczny płomień, co może prowadzić do przypadkowych poparzeń.
Właściwości:
Wodór jest najprostszym ze wszystkich pierwiastków i najlżejszym. Jest to również zdecydowanie najbardziej powszechny element we wszechświecie. Ponad 90 procent atomów we Wszechświecie to wodór.
W swojej najczęstszej formie, atom wodoru jest wykonany z jednego protonu, jednego elektronu i żadnych neutronów. Wodór jest jedynym pierwiastkiem, który może istnieć bez neutronów.
Wodór jest bezbarwnym, bezwonnym gazem, który istnieje, w standardowej temperaturze i ciśnieniu, jako cząsteczki dwuatomowe, H2.
Pali się i tworzy wybuchowe mieszaniny w powietrzu i gwałtownie reaguje z utleniaczami.
Na Ziemi, głównym miejscem występowania wodoru jest woda, H2O. Jest mało wolnego wodoru na Ziemi, ponieważ wodór jest tak lekki, że nie jest utrzymywany przez grawitację planety. Każdy wodór, który się tworzy, w końcu ucieka z atmosfery w przestrzeń kosmiczną.
Chociaż wodór jest zwykle niemetalem, staje się płynnym metalem, gdy stosuje się do niego ogromne ciśnienia.
Takie ciśnienia występują w obrębie planet gazowych olbrzymów, takich jak Jowisz i Saturn. Uważa się, że wysokie pole magnetyczne Jowisza (14 razy większe od ziemskiego) jest spowodowane efektem dynamo wynikającym z elektrycznie przewodzącego metalicznego wodoru krążącego podczas obrotu planety.
Zastosowanie wodoru
Duże ilości wodoru są wykorzystywane w procesie Habera (produkcja amoniaku), uwodornienie tłuszczów i olejów, produkcja metanolu, hydrokraking i hydroodsiarczanie. Wodór jest również używany w rafinacji metali.
Ciekły wodór jest używany jako paliwo rakietowe, na przykład do napędzania startu i wznoszenia się na orbitę wahadłowca kosmicznego. Ciekły wodór i tlen są przechowywane w dużym, zewnętrznym zbiorniku paliwa wahadłowca. (Zobacz zdjęcie po lewej.)
Dwa cięższe izotopy wodoru (deuter i tryt) są wykorzystywane w fuzji jądrowej.
Gospodarka wodorowa została zaproponowana jako zamiennik dla naszej obecnej gospodarki opartej na węglowodorach (ropa, gaz i węgiel).
Podstawą gospodarki wodorowej jest to, że energia jest produkowana, gdy wodór spala się z tlenem, a jedynym produktem ubocznym reakcji jest woda.
W chwili obecnej jednak, wodór do samochodów napędzanych wodorem jest produkowany z węglowodorów. Prawdziwa gospodarka wodorowa będzie możliwa dopiero wtedy, gdy np. energia słoneczna lub wiatrowa będzie mogła być wykorzystywana komercyjnie do rozszczepiania wody na wodór i tlen.
Objętość i izotopy
Objętość skorupy ziemskiej: 1400 części na milion wagowo (0,14%), 2,9% molowo
Objętość układu słonecznego: 75% wagowo, 93% molowo
Koszt, czysty: $12 za 100g
Koszt, luzem: $ za 100g
Źródło: Wodór jest przygotowywany komercyjnie poprzez reakcję przegrzanej pary wodnej z metanem lub węglem. W laboratorium, wodór może być produkowany przez działanie kwasów na metale takie jak cynk lub magnez, lub przez elektrolizę wody (pokazane po lewej stronie).
Izotopy: Wodór ma trzy izotopy, 1H (protium), 2H (deuter) i 3H (tryt). Jego dwa cięższe izotopy (deuter i tryt) są wykorzystywane do fuzji jądrowej. Prot jest najobficiej występującym izotopem, a tryt najmniej obficie. Tryt jest niestabilny, a jego okres połowicznego rozpadu wynosi około 12 lat i 4 miesiące. Naturalnie występujący wodór jest mieszaniną dwóch izotopów 1H i 2H, których naturalne stężenie wynosi odpowiednio 99,99% i 0,01%.

- Peter Hoffmann, Tomorrow’s Energy: Hydrogen, Fuel Cells, and the Prospects for a Cleaner Planet, (2001) p22. MIT Press, Cambridge, MA.
- P. Litherland Teed, The Chemistry and Manufacture of Hydrogen., (2008) p2. Dabney Press.
- John S. Davidson, Annotations to Boyle’s „The Sceptical Chymist”.
- Andreas Züttel, Andreas Borgschulte, Louis Schlapbach, Hydrogen as a future energy carrier., (2008) p8. Wiley-VCH, Weinheim.
- Kendall Haven, 100 Greatest Science Discoveries of All Time., (2007) p62. Libraries Unlimited.
Cite this Page
W przypadku linkowania online, proszę skopiować i wkleić jedno z poniższych:
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen</a>
lub
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen Element Facts</a>
Aby zacytować tę stronę w dokumencie akademickim, proszę użyć następującego cytatu zgodnego ze standardem MLA:
"Hydrogen." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hydrogen.html>.
.