Carcinoma in situ in a patient with erythroleukoplakia: challenges in the diagnosis and in the therapeutic choice
Tytuł skrócony: Carcinoma in situ in erythroleukoplakia
Willian Pecyna JacomacciI; Liogi Iwaki FilhoII; Lilian Cristina Vessoni IwakiII; Mariliani Chicarelli da SilvaII; Neli PielarisiII; Vanessa Cristina VeltriniII; Rafael de Oliveira LazarinIII; Elen de Souza TolentinoIV
I Undergraduate Student at Maringá State University, Maringá-PR, Brazil.
II DDS, MA, PhD, Associate Professor, Department of Dentistry, Maringá State University, Maringá-PR, Brazil.
III DDS, MA wnioskodawca w Stomatologii na Uniwersytecie Stanowym w Maringa, Maringa-PR, Brazylia.
IV DDS, MA, PhD, Assistant Professor, Department of Dentistry, Maringá State University, Maringá-PR, Brazil.
Endereço para correspondência
ABSTRACT
A 41-year-old Caucasian male smoker presented a red and white plaque on the left jugal mucosa suggestive of oral erythroleukoplakia (OEL). Biopsja, a następnie badanie mikroskopowe ujawniły raka in situ. Ponieważ OEL jest uważana za zmianę przedrakową o wysokim potencjale transformacji złośliwej, prezentowany przypadek ma na celu omówienie wyzwań związanych z rozpoznaniem tego schorzenia i wyborem najwłaściwszego leczenia. Omówiono takie zagadnienia, jak: czy istnieje granica wyboru radykalnego lub bardziej zachowawczego podejścia do leczenia oraz znaczenie zastosowania procedury umożliwiającej badanie mikroskopowe całej zmiany. Rak in situ związany z OEL spowodował, że planowanie leczenia w tym przypadku było jeszcze bardziej złożone. Aby uniknąć okaleczającego podejścia, wykonano wielokrotne wycięcia z marginesami bezpieczeństwa, a pacjentkę poinstruowano, aby nie paliła papierosów. Ścisła 12-miesięczna obserwacja nie wykazała oznak nawrotu OEL.
Deskryptory: Erytroplazja; Leukoplakia; Leczenie pierwotne.
WPROWADZENIE
Erytroukoplakia ustna (OEL), czasami porównywana do leukoplakii plamistej lub guzkowej, jest czerwono-białą blaszką o stosunkowo wysokim ryzyku transformacji złośliwej.1 Tytoń i alkohol są głównymi czynnikami ryzyka związanymi z jej potencjałem złośliwości.2,3
OEL wykazuje większy potencjał transformacji złośliwej niż leukoplakia homogenna,2-4 co można częściowo wykazać na podstawie badań histologicznych i immunohistochemicznych oraz badań kohortowych. Wskaźnik transformacji złośliwej OEL waha się od 18% do 47%, podczas gdy w przypadku homogennej grubej leukoplakii jamy ustnej (OL) wynosi on około 1-7%, a w przypadku ziarnistej lub brodawkowatej OL – 4-15%.5 Histologicznie zmiany OEL charakteryzują się zmianami nabłonkowymi w postaci hiperkeratozy, hiperplazji, atrofii, pewnego stopnia dysplazji nabłonka, raka in situ lub raka powierzchownie inwazyjnego. Ponadto zmiany OEL mają wyższe wskaźniki mitotyczne i apoptotyczne niż homogenne i guzkowe zmiany OL6.
Postępowanie w schorzeniach potencjalnie złośliwych może stanowić wyzwanie. Leczenie kliniczne polega na eliminacji czynników ryzyka,7 obserwacji,8 stosowaniu retinoidów,9 witamin A, C, E, ketorolaku, celekoksybu, zielonej herbaty, fenretinidu, likopenu,10 i terapii fotodynamicznej.5,11-14 Leczenie chirurgiczne polega na usunięciu zmiany, kriochirurgii i ablacji laserowej.15
Celem niniejszej pracy było (1) przedstawienie szczegółów klinicznych i histologicznych OEL na błonie śluzowej szyi oraz (2) przegląd piśmiennictwa dotyczącego cech demograficznych, klinicznych i histologicznych OEL, a także rokowania i leczenia.
OPIS PRZYPADKU
41-letni mężczyzna rasy kaukaskiej, palacz tytoniu, zgłosił się do Kliniki Medycyny Jamy Ustnej Uniwersytetu Stanowego w Maringá w Brazylii z powodu bezobjawowej zmiany po lewej stronie błony śluzowej jamy szyjnej o nieznanym czasie rozwoju. W badaniu wewnątrzustnym stwierdzono czerwoną blaszkę w okolicy przedtrzonowca i białą guzkową blaszkę w okolicy trzonowca (ryc. 1).
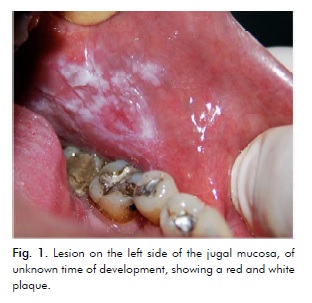
Przypuszczalnym rozpoznaniem był OEL lub rak kolczystokomórkowy. Próbki biopsyjne zostały pobrane z bardziej tylnego białego obszaru guzkowego i z bardziej przedniego czerwonego obszaru.
Badanie histopatologiczne z użyciem barwienia hematoksyliną i eozyną ujawniło hiperkeratozę i zanik, z ogniskowym carcinoma in situ w bardziej przednim czerwonym regionie, zgodnym z carcinoma in situ w OEL. Badanie wykazało również hiperkeratozę z umiarkowaną dysplazją w bardziej tylnej białej części, zgodną z rozpoznaniem OL. Warstwowy nabłonek płaski pokrywający błonę śluzową wykazywał różny stopień orto- i parakeratozy, a komórki grzebienia rombowego wykazywały hiperchromatyzm i pleomorfizm w około połowie grubości nabłonka. Jednakże na mniejszym obszarze stwierdzono bardziej wyraźne cechy dysplastyczne w całym nabłonku, ale bez cech wzoru naciekowego (ryc. 2A). Cechy te obejmowały zdezorganizowaną i zmienioną stratyfikację, projekcje kropli na przemian z atrofią (ryc. 2A i 2B), nietypowy stosunek jąder do cytoplazmy, hiperchromatyzm, pleomorfizm, utratę adhezji międzykomórkowej z rzadkimi figurami mitotycznymi (ryc. 2C) oraz ogniska dyskeratotyczne (ryc. 2D). Tkanka łączna leżąca u podłoża tych obszarów wykazywała bardziej nasilone zmiany zapalne.
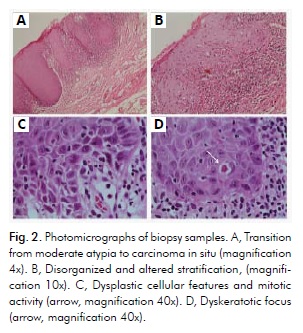
Cechy kliniczne i mikroskopowe były zgodne z rozpoznaniem OEL związanego z ogniskowym rakiem in situ. Na tym etapie pacjentowi udzielono dokładnych wyjaśnień na temat możliwości leczenia: (1) mógł zostać skierowany do chirurga szyi i głowy, który prawdopodobnie zastosowałby podejście inwazyjne, związane lub nie z radioterapią; (2) mógł poddać się leczeniu ambulatoryjnemu w Poradni Medycyny Jamy Ustnej z zastosowaniem bardziej zachowawczego podejścia, które pozwoliłoby na zachowanie zarówno aspektów estetycznych, jak i funkcjonalnych. Pacjent wybrał drugą opcję i podpisał odpowiedni formularz świadomej zgody (załącznik A).
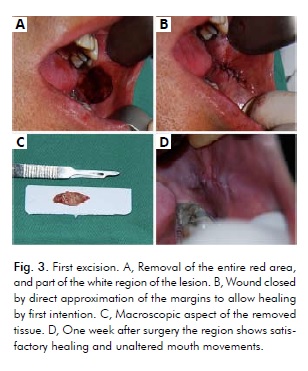
Z uwagi na rozległe rozmiary zmiany oraz fakt, że pojedyncze duże wycięcie mogłoby ograniczyć ruchy ust, postępowanie chirurgiczne składało się z trzech wielokrotnych wycięć przy użyciu skalpela, wykonanych w okresie 2 miesięcy, z zachowaniem 30-dniowego odstępu pomiędzy poszczególnymi zabiegami. Ze względu na obecność carcinoma in situ w obszarze czerwonym, pierwszy zabieg polegał na jego wycięciu w całości, jak również części białego obszaru zmiany, z zastosowaniem 5-mm marginesu bezpieczeństwa (ryc. 4). Dodatkowo pacjent został poinstruowany o konieczności zaprzestania palenia tytoniu.
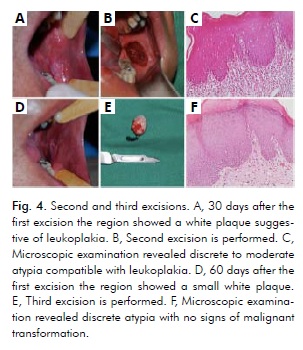
W badaniu klinicznym miesiąc po pierwszym wycięciu stwierdzono białą blaszkę sugerującą leukoplakię (ryc. 4A). Następnie wykonano drugie wycięcie (ryc. 4B), a badanie mikroskopowe wykazało dyskretną do umiarkowanej atypię (ryc. 4C). Badanie wewnątrzustne dwa miesiące po pierwszym wycięciu wykazało małą białą blaszkę położoną jeszcze bardziej tylno niż poprzednio (ryc. 4D). Następnie wykonano trzecie wycięcie (ryc. 4E), które ujawniło dyskretną atypię (ryc. 4F). Zarówno drugie, jak i trzecie wycięcie wykonano w bardziej tylnej okolicy trzonowca, stosując ten sam 5-mm margines bezpieczeństwa. Tkanki z tych dwóch wycięć były zgodne z leukoplakią bez cech transformacji złośliwej (Ryc. 4C, Ryc. 4F).
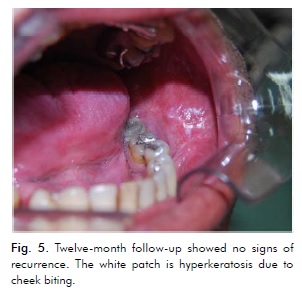
Pacjentka zaprzestała palenia i jest pod ścisłą obserwacją, widywana co tydzień przez pierwsze trzy miesiące, co miesiąc do roku, a następnie co trzy miesiące. Po 15 dniach od trzeciego i ostatniego wycięcia nie zaobserwowano żadnych oznak nawrotu, co potwierdzono podczas 12-miesięcznej wizyty kontrolnej (ryc. 5).
DISCUSSION
OEL jest uważany za niejednorodną leukoplakię z mieszanymi białymi i czerwonymi blaszkami i charakteryzuje się wysokim ryzykiem transformacji złośliwej.2-4 Obszary czerwone lub erytroplakia wydają się być bardziej podatne na zmiany dysplastyczne niż białe obszary hiperkeratotyczne,7 co stwierdzono w omawianym przypadku, przy czym najwięcej komórek atypowych obserwowano w obszarze czerwonym. Yen i wsp. (2008)16 stwierdzili, że używanie kwidu betelowego i papierosów wiązało się z 42,2% ryzykiem rozwoju leukoplakii i 95,0% ryzykiem rozwoju OEL po 20 latach obserwacji. W omawianym przypadku pacjent palił około dziesięciu papierosów dziennie przez 20 lat, a wstępna biopsja ujawniła raka in situ związanego z OEL.
Ponieważ sposoby leczenia OEL są zróżnicowane, wybór odpowiedniej terapii może stanowić wyzwanie. Biorąc pod uwagę stopień zaawansowania i wysoki potencjał złośliwości, można się zastanawiać, czy leczenie powinno być zachowawcze czy inwazyjne. W celu weryfikacji najczęściej stosowanych metod leczenia dokonano przeglądu piśmiennictwa dotyczącego tego zagadnienia. Źródłem były bazy danych Medline i Lilacs, teksty musiały być napisane w języku angielskim, a wyszukiwane hasła to oral AND nonhomogeneous OR no homogeneous AND leukoplakia OR erythroleukoplakia. Zastosowano leukoplakię niejednorodną, ponieważ wielu autorów uważa ją za synonim erytroleukoplakii. Odnaleziono 8 prac dotyczących leczenia OEL,5,7,14,16-19 opublikowanych w latach 1987-2010. Z ogólnej liczby 226 przypadków, 211 leczono metodą kliniczną (terapia fotodynamiczna i obserwacja kliniczna), a 15 leczono wycięciem chirurgicznym (tab. 1).
Jeśli chodzi o podejście kliniczne, terapia fotodynamiczna (PDT) jest stosowana w leczeniu potencjalnie złośliwych schorzeń, ponieważ jest nieinwazyjna, dobrze tolerowana przez pacjentów, może być stosowana wielokrotnie bez skumulowanych działań niepożądanych i powoduje niewielkie tworzenie się blizn. 5,11,13,14 Jednak technika ta wykazała zmienne powodzenie, niespójne wyniki obserwacji i nawroty.17 Rzeczywiście, nawroty choroby przy zastosowaniu PDT mogą wynosić od 21%5 do 29%14.
W podwójnie ślepym badaniu kontrolowanym placebo 17 stwierdzono, że witamina A i beta-karoten, stosowane samodzielnie, wykazały lepsze wyniki w przypadku homogennych leukoplakii i mniejszych zmian. W związku z tym stosowanie zarówno witaminy A, jak i betakarotenu było wątpliwe w omawianym przypadku, ze względu na wielkość zmiany i związany z nią rak in situ.
Tradycyjnym sposobem leczenia OEL jest jego całkowite wycięcie,15,21,22 szczególnie w przypadku zmian z ciężką dysplazją.21,22 Całkowite wycięcie pozwala na analizę histologiczną całej zmiany, co może ujawnić zmiany niezdiagnozowane w biopsji przedoperacyjnej.8 Ponadto, zgodnie z naszą najlepszą wiedzą, w długoterminowych badaniach nie wykazano jeszcze, czy po leczeniu nieoperacyjnym dochodzi do nawrotu choroby.20,23 W dwóch z ośmiu analizowanych badań w leczeniu OEL zastosowano wycięcie chirurgiczne,8,19 przy czym częstość nawrotów wahała się od 10,1%19 do 20%8.
W niniejszym badaniu zdecydowano się na podejście chirurgiczne, ponieważ biopsja ujawniła początkową transformację złośliwą. Ponadto, ze względu na duży rozmiar zmiany, wybrano wielokrotne wycięcia związane z bezpiecznymi marginesami, ponieważ duża rana może ograniczać ruchy ust i komplikować gojenie pooperacyjne. Ta opcja pozwoliła również na wykonanie uzupełniających badań mikroskopowych, które wykazały różny stopień atypii, co ukierunkowało leczenie. Podczas zabiegów chirurgicznych zwracano szczególną uwagę na to, aby nie zasłaniać otworu przewodu ślinowego, aby nie dopuścić do zaniku gruczołu i uniknąć dalszych powikłań, takich jak śluzak czy zmniejszenie przepływu śliny. Rana została zamknięta przez bezpośrednie zbliżenie brzegów, co umożliwiło gojenie w pierwszej intencji i nie spowodowało istotnego zmniejszenia otworu ust.
Vedtofte i wsp. (1987)8 podają, że ubytek błony śluzowej spowodowany wycięciem może być naprawiony według drugiej intencji lub zamknięty innymi technikami, takimi jak bezpośrednie zbliżenie brzegów rany, transpozycja za pomocą miejscowego płata śluzówkowego, wolny przeszczep śluzówkowy i wolny przeszczep skóry dzielonej. O ile nam wiadomo, nie ma badań z zastosowaniem przeszczepów alloplastycznych w przypadku zmian potencjalnie złośliwych, których leczenie może powodować duże ubytki. Chociaż przeszczepy mogą być stosowane do odtwarzania rozległych miejsc pooperacyjnych, za czym opowiada się kilku autorów,8,24 mogą one być zakażone Candida sp, ulegać pooperacyjnemu obkurczeniu, deformacjom i maskować wczesne objawy nawrotu choroby8.
Laser i krioterapia mogą być stosowane samodzielnie lub w połączeniu z tradycyjnymi metodami chirurgicznymi w leczeniu OEL. Cantarelli Morosolli i wsp. (2006)7 opisali udany przypadek choroby leczonej wycięciem i naświetlaniem laserem dwutlenkowo-węglowym. W badaniach kohortowych stwierdzono, że chirurgia laserowa odgrywa istotną rolę w diagnostyce i leczeniu zmian potencjalnie złośliwych.10,18,25,26 Zastosowanie kriochirurgii, choć opisywane w piśmiennictwie,9 ma wspólną z ablacją laserową główną wadę, jaką jest brak możliwości pobrania całej zmiany do badania histologicznego.27,28 Ponadto krioterapia powoduje znaczny ból i obrzęk pooperacyjny, a zmiany potencjalnie złośliwe rzadko ulegają całkowitemu zniszczeniu.10
Vedtofte i wsp. (1987)8 stwierdzili, że zmiany przedzłośliwe leczone przez wycięcie chirurgiczne wykazywały ogólny odsetek nawrotów wynoszący 20%, często rozpoznawanych w ciągu pierwszego roku po zabiegu. Większość nawrotów OEL stwierdzano w miejscach sąsiadujących z poprzednio leczoną zmianą. Nawrotowość erytroplakii i leukoplakii brodawkowatej wynosiła odpowiednio 40% i 55,6%. Leukoplakia nie wykazywała nawrotów. Dwa przypadki OEL przekształciły się w raka, podobnie jak jeden przypadek leukoplakii brodawkowatej. Wznowy zmian potencjalnie złośliwych często sąsiadowały z wyciętą zmianą, prawdopodobnie dlatego, że margines bezpieczeństwa 3-5 mm nie usuwał całej zmienionej chorobowo tkanki. Autorzy uważają, że wycięcie chirurgiczne jest zadowalającym sposobem leczenia zmian potencjalnie złośliwych i podkreślają znaczenie stosowania techniki umożliwiającej badanie histologiczne całej zmiany.
Trudności w dokładnym określeniu marginesu zmiany są szczególnie częste w przypadku erytroplakii lub OEL,8 co może tłumaczyć wysoki odsetek nawrotów tych zmian. W celu uniknięcia pozostawienia patologicznych tkanek w miejscu operowanym i zminimalizowania ryzyka nawrotu, w niniejszym badaniu zdecydowano się na wielokrotne wycięcia. Ruchy ust są prawidłowe i nie ma objawów nawrotu. Ponadto ryzyko nawrotu i transformacji złośliwej zmniejsza się wraz z eliminacją czynników ryzyka, takich jak zaprzestanie palenia tytoniu i picia alkoholu. Pacjentka została pouczona o konieczności zaprzestania palenia papierosów i zaprzestała ich palenia, pozostając obecnie pod ścisłą obserwacją.
W przedstawionym opisie przypadku zaproponowano zachowawczą metodę leczenia chirurgicznego OEL. Mimo że jest to nadal zabieg chirurgiczny, jest on mało inwazyjny w porównaniu z tradycyjnymi metodami stosowanymi zarówno przez chirurgów głowy i szyi, jak i onkologów. Ich typowe podejście polega na bardziej radykalnych i rozległych wycięciach, które zwykle prowadzą do okaleczenia i upośledzenia zarówno wyglądu estetycznego, jak i funkcji. Decyzja, czy zastosować podejście radykalne, czy bardziej zachowawcze, jest trudna do podjęcia, ponieważ dotychczasowe badania nie ustaliły jednego protokołu postępowania w takich przypadkach. Wybór sposobu postępowania w przypadkach takich jak opisany w niniejszej pracy wymaga dokładnej oceny indywidualnych okoliczności, z uwzględnieniem stopnia atypii komórkowej, lokalizacji i dostępu do zmiany, a także jej wielkości. Uważamy, że w zasadzie zmiany te nie powinny być traktowane jako nowotwory złośliwe, co pozwala uniknąć rutynowego protokołu dużych resekcji i terapii adjuwantowych, takich jak radioterapia. Ponadto uważamy, że należy pamiętać, że carcinoma in situ nie jest inwazyjny. Jego chirurgiczne usunięcie, wraz z zaprzestaniem czynników ryzyka, takich jak palenie tytoniu, oraz stałym monitorowaniem może przełożyć się na powodzenie leczenia. Ponadto wielokrotne operacje pozwalały na wielokrotne badania mikroskopowe, co dawało pacjentowi bardziej uspokajającą perspektywę i pewność, że w tym regionie nie ma złośliwych komórek.
REFERÊNCIAS
1. Küffer R, Lombardi T. Zmiany przednowotworowe błony śluzowej jamy ustnej. A discussion about the place of oral intraepithelial neoplasia (OIN). Oral Oncol. 2002;38:125-30.
2. Van der Waal I. Potencjalnie złośliwe schorzenia błony śluzowej jamy ustnej i gardła; terminologia, klasyfikacja i współczesne koncepcje postępowania. Oral Oncol. 2009;45:317-23.
3. Van der Waal I. Potencjalnie złośliwe schorzenia błony śluzowej jamy ustnej i gardła; współczesne koncepcje postępowania. Oral Oncol. 2010;46423-5.
4. Warnakulasuriya S, Johnson NW, van der Waal I. Nomenclature and classification of potentially malignant disorders of the oral mucosa. J Oral Pathol Med. 2007;36:575-80.
5. Yu CH, Lin HP, Chen HM, Yang H, Wang YP, Chiang CP. Comparison of clinical outcomes of oral erythroleukoplakia treated with photodynamic therapy using either light-emitting diode or laser light. Lasers Surg Med. 2009;41:628- 33.
6. Kövesi G, Szende B. Changes in apoptosis and mitotic index, p53 and Ki67 expression in various types of oral leukoplakia. Oncology. 2003;65:331-6.
7. Cantarelli Morosolli AR, Schubert MM, Niccoli- Filho W. Surgical treatment of erythroleukoplakia in lower lip with carbon dioxide laser radiation. Lasers Med Sci. 2006;21:181-4.
8. Vedtofte P, Holmstrup P, Hjørting-Hansen E, Pindborg JJ. Surgical treatment of premalignant lesions of the oral mucosa. Int J Oral Maxillofac Surg. 1987;16:656-64.
10. Thomson P. Oral Precancer – Diagnosis and Management of Potentially Malignant Disorders. Hoboken: Wiley-Blackwell: 2012; s. 107-136.
11. Dolmans DE, Fukumura D, Jain RK. Photodynamic therapy for cancer. Nat Rev Cancer. 2003;3:380-7.
12. Lee MR, Ryman W. Erythroplasia of Queyrat treated with topical methyl aminolevulinate photodynamic therapy. Australas J Dermatol. 2005;46:196-8.
13. Chen HM, Yu CH, Tsai T, Hsu YH, Kuo RC, Chiang CP. Topical 5-aminolevulinic acidmediated photo-dynamic therapy for oral verrucous hyperplasia, oral leukoplakia and oral erythroleukoplakia. Photodiagn Photodyn Ther. 2007;4:44-52.
14. Lin HP, Chen HM, Yu CH, Yang H, Wang YP, Chiang CP. Topical photodynamic therapy is very effective for oral verrucous hyperplasia and oral erythroleukoplakia. J Oral Pathol Med. 2010;39:624-30.
15. Reichart PA, Philipsen P. Oral erythroplakia: a review. Oral Oncol. 2005; 41:551-61.
16. Yen AM, Chen SC, Chang SH, Chen TH. The effect of betel quid and cigarette on multistate progression of oral pre-malignancy. J Oral Pathol Med. 2008;37: 417-22.
17. Sankaranarayanan R, Mathew B, Varghese C, Sudhakaran PR, Menon V, Jayadeep A, Nair MK, Mathews C, Mahalingam TR, Balaram P, Nair PP. Chemoprewencja leukoplakii jamy ustnej z witaminą A i beta karotenem: ocena. Oral Oncol 1997; 33: 231-6.
18. Schoelch ML, Sekandari N, Regezi JA, Silverman S Jr. Laser management of oral leukoplakias: a follow-up study of 70 patients. Laryngoscope 1999; 109: 949-53.
19. Pandey M, Thomas G, Somanathan T, Sankaranarayanan R, Abraham EK, Jacob BJ, Mathew B. Evaluation of surgical excision of nonhomogeneous oral leukoplakia in a screening intervention trial, Kerala, India. Oral Oncol. 2001;37:103-9.
20. Spinola Ribeiro A, Ribeiro Salles P, da Silva TA, Alves Mesquita R. A Review of the nonsurgical treatment of oral leukoplakia. Int J Dent 2010; Article ID 186018, 10 stron, 2010. doi:10.1155/2010/186018.
21. Marley JJ, Cowan CG, Lamey PJ, Linden GJ, Johnson NW, Warnakulasuriya KA. Management of potentially malignant oral mucosal lesions by consultant UK oral and maxillofacial surgeons. Br J Oral Maxillofac Surg. 1996;34:28-36.
22. Marley JJ, Linden GJ, Cowan CG, Lamey PJ, Johnson NW, Warnakulasuriya KAAS, Scully C. A comparison of the management of potentially malignant oral mucosa lesions by oral medicine practitioners and oral and maxillofacial surgeons in the UK. J Oral Pathol Med. 1998;27: 489-95.
23. Lodi G, Sardella A, Bez C, Demarosi F, Carrasi A. Intervations for treatings oral leukoplakia. Cochrane Database Syst Ver. 2006;4:CD001929.
24. Frame JW, Das Gupta AR, Dalton GA, Evans EH. Use of the carbon dioxide laser in the management of premalignant lesions of the oral mucosa. J Laryngol Otol. 1984;98:1251-60.
25. Stocker J, Thomson PJ, Hamadah O. Chirurgia laserowa w onkologii jamy ustnej – doświadczenia z Newcastle. The Surgeon 2005; Suppl 3: S32-33.
26. Hamadah O, Thomson PJ. Factors affecting carbon dioxide laser treatment for oral precancer: a patient cohort study. Lasers Surg Med 2009; 41: 17-25.
28. Sako K, Marchetta FC, Hayes RL Cryotherapy of intraoral leukoplakia. Am. J. Surg. 1972:124:482-4.