Jak widzieliśmy, nasza dieta zawiera wiele węglowodanów, i można się zastanawiać, czy istnieje sposób, aby przeanalizować próbkę, aby powiedzieć, czy to sacharoza, lub jeden z syntetycznych słodzików, takich jak sorbitol lub syropu kukurydzianego o wysokiej zawartości fruktozy, a nawet związek, taki jak witamina C, który jest syntetyzowany z cukrów i jak oni, zawiera tylko C, H i O. Istnieje taki sposób, i jest to jedna z najbardziej fundamentalnie ważnych form analizy, zwana analizą elementarną. Jest to jedna z pierwszych metod stosowanych przez naukowców do identyfikacji nowego związku.
Do tej pory uzyskaliśmy wszystkie współczynniki stechiometryczne ze współczynników zrównoważonych równań chemicznych. Wzory chemiczne również wskazują względne ilości substancji, jednak i z nich można wyprowadzić współczynniki stechiometryczne. Na przykład, wzór CO2 mówi nam, że niezależnie od tego, jak dużą próbkę dwutlenku węgla mamy, na każdy mol atomów węgla zawsze przypadną 2 mole atomów tlenu. To znaczy, że ze wzoru CO2 mamy stosunek stechiometryczny
Możemy również określić, że dla CO2
(Odwrotności tych stosunków stechiometrycznych są również ważne dla CO2.)
Stosunki stechiometryczne pochodzące ze wzorów zamiast równań są zaangażowane w najbardziej powszechną procedurę określania wzorów empirycznych związków, które zawierają tylko C, H i O. Odważona ilość substancji, która ma być analizowana jest umieszczona w pociągu spalinowym i ogrzewana w strumieniu suchego O2. Cały H w związku jest przekształcany do H2O(g), który jest selektywnie wychwytywany w uprzednio zważonej rurce absorpcyjnej. Cały C jest przekształcany w CO2(g), który jest selektywnie pochłaniany w drugiej rurce. Wzrost masy każdej rurki mówi, odpowiednio, ile H2O i CO2 powstało w wyniku spalania próbki
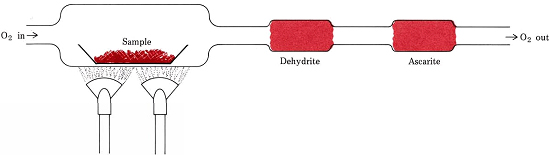
Figure \(\PageIndex{1}} A combustion train. H2O i CO2, powstałe w wyniku połączenia O2 z H i C w próbce, są selektywnie pochłaniane przez rurki zawierające dehydryt i askaryty (NaOH na azbeście).
Przykład \(\PageIndex{1}}): Empirical Formula of Ascorbic Acid
Próbka 6,49-mg kwasu askorbinowego (witamina C) została spalona w pociągu spalinowym. Powstało 9,74 mg CO2 i 2,64 mg H2O. Wyznacz wzór empiryczny kwasu askorbinowego.
Rozwiązanie Musimy znać ilość C, ilość H i ilość O w próbce. Stosunek tych daje subskryptów we wzorze. Pierwsze dwa można otrzymać z mas CO2 i H2O, stosując masy molowe i współczynniki stechiometryczne
Tak więc
Związek mógł zawierać również tlen. Aby sprawdzić, czy tak jest, oblicz masy C i H i odejmij od całkowitej masy próbki
Mamy zatem
i
Stosunki ilości pierwiastków w kwasie askorbinowym wynoszą zatem
Ponieważ nC:nH:nO wynosi 3 mol C:4 mol H:3 mol O, wzór empiryczny to C3H4O3.
Przedstawiono tu rysunek cząsteczki kwasu askorbinowego. Możesz określić, licząc atomy, że wzór cząsteczkowy jest C6H8O6-dokładnie podwoić wzór empiryczny. Oczywiste jest również, że o cząsteczce można wiedzieć więcej niż tylko to, ile atomów każdego rodzaju jest w niej obecnych. W kwasie askorbinowym, podobnie jak w innych cząsteczkach, bardzo ważny jest sposób, w jaki atomy są ze sobą połączone, oraz ich rozmieszczenie w przestrzeni trójwymiarowej. Obraz pokazujący, które atomy są połączone z którymi, nazywany jest wzorem strukturalnym. Wzory empiryczne można uzyskać na podstawie składu procentowego lub eksperymentów spalania, a jeśli znana jest masa cząsteczkowa, z tych samych danych można wyznaczyć wzory cząsteczkowe. Bardziej skomplikowane eksperymenty są wymagane do znalezienia wzorów strukturalnych. W przykładzie 2 otrzymaliśmy masę O odejmując masy C i H od całkowitej masy próbki. Zakładaliśmy, że w próbce znajdują się tylko C, H i O. Czasami takie założenie może być błędne. Czasami takie założenie może być błędne. Kiedy po raz pierwszy wyizolowano i przeanalizowano penicylinę, przeoczono fakt, że zawiera ona siarkę. Błąd ten nie został odkryty przez jakiś czas, ponieważ masa atomowa siarki jest prawie dokładnie dwa razy większa od masy atomowej tlenu. Dwa atomy tlenu zostały podstawione w miejsce jednego atomu siarki we wzorze.
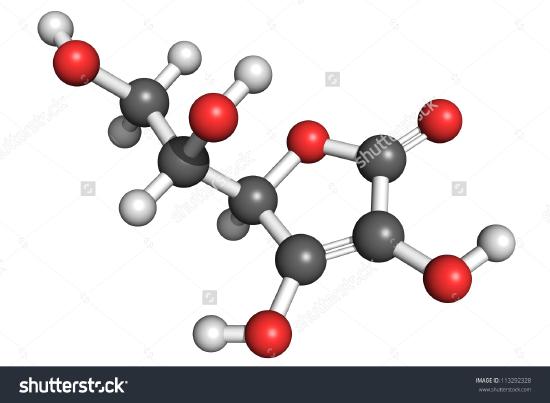
Rysunek ™ (™PageIndex{2}) Trójwymiarowa reprezentacja kwasu L-askorbinowego 1
Z ChemPRIME: 3.4: Analiza Związków