Introduction
Perhaps the first reference in human history to the absorption of iron and alcohol dates back to 1200 BC, a legend from Thessaly tells how Apolodorus of Iphycus, standing in a field watching his father castrate lambs, was threatened by the same punishment; when he became an adult, Apolodorus was impotent. Czarownik o imieniu Melampus, zainspirowany przez sępa, wyleczył Apolodorusa, każąc mu wypić w kieliszku wina rdzę z noża, którym jego ojciec kastrował jagnięta i którym mu grożono.
Liczna jest populacja pacjentów alkoholików widzianych w naszym szpitalu, jak również tych wymagających hospitalizacji, biorąc pod uwagę wszystkie jednostki chorobowe, które jej towarzyszą.
Naszym celem poprzez ten komunikat jest przypomnienie jednej z patologii hematologicznych obecnych w alkoholizmie, która często może się cofnąć wraz z samą abstynencją: niedokrwistość sideroblastyczna i hemosideroza.
Bjorkman w 1956 roku opisał czterech pacjentów z przewlekłą oporną anemią i pierścieniami sideroblastycznymi, u których komórki szpiku kostnego zabarwiono błękitem pruskim.
Pierwsze dowody na to, że te pierścienie sideroblastyczne były związane z alkoholem zostały zaproponowane przez Mac Gibbona i Mollina w 1965 r., od kiedy alkoholizm stał się najczęstszą przyczyną tej patologii.
W 1969 r. Hines (zastępując i przez 1) opisał w przewlekłym alkoholizmie występowanie odwracalnej niedokrwistości sideroblastycznej spowodowanej abstynencją.
Wpływ alkoholu
Wielorakie patologiczne skutki działania alkoholu(wymienić przez 2) na tkankę krwiotwórczą można podzielić na:
Te wynikające z bezpośredniego działania alkoholu
Te wynikające z efektów wtórnych do niedoborów żywieniowych
Te spowodowane przez choroby wątroby
Anemia jest częstą przyczyną u alkoholików.(zastąpić przez 3) Spośród nich najczęstsze to anemia megaloblastyczna i anemia sideroblastyczna.
Te ostatnie byłyby związane z czynnikami żywieniowymi i zaburzeniami metabolizmu witaminy B6.
Zmniejszenie zdolności pirydoksyny do konwersji do fosforanu pirydoksalu, aktywnej postaci witaminy B6, zostało wykazane w wyniku zahamowania aktywności fosfokinazy pirydoksalu erytrocytów.
Zasugerowano również, że etanol może działać jako stymulator błonowej fosfatazy alkalicznej poprzez przyspieszenie degradacji komórkowego fosforanu pirydoksalu (zastąpić przez 4). Ta zmiana w metabolizmie pirydoksyny jest potwierdzona przez zmniejszenie wydalania z moczem kwasu 4-pirydoksycznego, który jest metabolitem pirydoksyny, oraz zmniejszenie stężenia fosforanu pirydoksalu w surowicy.
Fosforan pirydoksalu działa również jako czynnik adiuwantowy w syntezie kwasu delta-aminolewulinowego, który jest jednym z prekursorów frakcji hemoglobiny zawierającej żelazo, czyli hemo.
Inne badania wykazały, że etanol działa nie tylko bezpośrednio, ale również poprzez swój metabolit – aldehyd octowy. Acetaldehydowi przypisuje się również nasilenie degradacji fosforanu pirydoksalu, co prowadzi do zmniejszenia stężenia fosforanu pirydoksalu w surowicy oraz pogorszenia tworzenia się fosforanu pirydoksalu w ludzkich czerwonych krwinkach in vitro poprzez przyspieszenie degradacji fosforylowanych związków witaminy B6.
Gdy metody barwienia żelaza (barwienie błękitem pruskim i perłami) są używane, granulki metalu zawierające żelazo niehemowe, przypuszczalnie w formie hemosyderyny lub ferrytyny mają tendencję do tworzenia pierścienia wokół jądra erytroblastów. Są one nazywane pierścieniami sideroblastów lub sideroblastami pierścieniowymi.
Mikroskopia elektronowa wykazała, że te sideroblasty mają złogi żelaza na poziomie mitochondriów lub ciał cytoplazmatycznych.
Te morfologiczne nieprawidłowości są związane ze wszystkimi cechami nieefektywnej erytropoezy: hiperplazją erytroidów, zwiększonym wychwytem żelaza przez prekursory erytroidów szpiku kostnego, nieprawidłowym wbudowywaniem żelaza do krążącej hemoglobiny z cofaniem się żelaza do krążenia, co powoduje hiperferremię, wewnątrz szpikowe niszczenie normoblastów, niedokrwistość i retikulocytopenię.
Częstotliwość występowania pierścienia sideroblastycznego w szpiku erytroidalnym jest większa u pacjentów przewlekle chorych, a także u niedożywionych alkoholików.
Kliniczne i eksperymentalne dowody sugerują, że czynnik odżywczy jest ważne w patogenezie niedokrwistości sideroblastycznej u pacjentów alkoholowych.
Eksperymentalne przewlekłe podawanie alkoholu w ludzkich ochotników spowodował zmiany sideroblastyczne w szpiku kostnym.
Gdy alkohol był podawany z niskim diety pirydoksyny i folianów, pierścienie
sideroblasts opracowany po kilku tygodniach w większości badanych podmiotów.
W 1970 Hines i Cowan wspomnieć zmiany w fosforylacji pirydoksyny do fosforanu pirydoksalu potwierdzając w ten sposób zaburzenia w metabolizmie pirydoksyny przez trzy linie dochodzenia:
Zmniejszona fosforanu pirydoksalu i pierścienie sideroblastic zostały wyprodukowane w 2 z 3 podmiotów, które były utrzymywane na niskich folianów diety z suplementacją alkoholu. Następnie wykazały odpowiedź hematologiczną po podaniu fosforanu pirydoksalu, ale nie z kwasem foliowym lub pirydoksyny therapeutics.
Po podaniu pirydoksyny w przewlekle chorych alkoholików, jest niedobór w tworzeniu fosforanu pirydoksalu w porównaniu z kontrolami.
Opisują one zmniejszenie in vitro konwersji pirydoksyny do fosforanu pirydoksalu przez enzym erytrocytów u osób uzależnionych od alkoholu. Prowadzi to do postulatu bezpośredniej supresji fosforylazy pirydoksynowej erytrocytów przez alkohol. Jednak alternatywne wyjaśnienie spadku fosforanu pirydoksalu sugeruje, że aldehyd octowy, główny metabolit alkoholu, stymuluje aktywność fosfatazy błonowej, a także zmniejsza ilość fosforanu pirydoksalu przenoszonego z krwinki czerwonej do przedziału osocza.
Jednak niezależnie od mechanizmu, wynik jest taki sam, wszystko prowadzi do zwiększenia ilości Fe zawartego w erytroblastach (sideroblasty)
Sideroblastoza polega na słabym wbudowaniu żelaza do krwinki czerwonej, co skutkuje hipochromią, nieefektywną erytropoezą i zwiększoną sideremią.
Hemosiderosis w alkoholików (zastąpić przez 5) Szeroka gama przyczyn przeciążenia żelaza w alkoholików zostały implikowane samodzielnie lub zbiorowo, w tym znaczny wzrost żelaza niektórych napojów alkoholowych (zwłaszcza wina), zwiększone wydzielanie kwasu solnego w żołądku wywołane etanolem, hemoliza, utrata krwi z przewodu pokarmowego, niedobór kwasu foliowego, zwiększone wchłanianie jelitowe spowodowane uszkodzeniem wątroby i uszkodzeniem trzustki, dalsze nasilenie objawów ubocznych i doprowadzenie do hemosiderozy.
Kilka badań dokumentuje zwiększone poziomy ferrytyny w surowicy u pacjentów alkoholików, odzwierciedlając zwiększone żelazne stores.
Po podaniu chelatorów żelaza, takich jak desferroksamina i późniejszy pomiar siderurii, żelazne sklepy mogą być półilościowo ocenione. U alkoholików wydalanie żelaza po tych chelatorach jest również zwiększone w stosunku do kontroli.
Jednakże inne badania wykazują u hospitalizowanych pacjentów alkoholików, że zarówno żelazo w surowicy i/lub stężenia ferrytyny są w granicach normy lub rzadziej podwyższone. Różnice te mogą wynikać z doboru pacjentów włączonych do badania; jeśli pacjenci mają krwawienie z przewodu pokarmowego z powodu żylaków przełyku, mogą mieć wyczerpane zapasy żelaza, nawet jeśli przed krwawieniem były one wyższe niż normalnie.
Wreszcie, należy zauważyć, że w większości badań przeprowadzonych w celu pomiaru żelaza w surowicy, były one zawsze znaleźć podwyższone w alkoholików, z korelacją między złogi żelaza i ilości spożywanego alkoholu, sugerując, że ten element jest przyczyną siderosis.
Wchłanianie żelaza
Około 5 do 15 mg żelaza spożywanego dziennie, tylko 10% jest wchłaniane.
Faktory wpływające na wchłanianie żelaza mogą interweniować na trzech poziomach: intraluminalnym, śluzówkowym i ogólnym.
Na poziomie intraluminal, wchłanianie żelaza jest znany zależy od interakcji różnych pokarmów, tak, że niektóre, takie jak aminokwasy, ułatwić wchłanianie i inne mogą zmniejszyć go. Brak wydzieliny trawiennej może być czynnikiem, który modyfikuje absorpcję.
W próbie wyjaśnienia hemosiderosis, po raz pierwszy myślano, że dieta pacjentów alkoholowych był bardzo bogaty w tym elemencie. Obserwacja ta opierała się na tym, co nazywa się hemosiderozą bantusa lub hemosiderozą bantusa. Badania przeprowadzone przez Południowoafrykańczyków na tych plemionach wykazały, że przygotowywany przez nie napój zwany kefirem, rodzaj piwa, był warzony w żelaznych naczyniach, a zawartość żelaza wynosiła od 30 do 100 mg na litr. Zawartość alkoholu w napoju była bardzo niska, a oni spożywali go w dużych ilościach, do 1000 mg żelaza dziennie. Produkcja kefiru nie jest już prowadzona, co w konsekwencji doprowadziło do zaniku hemosiderozy w tym plemieniu.
Ilości żelaza obecne w różnych napojach alkoholowych są bardzo zróżnicowane, osiągając w niektórych przypadkach do 350 mg na litr (Rumunia), chociaż ogólnie można uznać, że wino (białe, bordo lub czerwone) jest bogate w ten metal.
Ale istnieje również wielu alkoholików, których głównym napojem nie jest wino, ale whisky, piwo lub inne, które zawierają znikome ilości żelaza.
Z drugiej strony, pomimo badań nad bantusem, nadmiar żelaza w diecie nie jest wystarczającym powodem do rozwoju hemosiderozy. Tak więc w Etiopii podstawą diety jest teff, ziarno zawierające dużą ilość żelaza, którego dzienne spożycie wynosi od 300 do 500 mg tego metalu. Pomimo tego spożycia depozytów nie są zwiększone i częstotliwość niedokrwistości z niedoboru żelaza nie różni się od populacji ogólnej.
Jest oczywiste, że ilość żelaza w żywności nie ma wartości.
Do tej pory wydaje się, że alkohol nie odgrywa żadnej roli na poziomie intraluminal we wchłanianiu żelaza.
Na poziomie ogólnym wiadomo, że stan zapasów żelaza będzie warunkował ich wchłanianie; jeśli są one zmniejszone, wchłanianie wzrasta i odwrotnie. Erytropoeza jest również zaangażowany na tym poziomie, zwiększając jego absorpcję, gdy wzrasta. Alkohol nie wydaje się przyspieszać obrotu żelaza w osoczu, co mogłoby wyjaśnić wzrost jego absorpcji.
Na poziomie błony śluzowej, ilość żelaza zawartego w błonie śluzowej, jak również poziom syntezy białek, może wpływać na wchłanianie żelaza. Wykazano, że niedobór kwasu foliowego po spożyciu alkoholu może być odpowiedzialny za zwiększone wchłanianie żelaza i następczą siderozę, która nasila szkodliwe działanie alkoholu na narządy miąższowe, a zwłaszcza na wątrobę.
W badaniach na zwierzętach wykazano, że przewlekłemu podawaniu alkoholu może towarzyszyć zwiększenie jelitowego wchłaniania żelaza, którego mechanizm nie jest znany.
W ostatniej dekadzie wykazano istnienie co najmniej trzech mechanizmów biorących udział w translokacji żelaza przez błonę śluzową dwunastnicy:
Transporter-mediated(regulated)
Mechanizm pasywny mediowany przez nieestryfikowane kwasy tłuszczowe
(Unregulated) wejście parakomórkowe
Badania in vivo i in vitro wykazały zwiększoną przepuszczalność jelit u przewlekłych alkoholików oferując możliwy mechanizm jelitowego wchłaniania żelaza.
Inne badania sugerują, że może być wzrost wewnętrznej zdolności błony śluzowej jelit pacjentów alkoholowych do pobierania żelaza.
Zaobserwowano, że u tych z podwyższonym żelazem w surowicy, pomiary żelaza zmniejszyły się w ciągu pierwszego tygodnia hospitalizacji z rozwojem retikulocytów. Zaobserwowano również, że zmiany sideroblastyczne były odwracalne, co jest zgodne z poglądami innych autorów. Charakterystyczne pierścienie zniknęły ze szpiku w ciągu pierwszego tygodnia hospitalizacji, choć niektóre utrzymywały się przez dwanaście dni.
Ostatnio(zastąpić przez 6) stwierdzono podwyższony poziom asialotransferyny w surowicy krwi u pacjentów z przewlekłym alkoholizmem; świadczy to o zwiększonej zdolności uwalniania żelaza do tkanek, zwłaszcza hepatocytów, w porównaniu z normalnymi wariantami transferyny.
Zwrócono uwagę, że może istnieć również silny związek między zmianami sideroblastycznymi a niedoborami folianów. Sugeruje się, że niedobór ten może być warunkiem koniecznym do ekspresji zmian sideroblastycznych u alkoholików, choć inni autorzy nie zgadzają się z tym, gdyż mimo znacznej niedokrwistości nie mieli oni zmian megaloblastycznych w szpiku, makrocytozy ani hipersegmentacji neutrofilów we krwi obwodowej, a stężenia folianów w surowicy i erytrocytach były prawidłowe.
Należy zwrócić uwagę, że u pacjentów alkoholowych niedokrwistość chorób przewlekłych spowodowana gruźlicą, chorobami nowotworowymi lub niewydolnością nerek często wiąże się z niedokrwistością sideroblastyczną, która jest bardzo częsta w tej populacji.
Podsumowując, spożywanie alkoholu wraz z nieodpowiednią dietą prawdopodobnie prowadzi do rozwoju anemii sideroblastycznej i hemosiderozy, których patogeneza nie została jeszcze ustalona, a prawdopodobne czynniki obejmują:
Toksyczny wpływ alkoholu na jeden lub więcej etapów syntezy hemu.
Association with poor nutritional status leading to pyridoxal phosphate depletion and accelerated catabolism caused by acetaldehyde, liver disease or both
Pogłębiony niedobór folianów i gdzie główną rolę odgrywa odstawienie i zastąpienie składników odżywczych.
Przypadek kliniczny:
55-letni mężczyzna przyjęty z obrzękiem kończyn dolnych (1/6 nadobojczykowych, 2/6 podobojczykowych) i kości krzyżowej o miękkiej konsystencji, rozdęciem brzucha, bladością skóry błon śluzowych, osłabieniem i postępującą adynamią trwającą trzy miesiące.
Historia:
Przewlekły alkoholizm (2 lub 3 litry wina i/lub piwa dziennie) i palenie tytoniu (40 papierosów dziennie), oba przez ostatnie 30 lat.
Wyniki badań wykonanych na oddziale:
Rentgenogram klatki piersiowej: wypukłość prawej zatoki kostno-przeponowej. Wskaźnik sercowo-piersiowy nieznacznie podwyższony.
Paracenteza: cechy wysięku.
Transfuzje: Z powodu HTO. wskazana transfuzja 2 jednostek zdeplazmowanych krwinek czerwonych.
Diagnoza wstępna:
Etiologiczna: Przewlekły etylizm. Palenie tytoniu.
Patofizjologiczne: Zespół askitowo-obrzękowy. Zespół askitowo-obrzękowy. Plamki obrzękowo-wątrobowe. Niedokrwistość. Wysięk opłucnowy. Niewydolność wątroby.
Anatomopatologiczne: Hepatomegalia. Kardiomegalia.
Wyniki badań wykonanych w trakcie hospitalizacji:
FEDA: Przewlekłe zapalenie błony śluzowej żołądka.
Wykonanie lewatywy z podwójnym kontrastem jelita grubego: Tranzyt jelitowy zachowany.
Echokardiogram: Umiarkowany wysięk w osierdziu.
Echopleuralne: Wysięk w prawej jamie opłucnej.
Echo brzuszne: Wątroba zgodna ze stłuszczeniem wątroby.
Serologia: negatywna dla VDRL, Chagas, WZW B i C.
PAMO i BMO: szpik kostny z ciężką dyspoezą serii czerwonej.
Perls: obserwuje się zwiększoną ilość wewnątrz- i zewnątrzkomórkowych granulek żelaza.
PBH: uzyskany materiał był słabo reprezentatywny dla wnioskowania diagnostycznego.
Laboratorium
Hematokryt (%): wahał się od 11.8 do 19
Krwinki czerwone (x10E12/l): wykazywały zmienność od 1,1 do 1,94
Krwinki białe (x10E9/l): wykazywały zmienność od 7,7 do 9.2
Hemoglobina (g/dL): wahała się od 4,4 do 6.8
Płytki krwi (x10E9/l): wahały się od102 do 346
Ferremia (mg/dl): wahała się od248 do 75
Ferrytyna (ng/dl): 594
TIBC (całkowita zdolność wiązania żelaza) (mg/dl): 360
Oprocent nasycenia transferyny: wykazywał wahania od 95 do 24
Bilirubina całkowita (mg/dl): wykazywał wahania od 1.6 do 0,51
Bilirubina bezpośrednia (mg/dl): wykazywała wahania od 1,92 do 0,18
Bilirubina pośrednia (mg/dl): wykazywała wahania od 2,99 do 0,33
Leczenie medyczne:
Dieta hiposodowa i niskobiałkowa. Ograniczenie wody.
PHP przy 21 kroplach na minutę naprzemiennie. Albumina jedna fiolka równolegle co 8 godzin, a następnie jedna ampułka furosemidu. Spironolakton jedna tabletka co 12 godzin. Fitomenadion (Konakion) jedna ampułka co 12 godzin.
Laktuloza (Lactulon) jedna łyżka stołowa co 6 godzin. Witamina B kompleks jedna tabletka co 12 godzin.
Dzięki dobrej odpowiedzi pacjenta, doustne leczenie lekami moczopędnymi i B kompleks jest kontynuowane. Odstawiono laktulozę i fitomenadion.
Pacjent prezentował korzystną ewolucję kliniczną w zakresie obrzękowego stanu wodobrzusza, z tego powodu został wypisany, otrzymując leki z witaminą B i zalecenie niepicia alkoholu.
Ciągła kontrola lekarska w poradniach Kliniki Medycznej naszego Szpitala oraz w Służbie Hematologicznej Szpitala Álvarez..
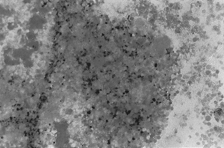
PAMO X 100
– barwienie Perlsa. Wyróżnia się guzek rdzenia z intensywnym odkładaniem żelaza pozakomórkowego.
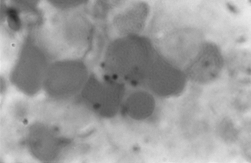
PAMO X 1000
– barwienie Perlsa. Obserwuje się wewnątrzerytroblastyczne odkładanie żelaza.
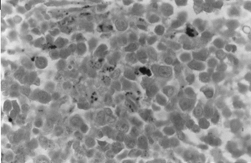
BMOX100
– barwienie Perlsa. Gdzie obserwuje się gęste wewnątrz- i pozaerytroblastyczne skupiska żelaza.
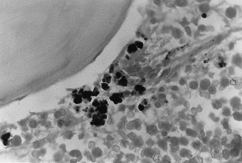
BMO X 1000
– barwienie Perisa. Gdzie obserwuje się gęste wewnątrz- i zewnątrztroblastyczne nagromadzenia żelaza.
Pacjent miał dobrą ewolucję po internowaniu. W sześćdziesiątym dniu miał badanie krwi z następującymi wynikami: HTO 43%, GR 5,1 X 10E12/L, GB 8,7 X10E9/L, HB 13,9 g/di, Plaq.354 X10E9/L, przy czym tylko przestrzegał leczenia.
Po 120 dniach był ponownie monitorowany z tymi samymi wynikami badania krwi.
Po 120 dniach był ponownie monitorowany z tymi samymi wynikami badania krwi.
Po sześćdziesięciu dniach był ponownie monitorowany z tymi samymi wynikami badania krwi.