An addukt (od łacińskiego adductus, „ciągnięty w kierunku” alternatywnie, skurcz „produkt dodawania”) jest produktem bezpośredniego dodawania dwóch lub więcej odrębnych cząsteczek, w wyniku czego powstaje jeden produkt reakcji zawierający wszystkie atomy wszystkich składników. Produkt końcowy jest uważany za odrębny gatunek molekularny. Przykłady obejmują dodanie wodorosiarczynu sodu do aldehydu w celu otrzymania sulfonianu. Można go po prostu uznać za pojedynczy produkt powstały w wyniku bezpośredniego połączenia różnych cząsteczek, który zawiera wszystkie atomy cząsteczek reagentów.
Addukty często tworzą się między kwasami Lewisa i zasadami Lewisa. Dobrym przykładem jest tworzenie się adduktów pomiędzy kwasem Lewisa boranem a atomem tlenu w zasadzie Lewisa, tetrahydrofuranie (THF): BH3-O(CH2)4 lub eterze dietylowym: BH3-O(CH3CH2)2. Wiele kwasów Lewisa i zasad Lewisa reagujących w fazie gazowej lub w rozpuszczalnikach niewodnych tworząc addukty zostało przebadanych w modelu ECW. Trimetyloboron, chlorek trimetylotinu i bis(heksafluoroacetyloacetonato)miedź(II) są przykładami kwasów Lewisa, które tworzą addukty wykazujące efekty steryczne. Na przykład: chlorek trimetylocyny, podczas reakcji z eterem dietylowym, wykazuje odpychanie steryczne pomiędzy grupami metylowymi na Sn i grupami etylowymi na tlenie. Jednak gdy zasadą Lewisa jest tetrahydrofuran, odpychanie steryczne ulega zmniejszeniu. Model ECW może dostarczyć miary tych efektów sterycznych.
-
.
CząsteczkaTHF
-
Cząsteczka BH3
.
-
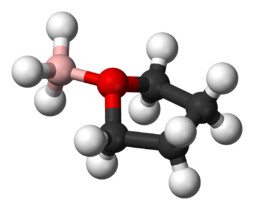
Addukt Lewisa pomiędzy BH3 i THF
Związki lub mieszaniny, które nie mogą utworzyć adduktu z powodu przeszkody sterycznej nazywamy sfrustrowanymi parami Lewisa.
Addukty nie muszą mieć charakteru molekularnego. Dobrym przykładem z chemii ciała stałego jest addukty etylenu lub tlenku węgla z CuAlCl4. Ten ostatni jest ciałem stałym o rozbudowanej strukturze sieciowej. Po utworzeniu adduktu powstaje nowa faza, w której cząsteczki gazu zostają włączone do struktury jako ligandy atomów miedzi. Reakcja ta może być również uważana za reakcję pomiędzy zasadą a kwasem Lewisa, w której atom miedzi pełni rolę odbierającą elektrony, a elektrony pi cząsteczki gazu pełnią rolę elektronodonującą.
.


