Najbardziej ogólna zasada rządząca siłą kwasu może być określona w ten sposób: silne kwasy mają stosunkowo stabilne zasady sprzężone. Ogólnie rzecz biorąc, im bardziej stabilna baza sprzężona, tym mocniejszy kwas. Ważną rzeczą do zapamiętania jest to, że stabilność i reaktywność są odwrotne. Im bardziej stabilna jest substancja, tym mniej jest reaktywna i odwrotnie. Dlatego też, innym sposobem wyrażenia powyższej zasady jest stwierdzenie, że mocne kwasy mają słabe zasady sprzężone. HCl i H3O+ są mocnymi kwasami. Odpowiednio, odpowiadające im zasady sprzężone, Cl- i H2O, są słabe (bardzo stabilne). Jon chlorkowy jest stabilny, ponieważ ujemny ładunek znajduje się na bardzo elektroujemnym atomie. Cząsteczka wody jest jedną z najbardziej stabilnych znanych substancji.
Skąd wiemy, który proton jest najbardziej kwasowy w cząsteczce (takiej jak kwas octowy), która zawiera więcej niż jeden typ protonu? Pamiętajmy, że im wyższy stopień dodatniego znaku na protonie, tym bardziej jest on kwaśny. Analiza tabeli pKa ujawnia pewne tendencje dla kwaśnych protonów. Do przewidywania kwasowości można wykorzystać następujące wskazówki.
1. Hydrogeny przyłączone bezpośrednio do atomów o bardzo dużej elektroujemności, takich jak tlen, siarka i fluorowce, mają znaczny stopień kwasowości.
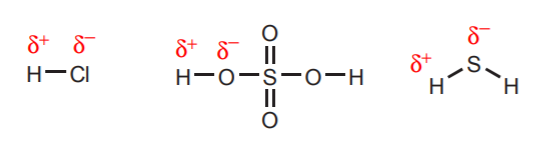
2. Hydrogeny przyłączone do dodatnio naładowanego azotu, tlenu lub siarki są kwaśne. Wysoka elektronegatywność tych atomów powoduje, że nie czują się one komfortowo z ładunkiem dodatnim. Dążą one do rozproszenia tego ładunku pomiędzy sąsiednie atomy, odbierając im gęstość elektronową. Można to wykazać rysując struktury rezonansowe jak na rysunku.
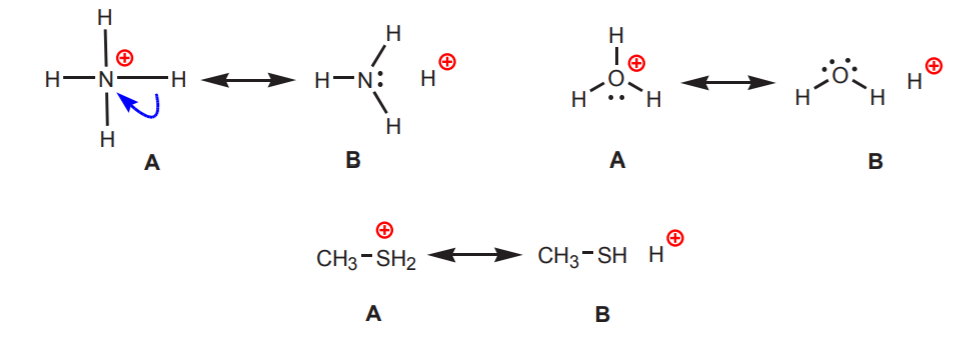
We wszystkich przypadkach struktura B ujawnia dodatni charakter wodoru, a więc jego kwasowy charakter.
3. Jak świadczą wartości pKa alkanów i alkenów, hydrogeny przyłączone do węgla mają bardzo niską kwasowość. Substancje takie nie są zwykle w ogóle uważane za kwasy. Jednak niektóre węglowodory mogą być słabo kwaśne, jeśli ich sprzężone zasady są stabilnymi jonami. Może się to zdarzyć w następujących przypadkach.
a) W pobliżu rozważanego protonu znajduje się jeden lub więcej elektronegatywnych atomów. Indukcyjne działanie tych elektronegatywnych atomów pozostawia hydrogeny w pobliżu pozbawione gęstości elektronowej, a więc z częściowym dodatnim charakterem.
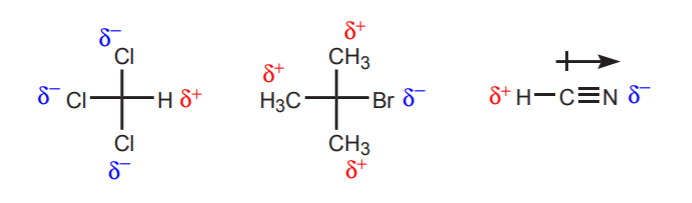
b) Atom wodoru związany z węglem, który z kolei jest związany z innym węglem, który niesie częściowy lub pełny ładunek dodatni, jest kwaśny.
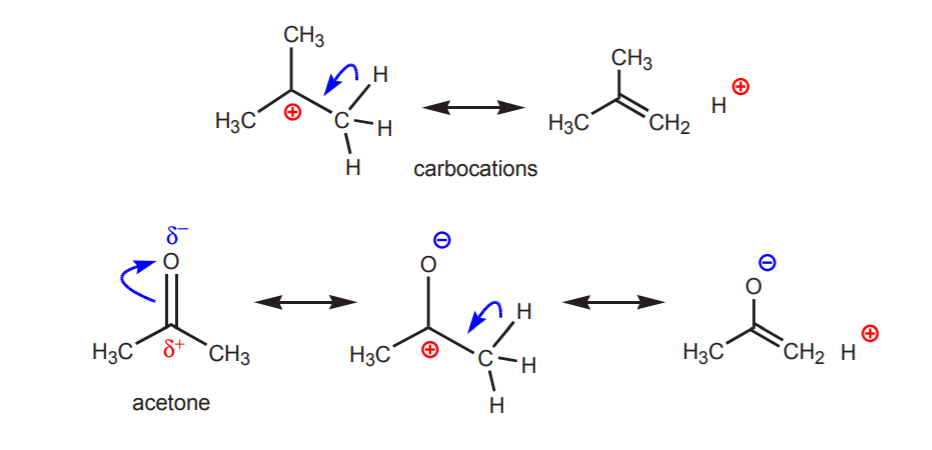
Kwasowość przedstawionych protonów uwidacznia się w reakcjach eliminacji (rozdział 6) oraz w chemii enoli (rozdział 22), kiedy obecność zasady prowadzi do powstania alkenów lub jonów enolanowych poprzez etap obejmujący przeniesienie protonu.
c) Sprzężona zasada jest stabilizowana rezonansowo. Efekt ten jest najważniejszy, gdy istnieje inny czynnik wzmacniający kwasowość, taki jak obecność dipola lub elektronegatywnego atomu (jak w nitrylowej grupie funkcyjnej, -CN). W przeciwnym razie, sama stabilizacja rezonansowa nie wystarcza do radykalnego zwiększenia kwasowości wodoru przyłączonego do węgla (jak w toluenie, gdzie pKa wynosi tylko 40).
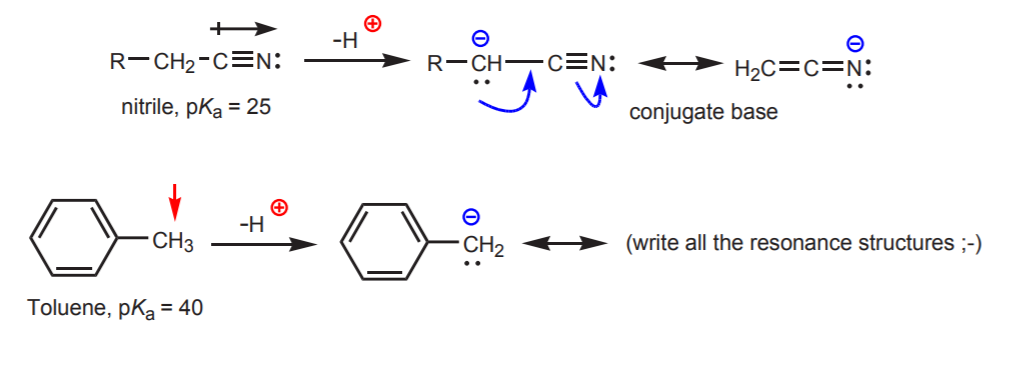
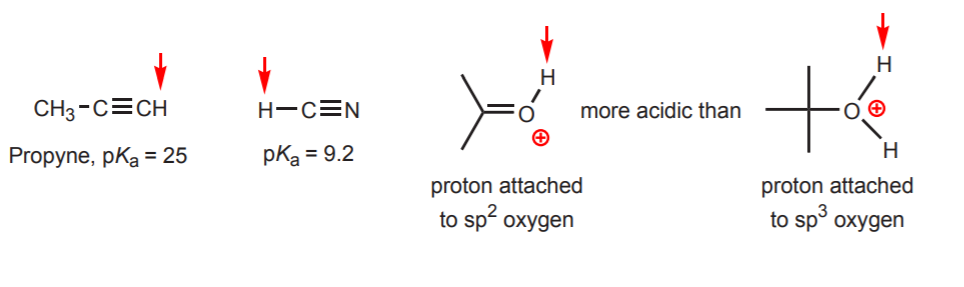
d) Wodór jest przyłączony do sp-hybrydyzowanego węgla. Wpływ hybrydyzacji na kwasowość jest omówiony w rozdziale 9. Trendy w hybrydyzacji można rozszerzyć na tlen i azot oprócz węgla, jak w przykładzie po prawej stronie.
.