Structure, dynamique et fonction des aquaporines
 Gagnant 2004 du défi de visualisation en science et ingénierie,
Gagnant 2004 du défi de visualisation en science et ingénierie, Organisé par la National Science Foundation et Science Magazine. (Voir l’article connexe de Science.)
Notre film sur la perméation de l’eau et le prix Nobel de chimie 2003
L’art du transport de l’eau dans les aquaporines
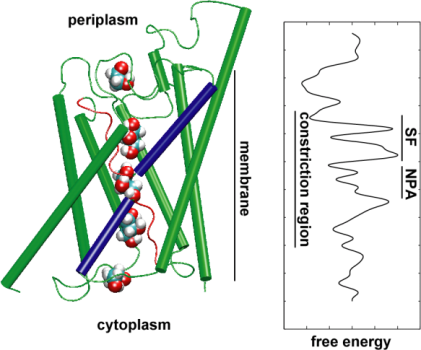
Les aquaporines sont des canaux membranaires à eau qui jouent des rôles critiques dans le contrôle du contenu en eau des cellules. Ces canaux sont largement distribués dans tous les règnes de la vie, y compris les bactéries, les plantes et les mammifères. Plus de dix aquaporines différentes ont été trouvées dans le corps humain, et plusieurs maladies, telles que les cataractes congénitales et le diabète insipide néphrogénique, sont liées à l’altération de la fonction de ces canaux. Ils forment des tétramères dans la membrane cellulaire et facilitent le transport de l’eau et, dans certains cas, d’autres petits solutés à travers la membrane. Cependant, les pores de l’eau sont complètement imperméables aux espèces chargées, comme les protons, une propriété remarquable qui est essentielle pour la conservation du potentiel électrochimique de la membrane, mais paradoxale en même temps, puisque les protons peuvent généralement être transférés facilement par les molécules d’eau. Les résultats de nos simulations ont permis de mieux comprendre le mécanisme qui sous-tend cette propriété fascinante. Les molécules d’eau qui passent par le canal sont forcées, par les forces électrostatiques de la protéine, de se retourner au centre du canal (voir l’animation),brisant ainsi l’arrangement alternatif donneur-accepteur qui est nécessaire à la translocation des protons (lire l’histoire complète dans notreSciencepaper).

Implication fonctionnelle d’une architecture protéique particulière
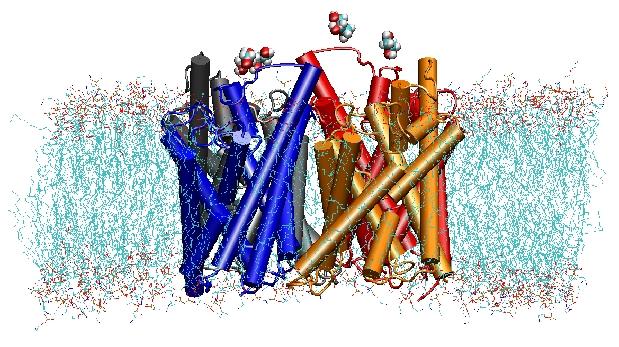
En l’an 2000, le laboratoire de Stroud à l’UCSF a réussi à résoudre la première structure à haute résolution d’une aquaporine par radiocristallographie. La structure étudiée était celle du facilitateur d’absorption du glycérol (GlpF) d’E. col, qui est une aquaporine, c’est-à-dire que le canal est également perméable aux petites molécules de sucre linéaires comme le glycérol. Des simulations MD nanosecondes de GlpF tétramérique dans un patch hydraté de bicouche lipidique POPE ont permis de caractériser la voie complète de conduction du substrat dans le canal. L’analyse des interactions entre les liaisons hydrogène du substrat et l’intérieur du canal a également expliqué pour la première fois pourquoi ces canaux incorporent dans leur architecture deux boucles caractéristiques, comprenant des éléments de structure secondaire énergétiquement défavorables, qui sont conservés dans toute la famille des aquaporines (Jensen et al, Structure, 2001).
Énergétique de la perméation des sucres
Ensuite, nous avons exploré l’énergétique du transporteur pour comprendre quelles barrières un substrat doit surmonter lors de son passage dans le canal. Afin de décrire le profil d’énergie libre, nous avons calculé le potentiel de force moyenne pour l’événement de conduction complet à partir des trajectoires dans lesquelles le mouvement du glycérol à travers le canal a été accéléré par l’application de forces externes. Cette technique, connue sous le nom de steeredmolecular dynamics (SMD), permet d’observer des événements lents dans l’échelle de temps accessible des simulations MD. Cependant, en raison de la nature non équilibrée des trajectoires, l’analyse des résultats est confrontée au problème du travail irréversible qui doit être pris en compte. En utilisant l’identité de Jarzinsky, l’égalité entre l’énergie libre et le travail dans les systèmes non-équilibrés, nous avons pu décrire complètement l’énergétique du transport du glycérol à travers le canal. Le potentiel calculé de la force moyenne capture les principaux sites de liaison et les barrières dans le canal en accord étroit avec les résultats des simulations MD à l’équilibre et la structure cristalline. De plus, il présente une asymétrie prononcée dans sa forme, suggérant que la structure asymétrique de la protéine peut être fonctionnellement importante pour une absorption efficace des molécules nutritives de l’environnement. (Jensen, etal., PNAS, 2002).
What Makes an Aquaporin a Glycerol Channel
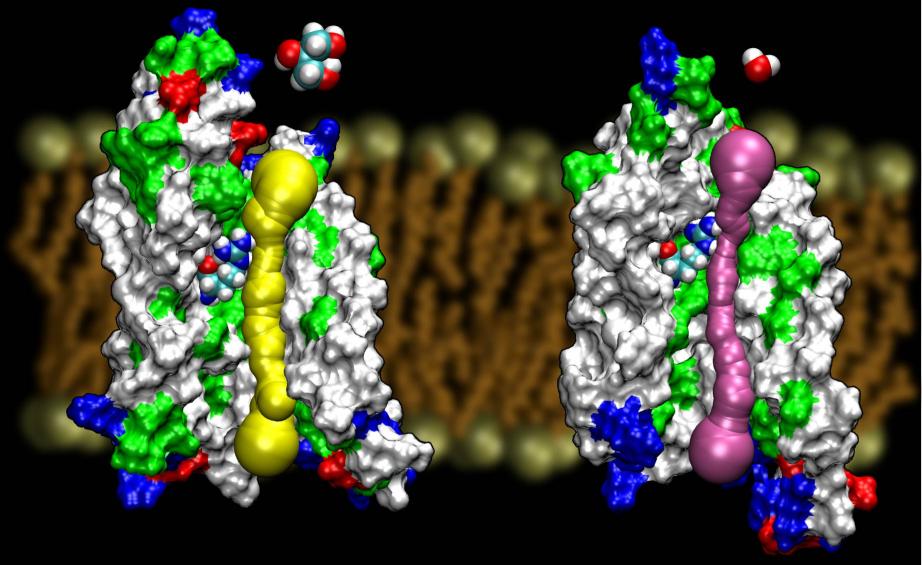
Les aquaporines sont une famille très chanceuse de protéines membranaires,qui sont notoirement résistantes à la détermination de leur structure. Nous disposons de structures à haute résolution de plusieurs AQP : GlpF, AQP1, AQP0, etAqpZ. D’autres structures devraient bientôt apparaître. La disponibilité de la structure de deux AQP d’E. coli, l’un étant un canal d’eau pure (AqpZ) et l’autre un canal de glycérol (GlpF), nous a fourni une occasion unique de comprendre les principes de sélectivité employés par la nature dans l’utilisation de deux canaux génétiquement et structurellement très homologues pour le trafic membranaire de matériaux différents. En fait, le pore est dans l’ensemble plus étroit que celui de GlpF (voir la figure ci-dessous). Il semble que la nature se soit tournée vers un mécanisme très basique, à savoir le réglage de la taille du pore du canal, afin que deux protéines de la même famille présentent des propriétés de conduction différentes. Lisez l’histoire complète dans Wang, etal, STRUCTURE, 2005.
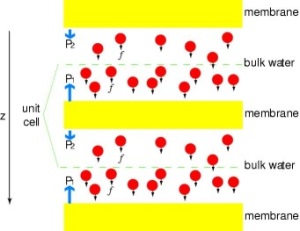
Mettre les canaux sous pression
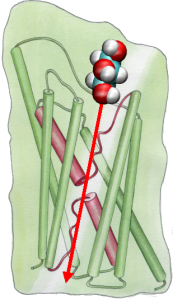
Afin de comparer directement les résultats des simulations MD avec les mesures biochimiques de la conductivité des canaux d’eau membranaires, dans lesquelles des gradients de pression osmotique sont utilisés pour induire le flux d’eau à travers la membrane, nous avons développé une nouvelle méthodologie pour les simulations MD. En appliquant de petites forces sur les molécules d’eau dans la région centrale (voir figure), un gradient de pression hydrostatique est généré à travers la membrane. Le gradient de pression induit des taux de conduction qui peuvent être étudiés avec des simulations MD, qui sont généralement limitées à quelques nanosecondes. La méthode a été appliquée dans la simulation de la perméation de l’eau à travers le GlpF, et a abouti à une corrélation linéaire entre la pression appliquée et le flux (Zhu et al.,Biophys. J., 2002).
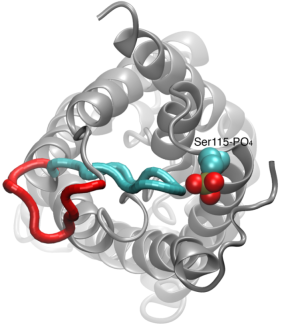
Gating of Water Channels
La perméation de l’eau à travers les aquaporines est un processus passif qui suit la direction de la pression osmotique à travers la membrane. Bien que de nombreuses aquaporines fonctionnent comme des canaux toujours ouverts, un sous-groupe d’aquaporines, en particulier chez les plantes ont évolué un mécanisme moléculaire sophistiqué par lequel le canal peut être fermé en réponse à des conditions difficiles de l’environnement, dans lequel l’échange d’eau peut être nuisible pour l’organisme. Des exemples de telles conditions sont le stress de la sécheresse et les inondations, qui déclenchent certains signaux cellulaires (déphosphorylation et changement de pH) qui entraînent la fermeture du canal. La structure récemment résolue d’une aquaporine d’épinard a été simulée dans différentes conditions afin d’étudier le mécanisme moléculaire de fermeture de ces canaux membranaires. On a découvert qu’une boucle cytoplasmique allongée dans les aquaporines compétentes en matière de déclenchement occlut physiquement l’entrée du pore d’eau dans le canal fermé et bloque l’accès des molécules d’eau au pore. Le déplacement de cette boucle en réponse à la phosphorylation, tel qu’observé dans les simulations, élimine la boucle de l’entrée cytoplasmique du pore. De plus, un acide aminé hydrophobe qui est conformationnellement étroitement couplé à cette boucle sera retiré du canal suite au déplacement de la boucle. Ensemble, ces événements moléculaires aboutissent à un canal ouvert qui est perméable aux molécules d’eau. L’étude est parue dans Nature2006.

Gating and Ion Conductivity of the Tetrameric Pore
Les AQP sont généralement connus pour leur haute perméabilité à l’eau. Cependant, leur implication dans d’autres fonctions cellulaires, y compris la perméation de petites molécules autres que l’eau, ainsi que la communication cellule-cellule a été suggérée. La tétramérisation est une caractéristique structurelle commune des AQP. Le fait que les quatre monomères forment chacun un pore d’eau fonctionnellement indépendant, mais nécessitent une organisation tétramérique pour fonctionner, suggère un avantage synergique de l’oligomérisation, et, par conséquent, oblige à poursuivre l’analyse du rôle potentiel du pore central dans les PQA. Une proposition intéressante est l’implication possible du pore central dans la conduction ionique lors de l’activation du GMPc. En utilisant des simulations MD de modèles d’AQP1 incorporés dans la membrane, nous avons étudié cette propriété de l’AQP1, afin de déterminer comment, et dans quelles conditions de conformation et d’hydratation, le pore central peut conduire et comment la conductivité est régulée. L’une des boucles cytoplasmiques, à savoir la boucle D riche en arginine, a été suggérée par nos simulations comme jouant un rôle clé dans l’activation du pore central médiée par le GMPc. Le rôle suggéré de la boucle D a été vérifiéde manière expérimentale par un mutant conçu de la boucle D montrant une perte complète de la conductivité ionique ( Yu et al.,Structure, 2006 ) .
Les molécules de gaz se déplacent dans la cellule
Chaque matin, de nombreuses personnes se rendent au travail en voiture, tandis que d’autres peuvent faire du vélo, prendre le bus ou le métro.De même, diverses biomolécules du corps humain atteignent également leur destination de diverses manières. Par exemple, pour traverser la membrane cellulaire, les petites molécules de gaz hydrophobes diffusent à travers la couche lipidique, tandis que les molécules d’eau passent par les aquaporines (AQP).Il est intéressant de noter que, tout comme on peut se rendre au travail en bus ou en voiture, il a été découvert récemment que certaines molécules de gaz peuvent avoir plus d’une façon de traverser la membrane, En utilisant la dynamique moléculaire réalisée avec NAMD, nous avons étudié la perméabilité au gaz de l’AQP1 avec deux méthodes complémentaires (simulation de diffusion de gaz explicite et échantillonnage de ligands implicite). Les résultats de la simulation suggèrent que si les pores quadrimonomériques de l’AQP1 fonctionnent comme des canaux à eau, le pore central de l’AQP1 peut servir de voie d’accès aux molécules de gaz pour traverser la membrane (Wang et al., Journal of Structural Biology, 2007 ).
Course d’obstacles moléculaires
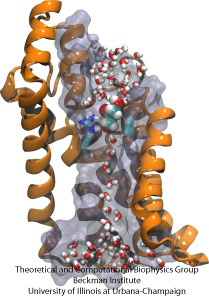
Les cellules biologiques protègent leur intérieur grâce à leurs membranes cellulaires, mais dépendent de l’importation de nutriments. Elles ont évolué pour cette importation des canaux de conduction rapides qui comprennent des points de contrôle fiables distinguant les composés désirables et indésirables. Un point de contrôle constitue une véritable course d’obstacles que seuls les bons composés peuvent franchir rapidement. La compréhension de la conception du canal est difficile en raison du manque de données expérimentales détaillées sur la dynamique des nutriments. Actuellement, les informations les plus détaillées proviennent de la visualisation de la dynamique des canaux par calcul, à partir de structures cristallographiques statiques. Une étude récente a examiné comment les glycérols, de petites molécules nutritives nécessaires à certaines bactéries, passent par des points de contrôle réalisés par le canal GlpF des glycérols. GlpF fournit quatre canaux parallèles qui ont été contrôlés par calcul à l’aide de NAMD et d’un nouvel algorithme qui explore l’énergétique des canaux assez rapidement pour être méthodologiquement réalisable sur les ordinateurs actuels. Les résultats montrent comment les caractéristiques physiques des glycérols, leur capacité à former des liaisons hydrogène, leurs moments dipolaires électriques, leur mobilité diffusive et leur flexibilité intrinsèque sont sondés le long du canal (Henin et al, Biophysical Journal, sous presse ).
Nos recherches sur les aquaporines dans l’actualité
|
Équipe Aquaporin
|
Publications
-.//W3C//DTD XHTML 1.0 Transitional//EN » « http://www.w3.org/TR/xhtml1/DTD/xhtml1-transitional.dtd »>Publications Base de données Diffusion du glycérol à travers l’aquaglycéroporine GlpF d’Escherichia coli.Jerome Henin, Emad Tajkhorshid, Klaus Schulten, et Christophe Chipot. Biophysical Journal, 94:832-839, 2008. Exploration de la perméabilité aux gaz des membranes cellulaires et des canaux membranaires par la dynamique moléculaire.Yi Wang, Jordi Cohen, Walter F. Boron, Klaus Schulten, et Emad Tajkhorshid. Journal of Structural Biology, 157:534-544, 2007. Mechanism of gating and ion conductivity of a possible tetrameric pore in Aquaporin-1.Jin Yu, Andrea J. Yool, Klaus Schulten, and Emad Tajkhorshid. Structure, 14:1411-1423, 2006. Structural mechanism of plant aquaporin gating.S. Törnroth-Horsefield, Y. Wang, K. Hedfalk, U. Johanson, M. Karlsson, E. Tajkhorshid, R. Neutze, and P. Kjellbom. Nature, 439:688-694, 2006. Ce qui fait d’une aquaporine un canal à glycérol : A comparative study of AqpZ and GlpF.Yi Wang, Klaus Schulten, and Emad Tajkhorshid. Structure, 13:1107-1118, 2005. Théorie cinétique et simulation du transport de l’eau par un seul canal. Emad Tajkhorshid, Fangqiang Zhu et Klaus Schulten. Dans S. Yip, éditeur, Handbook of Materials Modeling, Vol. I : Methods and Models, pp. 1797-1822. Springer, Pays-Bas, 2005. Towards understanding membrane channels.Emad Tajkhorshid, Jordi Cohen, Aleksij Aksimentiev, Marcos Sotomayor, and Klaus Schulten. Dans Boris Martinac et Andrzej Kubalski, éditeurs, Bacterial ion channels and their eukaryotic homologues, pp. 153-190. ASM Press, Washington, DC, 2005. Collective diffusion model for water permeation through microscopic channels.Fangqiang Zhu, Emad Tajkhorshid, and Klaus Schulten. Physical Review Letters, 93:224501, 2004. (4 pages). Études computationnelles des canaux membranaires.Benoit Roux et Klaus Schulten. Structure, 12:1343-1351, 2004.