Plus de 200 000 personnes ont subi un remplacement de valve aortique par cathéter (TAVR), et chaque année, environ 140 000 patients reçoivent une valve bioprothétique chirurgicale.1,2 Malgré ce volume croissant, la stratégie optimale d’anticoagulation postopératoire est souvent peu claire. Plus précisément, deux questions soulignent la difficulté de prendre des décisions pour ces scénarios cliniques courants :
- Dans les premiers mois après le remplacement d’une valve bioprothétique, quelles complications essayons-nous de réduire avec l’anticoagulation ?
- Doit-on fournir une anticoagulation à tous les patients pour réduire ces complications ? Ou devrions-nous avoir une approche plus sélective en fonction des facteurs de risque ?
Risques thrombotiques après un remplacement valvulaire bioprothétique
Traditionnellement, la justification de l’anticoagulation dans les premiers mois après un remplacement valvulaire chirurgical a été d’atténuer les complications thrombotiques, vraisemblablement liées au matériel de suture et à un anneau de couture qui n’est pas encore recouvert de biofilm et endothélialisé3,4. Les complications thrombotiques ultérieures possibles sont de trois ordres : événements thromboemboliques, thrombose manifeste de la valve et thrombus organisé subclinique pouvant altérer la fonction de la valve à long terme. Malgré la fréquence du remplacement des valves bioprothétiques, les données relatives à ces complications sont limitées, en partie parce que ces événements sont apparemment peu fréquents.
Une méta-analyse récente a mis en évidence le faible taux d’événements après remplacement des valves bioprothétiques. Dans cette analyse portant sur 31 740 patients, principalement avec un remplacement chirurgical de la valve aortique, des événements thromboemboliques précoces sont survenus chez 145 patients (1%) prenant des antagonistes de la vitamine K et 262 patients (1,5%) ne prenant pas d’antagonistes de la vitamine K (odds ratio 0,96 ; intervalle de confiance à 95%, 0,60-1,52).Si nous supposons qu’il y a effectivement une augmentation de 0,5 % des complications thromboemboliques dans les premiers mois suivant le remplacement chirurgical de la valve aortique chez les patients ne prenant pas d’antagonistes de la vitamine K, un essai contrôlé randomisé de puissance appropriée nécessiterait environ 15 500 patients6. A ce jour, 2 essais randomisés ont été réalisés, totalisant 268 patients.7,8 Compte tenu du faible nombre de patients, l’absence de différence statistiquement détectable dans les 2 groupes n’est pas surprenante.
En l’absence de grands essais contrôlés randomisés, les cliniciens doivent se tourner vers des études d’observation pour obtenir des informations, comme l’analyse du registre national danois des patients.9 Dans cette étude portant sur 4 075 patients ayant subi un remplacement de valve aortique bioprothétique, l’arrêt de la warfarine a été associé à une augmentation des événements thromboemboliques et des décès cardiovasculaires 1 à 6 mois après la chirurgie. Il est intéressant de noter que, bien que le taux d’accidents vasculaires cérébraux ait augmenté au cours des 3 premiers mois dans le groupe traité, le nombre d’accidents vasculaires cérébraux entre 3 et 6 mois n’était pas différent entre les patients ayant poursuivi ou interrompu la warfarine, bien qu’il n’y ait eu que 21 événements au cours de cette période. En outre, il n’y avait pas de différence dans les événements hémorragiques entre 3 mois et 1 an. Cette observation va à l’encontre des rapports précédents et de l’expérience clinique selon lesquels les patients sous warfarine sont plus susceptibles d’être hospitalisés pour des hémorragies.5 Par conséquent, les conclusions des auteurs concernant la mortalité cardiovasculaire et les événements thromboemboliques peuvent être liées à une confusion résiduelle. Plus précisément, il se peut qu’il n’y ait pas eu de différence dans les événements hémorragiques parce que les cliniciens étaient moins susceptibles de commencer ou de poursuivre l’anticoagulation chez les patients les plus à risque.
Malheureusement, par rapport aux événements thromboemboliques, les données publiées fournissent encore moins d’indications sur les associations inférentielles pour la thrombose de la valve bioprothétique. Peu d’événements ont été rapportés, et la plupart des publications se limitent à des séries de cas et à des expériences monocentriques.10 Par conséquent, l’incidence de la thrombose de la valve bioprothétique n’est pas bien définie, bien que dans une étude, seuls 8 des 4 568 patients porteurs d’une valve aortique bioprothétique aient dû être réopérés pour une sténose aortique liée à un thrombus.11 De même, le rôle de la thrombose cliniquement silencieuse et de la possible dégénérescence accélérée de la valve bioprothétique est largement inconnu.
Anticoagulation sélective après le remplacement de la valve bioprothétique
Sur la base d’une ampleur peu claire du bénéfice et d’un risque de saignement bien accepté, l’anticoagulation universelle après le remplacement de la valve aortique bioprothétique est difficile à justifier ; cette incertitude est reflétée par la recommandation de classe IIb dans les lignes directrices 2014 de l’American College of Cardiology et de l’American Heart Association (ACC/AHA) sur les maladies cardiaques valvulaires12. Cependant, des situations cliniques spécifiques peuvent se présenter où l’anticoagulation doit être plus fortement envisagée. Par exemple, dans une récente étude cas-témoins incluant 46 patients réopérés pour une thrombose de la valve aortique bioprothétique, une augmentation >50 % des gradients Doppler moyens à l’échocardiographie par rapport aux valeurs de départ, une augmentation de l’épaisseur des cuspides et une mobilité anormale des cuspides étaient toutes associées à une thrombose de la valve.13 Par conséquent, un essai d’anticoagulation et une échocardiographie de suivi pour évaluer les gradients Doppler pourraient être envisagés chez ces patients,14 bien que la mesure dans laquelle la fonction de la valve à court et à long terme est modifiée par l’anticoagulation ne soit pas claire.
En outre, les patients porteurs d’une valve mitrale bioprothétique semblent présenter un risque plus élevé d’événements thromboemboliques et de thrombose valvulaire (voir le cas illustratif, avec les figures 1-2 et les vidéos 1-2, ci-dessous). Le remplacement de la valve mitrale par une bioprothèse étant beaucoup moins fréquent que le remplacement de la valve aortique, les données sont encore plus limitées. Cependant, dans une étude monocentrique portant sur 216 patients ayant subi un remplacement valvulaire mitral bioprothétique, 10 (5 %) ont eu un accident vasculaire cérébral ischémique dans les 6 mois.15 De plus, dans une autre étude portant sur 149 patients consécutifs, 9 (6 %) ont développé une thrombose de la valve mitrale bioprothétique.16 Par conséquent, les patients ayant subi un remplacement de la valve mitrale bioprothétique semblent présenter un risque plus élevé, et une anticoagulation de routine doit être envisagée pendant 3 à 6 mois, ce que reflète à nouveau la recommandation de classe IIa des directives de 2014 de l’ACC/AHA sur les cardiopathies valvulaires.12
Cas illustratif : thrombose de la valve mitrale bioprothétique
Une femme de 71 ans a présenté une insuffisance cardiaque 8 mois après un remplacement de la valve mitrale bioprothétique pour une sténose mitrale rhumatismale. En postopératoire, elle avait été traitée par coumadine pendant 3 mois et continuait à prendre de l’aspirine. Elle n’avait pas d’antécédents de fibrillation auriculaire et avait été afébrile, et les hémocultures étaient négatives.
Vidéo 1
Figure 1
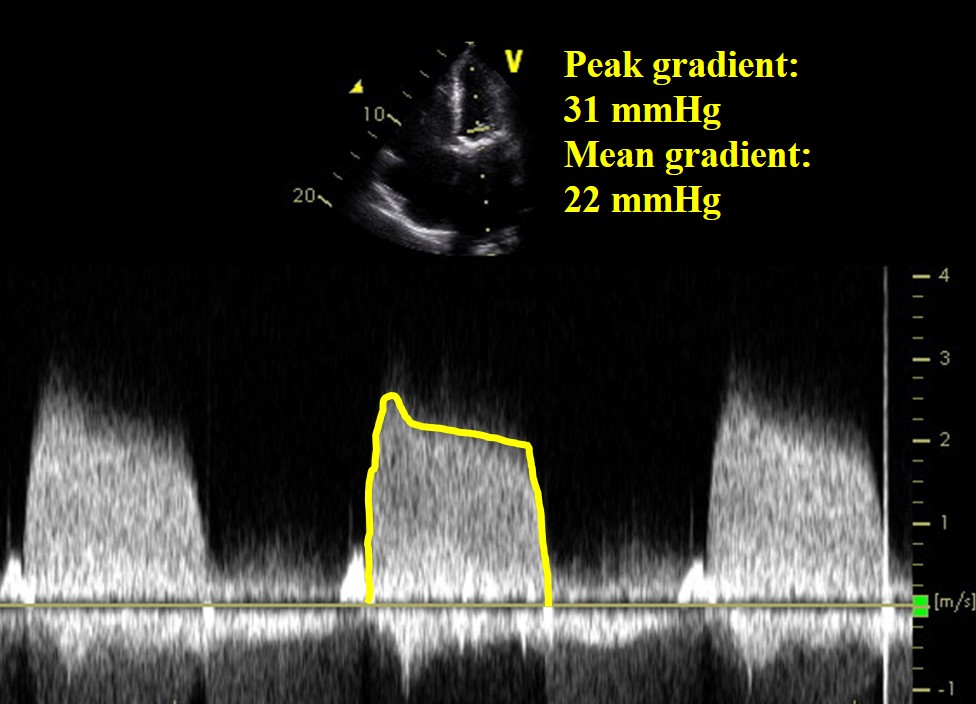
Vidéo 2
Figure 2
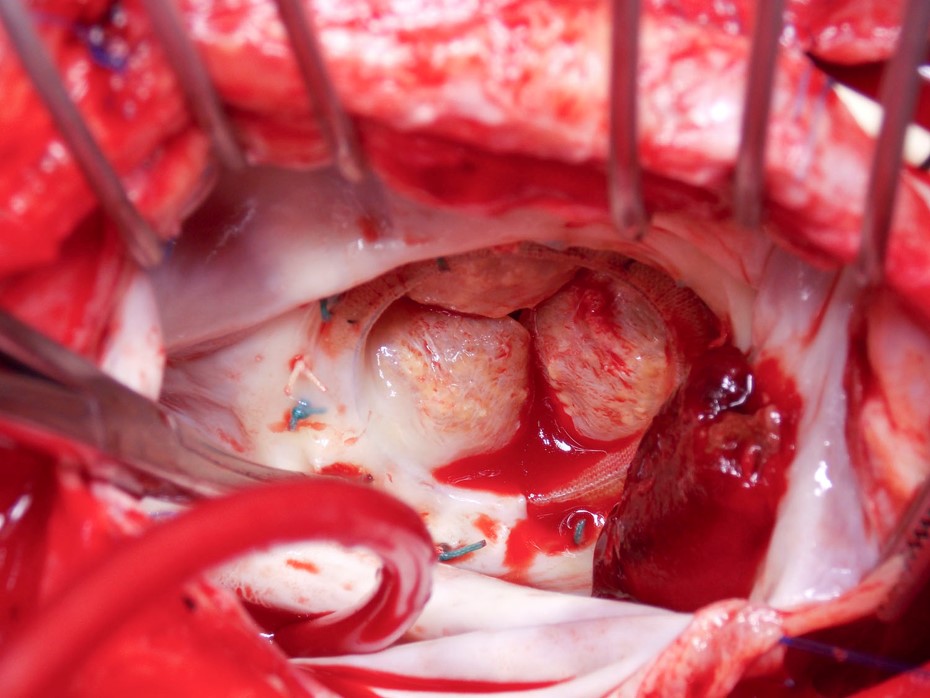
Enfin, et peut-être la question la plus controversée, est de savoir si notre approche de l’anticoagulation doit différer pour les patients ayant subi une TAVR. Le défaut initial a été de traiter ces patients avec de l’aspirine et du clopidogrel parce que c’était l’approche entreprise dans les essais randomisés. Plus récemment, l’angiographie par tomodensitométrie (CTA) quadridimensionnelle avec électrocardiographie a permis de décrire une mobilité réduite des feuillets de la valve aortique bioprothétique et un épaississement hypoatténué des feuillets, ce qui implique une thrombose de la valve.17,18 Souvent, ces patients sont asymptomatiques et présentent des gradients Doppler normaux à l’échocardiographie, ce qui suggère que ces résultats peuvent être subcliniques. Il est important de noter que ces anomalies de l’angiographie coronarienne peuvent disparaître avec la warfarine, et l’absence d’anticoagulation initiale apparaît comme un facteur de risque possible.19 Cependant, à l’heure actuelle, ces résultats d’imagerie n’ont pas de signification clinique claire.20 Heureusement, un essai randomisé, GALILEO (Global Study Comparing a Rivaroxaban-Based Antithrombotic Strategy to an Antiplatelet-Based Strategy After Transcatheter Aortic Valve Replacement to Optimize Clinical Outcomes) comparant le rivaroxaban à un traitement antiplaquettaire après TAVR est en cours et devrait fournir des informations précieuses.21 Pourtant, malgré un recrutement estimé à 1520 patients, l’essai pourrait ne pas être suffisamment puissant pour les événements cliniques.
Conclusions
Dans l’ensemble, chez les patients porteurs de valves bioprothétiques, les événements thromboemboliques non procéduraux précoces sont peu fréquents. De plus, l’incidence de la thrombose valvulaire manifeste est probablement faible, et l’effet de la thrombose valvulaire subaiguë sur la durabilité de la valve est encore en cours de définition. Compte tenu de ces observations et du risque hémorragique accru avec la warfarine, nous préconisons une approche sélective de l’anticoagulation postopératoire (figure 3). Pour les patients porteurs de valves aortiques bioprothétiques, une anticoagulation pendant 3 à 6 mois est indiquée chez les patients présentant des facteurs de risque établis, comme la fibrillation auriculaire. Sur la base des récentes données émergentes, une anticoagulation et un suivi étroit doivent être envisagés chez les patients présentant des résultats anormaux à l’échocardiographie ou à l’angiographie par scanner, tels qu’une augmentation inexpliquée des gradients valvulaires au Doppler ou un épaississement hypoatténué des feuillets. Enfin, même si les données disponibles sont moins nombreuses, les patients porteurs de valves mitrales bioprothétiques semblent présenter un risque plus élevé de complications thrombotiques, et une anticoagulation systématique pendant 3 à 6 mois est recommandée.
Figure 3 : Approche proposée pour l’anticoagulation après le remplacement de la valve bioprothétique
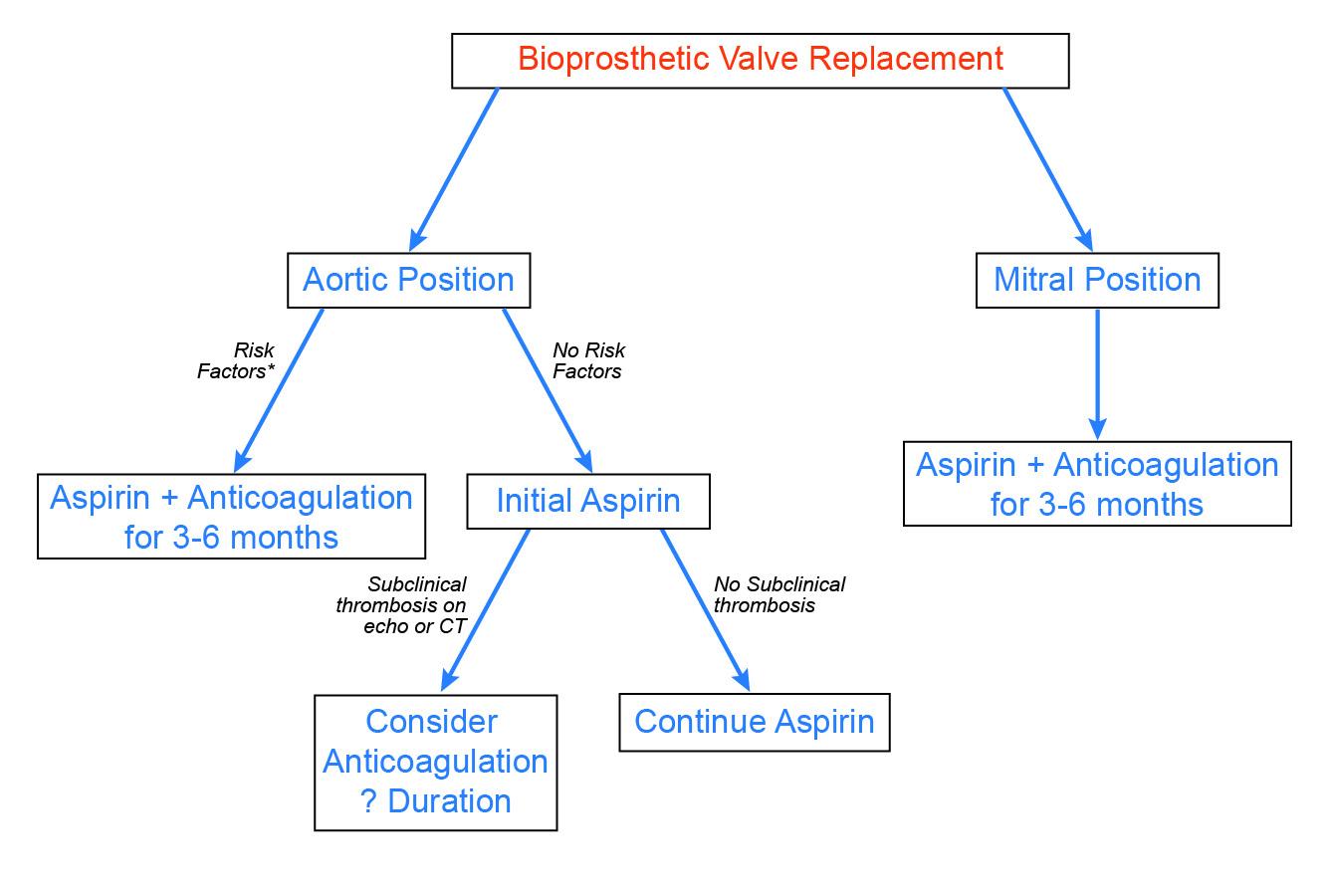
Cet article contient du matériel éducatif destiné aux professionnels de santé agréés et est destiné à être utilisé uniquement à des fins éducatives et informatives. Bien que le contenu puisse porter sur des questions médicales et de soins de santé spécifiques, il ne remplace pas les conseils médicaux personnalisés et n’est pas destiné à être utilisé comme seule base pour prendre des décisions médicales ou liées à la santé individualisées. Les points de vue et les opinions exprimés sont ceux des auteurs et des rédacteurs et ne représentent pas nécessairement ceux de l’ACC. Le matériel n’est pas destiné à présenter les seules, ou nécessairement les meilleures, méthodes ou procédures pour les situations médicales abordées, mais plutôt à représenter une approche, un point de vue, une déclaration ou une opinion.
- Pibarot P, Dumesnil JG. Valves cardiaques prothétiques : sélection de la prothèse optimale et gestion à long terme. Circulation 2009;119:1034-48.
- Mack MJ, Douglas PS, Holmes DR. Faire plus de lumière sur la thrombose valvulaire après le remplacement valvulaire aortique transcathéter. J Am Coll Cardiol 2016;67:656-8.
- Heras M, Chesebro JH, Fuster V, et al. Risque élevé de thromboembolie précoce après un remplacement de valve cardiaque bioprothétique. J Am Coll Caridol 1995;25:1111-9.
- Roudaut R, Serri K, Lafitte S. Thrombose des valves cardiaques prothétiques : diagnostic et considérations thérapeutiques. Heart 2007;93:137-42.
- Masri A, Gillinov AM, Johnston DM, et al. Anticoagulation versus antiplaquettaire ou absence de traitement chez les patients subissant une implantation de valve bioprothétique : une revue systématique et une méta-analyse. Heart 2017;103:40-80.
- R Core Team (2015). R : un langage et un environnement pour le calcul statistique. Fondation R pour le calcul statistique ; Vienne, Autriche. Disponible à : https://www.R-project.org/. (En utilisant la fonction power.prop.test α = 0,05 et β = 0,8)
- Aramendi JI, Mestres CA, Martinez-León J, Campos V, Muñoz G, Navas C. Triflusal versus anticoagulation orale pour la prévention primaire de la thromboembolie après remplacement de la valve bioprothétique (trac) : essai prospectif, randomisé et coopératif. Eur J Cardiothorac Surg 2005;27:854-60.
- Colli A, Mestres CA, Castella M, Gherli T. Comparing warfarin to aspirin (WoA) after aortic valve replacement with the St. Jude Medical Epic heart valve bioprosthesis : results of the WoA Epic pilot trial. J Heart Valve Dis 2007;16:667-71.
- Mérie C, Køber L, Skov Olsen P, et al. Association of warfarin therapy duration after bioprosthetic aortic valve replacement with risk of mortality, thromboembolic complications, and bleeding. JAMA 2012;308:2118-25.
- Cremer PC, Rodriguez LL, Griffin BP, et al. Early Bioprosthetic Valve Failure : Mechanistic Insights via Correlation between Echocardiographic and Operative Findings. J Am Soc Echocardiogr 2015;28:1131-48.
- Brown ML, Park SJ, Sundt TM, Schaff HV. Risque de thrombose précoce chez les patients porteurs de valves biologiques en position aortique. J Thorac Cardiovasc Surg 2012;144:108-11.
- Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC guideline for the management of patients with valvular heart disease : a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2014;63:e57-185.
- Egbe AC, Pislaru SV, Pellikka PA, et al. Thrombose de la valve bioprothétique versus défaillance structurelle : Prédicteurs cliniques et échocardiographiques. J Am Coll Cardiol 2015;66:2285-94.
- Stewart WJ. La thrombose des valves bioprothétiques : Peut-on se permettre de l’ignorer ? J Am Coll Cardiol 2015;66:2295-7.
- Russo A, Grigioni F, Avierinos JF, et al. Complications thromboemboliques après correction chirurgicale de la régurgitation mitrale : incidence, prédicteurs et implications cliniques. J Am Coll Cardiol 2008;51:1203-11.
- Butnaru A, Shaheen J, Tzivoni D, Tauber R, Bitran D, Silberman S. Diagnostic et traitement du dysfonctionnement bioprothétique précoce en position de valve mitrale dû à la formation de thrombus. Am J Cardiol 2013;112:1439-44.
- Makkar RR, Fontana G, Jilaihawi H, et al. Possible subclinical Leaflet Thrombosis in Bioprosthetic Aortic Valves. N Engj J Med 2015;373:2015-24.
- Pache G, Schoechlin S, Blanke P, et al. Épaississement précoce hypo-atténué des feuillets dans les valves cardiaques aortiques transcathéter expansibles par ballonnet. Eur Heart J 2016;37:2263-71.
- Hansson NC, Grove EL, Andersen HR, et al. Thrombose de la valve aortique transcathéter : incidence, facteurs prédisposants et implications cliniques. J Am Coll Cardiol 2016;68:2059-69.
- Laschinger JC, Wu C, Ibrahim NG, Shuren JE. Réduction du mouvement du feuillet dans les valves aortiques bioprothétiques–le point de vue de la FDA. N Engj J Med 2015;373:1996-8.
- Étude mondiale comparant une stratégie antithrombotique à base de rivAroxaban à une stratégie à base d’antipLatelet après le rEplacement aortIc vaLve transcathéter pour optimiser les résultats cliniques (GALILEO) (site Web ClinicalTrails.gov). 2016. Disponible à : https://clinicaltrials.gov/ct2/show/NCT02556203. Consulté le 29/11/2016.
Thèmes cliniques : Gestion de l’anticoagulation, arythmies et EP clinique, chirurgie cardiaque, insuffisance cardiaque et cardiomyopathies, angiographie et intervention cardiovasculaire invasive, imagerie non invasive, cardiopathie valvulaire, gestion de l’anticoagulation et fibrillation auriculaire, fibrillation auriculaire/arythmies supraventriculaires, Chirurgie aortique, Chirurgie cardiaque et arythmies, Chirurgie cardiaque et insuffisance cardiaque, Chirurgie cardiaque et VHD, Insuffisance cardiaque aiguë, Interventions et imagerie, Interventions et cardiopathies structurelles, Angiographie, Echocardiographie/Ultrasons, Imagerie nucléaire
Mots-clés : Valve aortique, sténose valvulaire aortique, fibrillation auriculaire, Aspirine, bioprothèse, études cas-témoins, angiographie, constriction, pathologique, échocardiographie, transoesophagienne, électrocardiographie, insuffisance cardiaque, maladies des valves cardiaques, Prothèse de valve cardiaque, Valve mitrale, Sténose de la valve mitrale, Réopération, Facteurs de risque, Accident vasculaire cérébral, Sutures, Thrombose, Ticlopidine, Remplacement transcathéter de la valve aortique, Vitamine K, Warfarine
< Retour aux listes
.