Les récepteurs de type Toll sont des protéines de détection microbienne qui reconnaissent un large éventail de pathogènes, ils sont une protéine critique dans la protection initiale contre l’infection ; générant une réponse immédiate mais relativement non spécifique. Cette mini-revue met en évidence le rôle que jouent les TLR dans l’immunité innée, y compris des informations sur les voies de signalisation des TLR et les molécules qui leur sont associées.
Voir notre gamme complète d’anticorps TLR

Récepteurs de type TLR (TLR) Mini-revue
Télécharger en PDF
TLRs et immunité innée
Les récepteurs de type TLR (TLR) sont des composants essentiels de la réponse immunitaire innée et sont donc l’un des facteurs clés impliqués dans la reconnaissance et la défense contre les agents pathogènes envahissants. Ce sont des récepteurs transmembranaires qui peuvent être localisés soit à la surface des cellules, soit dans des vésicules endosomales. Ils appartiennent à la famille des récepteurs de reconnaissance des formes (PRR), avec les récepteurs du mannose (CD206), NOD et NALP. Comme ils sont impliqués dans l’identification du soi par rapport au non-soi, ils seraient également impliqués dans les maladies auto-immunes.
Les récepteurs de type Toll constituent une famille de protéines essentielles au système immunitaire inné qui est conservée des plantes aux mammifères.
En 1996 et 1997, Lamaitre et ses collègues ont montré que le gène Toll, un régulateur dorso-ventral du développement de la drosophile, était également impliqué dans la réponse immunitaire innée aux champignons et aux bactéries gram-positives (1, 2). Ce rôle était cohérent avec la similarité structurelle du domaine intracellulaire de Toll avec le récepteur de l’interleukine-1B.
Presque au même moment, le groupe de Janeway a cloné l’un des homologues mammaliens de Toll de drosophile, nommé par la suite Toll-like receptor 4 (TLR4). Ils ont observé qu’une forme active dominante de TLR4 était capable de stimuler le NFkB et les gènes inflammatoires dépendants du NFkB, et que TLR4 induit l’expression de CD80 (3).
L’expression de la molécule costimulatrice CD80 est nécessaire pour l’activation des lymphocytes T naïfs, et son induction par TLR4 a été la première preuve que le système immunitaire inné pouvait participer à la polarisation des lymphocytes T naïfs et activer l’immunité adaptative (3).
Gènes TLR et expression
À ce jour, 11 gènes TLR ont été identifiés chez l’homme, et 13 chez la souris. Ils peuvent être divisés en classes en fonction de leur fonction et de leur séquence. Bien que tous soient des protéines membranaires, certains TLR sont localisés dans des vésicules intracellulaires.
Bien que l’expression des TLR soit très large, plusieurs tissus exprimant plus d’un type de TLR, le niveau d’expression le plus élevé et la plus grande gamme de TLR se trouvent sur les tissus impliqués dans l’immunité innée (4).
Molécules associées aux TLR
Le domaine intracellulaire des TLR est appelé Toll/IL-1 (TIR), en raison de similitudes avec le récepteur de l’IL-1, tandis que la partie extracellulaire contient un domaine à répétition riche en leucine (LRR). Le TIR, est connu pour être impliqué dans la transduction du signal, tandis que le LRR est censé reconnaître directement le ligand cognate.
Sur liaison du ligand, les TLR se dimérisent ou s’associent à d’autres récepteurs. Le domaine TIR interagit avec d’autres protéines intracellulaires contenant du TIR.
Quatre protéines adaptatrices intracellulaires qui contiennent un domaine TIR ont été décrites :
- MyD88
- TRIF (ou TICAM-1)
- TIRAP (ou MAL)
- TICAM-2 (ou TRAM)
MyD88 et TRIF définissent deux voies de signalisation indépendantes, tandis que MAL et TICAM agissent comme des molécules ponts.
Voie de signalisation des TLR
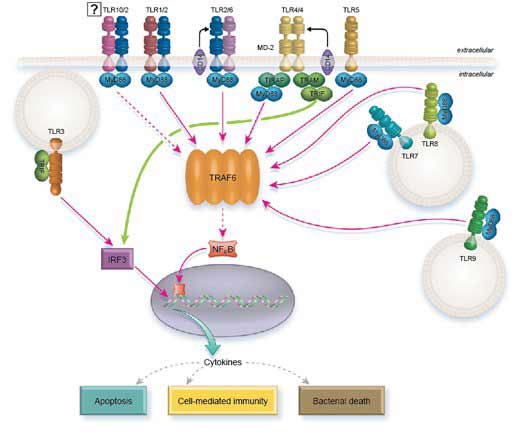
Signalisation des TLR
Tous les TLR, à l’exception de TLR3, peuvent signaler par l’intermédiaire de MyD88. Cependant, TLR2 et TLR4 ont besoin de TIRAP pour recruter MyD88. A son tour, MyD88 recrute IRAK1 et IRAK4 qui se dissocient de MyD88 après phosphorylation. Ensuite, IRAK1 et IRAK4 interagissent avec TRAF6 qui active à son tour la voie NFkB, AP1 et IRF5, stimulant finalement la transcription des cytokines inflammatoires.
Pour accomplir cette tâche, TRAF6 phosphoryle directement IRF5, tout en activant AP1 par l’intermédiaire des MAP kinases. La libération de NFkB de son inhibiteur IKB nécessite le recrutement des protéines TAK1 et TAB de TRAF6 qui agissent sur la kinase IKB (IKKa/IKKB/NEMO).
TLR7, TLR8, et TLR9 induisent la signalisation IFN de type I par l’intermédiaire de MyD88. Dans ce cas, MyD88 activerait directement IRF1 et indirectement IRF7 par l’interaction de TRAF6 avec TRAF3.
Au lieu d’agir par MyD88, TLR3 signale par TRIF. Cependant, la voie finit par activer les mêmes effecteurs : NFkB, AP1, IRF3, et IRF7.
TLR4 est unique en ce qu’il utilise à la fois MyD88 et TRIF comme molécules adaptatrices intracellulaires. Il a également besoin de la molécule pont TRAM pour recruter TRIF et de TIRAP pour recruter MyD88.
Intéressant, il semble que le TLR4 utilise les deux voies de manière séquentielle et non à partir du même compartiment (5). Lorsque TLR4 se lie au LPS, TIRAP est recruté et recrute à son tour la signalisation de MyD88 à partir de la membrane plasmique pour activer la transcription des cytokines. Le LPS favorise également l’internalisation de TLR4 par endocytose, un événement qui désactive la signalisation MyD88. A ce stade, le TLR4 internalisé continue à signaler à partir du compartiment de l’endolysosome, mais il agit maintenant par l’intermédiaire de TRAM/TRIF et conduit à la transcription des gènes de l’interféron.
Pour plus d’informations sur les récepteurs de reconnaissance de motifs, y compris les TLR, veuillez visiter notre page Web sur les récepteurs de reconnaissance de motifs et examiner la gamme d’anticorps disponibles.
- Lemaitre, B. et al. (1996) La cassette génétique régulatrice dorsoventrale spätzle/Toll/cactus contrôle la puissante réponse antifongique chez les adultes de la drosophile.
Cell. 86:973-83 - Lemaitre, B. et al. (1997) Défense de l’hôte chez la drosophile : induction différentielle des gènes de peptides antimicrobiens après infection par diverses classes de micro-organismes.
Proc Natl Acad Sci U S A. 94:14614-9 - Medzhitov, R. et al. (1997) Un homologue humain de la protéine Toll de la drosophile signale l’activation de l’immunité adaptative.
Nature. 388:394-7 - Zarember, K.A. et Godowski, P.J. (2002) Expression tissulaire des récepteurs Toll humains et régulation différentielle des ARNm des récepteurs Toll dans les leucocytes en réponse aux microbes, à leurs produits et aux cytokines.
J. Immunol. 168:554-561 - Barton, G.M. et Kagan, J.C. (2009) Une vue biologique cellulaire de la fonction des récepteurs Toll-like : régulation par la compartimentation.
Nat Rev Immunol. 9:535-42
Lecture complémentaire
- Montero Vega, M.T. et De Andrés Martín, A. (2009) La signification des récepteurs Toll-like dans les maladies humaines.
Allergol Immunopathol(Madr). 37:252-63 - Montero Vega, M.T. et De Andrés Martín, A. (2008) Toll-like receptors : a family of innate sensors of danger that alert and drive immunity.
Allergol Immunopathol(Madr). 36:347-57 - Uematsu, S. et Akira, S. (2008) Les récepteurs Toll-Like (TLR) et leurs ligands.
Handb Exp Pharmacol. :1-20 - Bauer, S. et al. (2009) La reconnaissance des formes par les récepteurs Toll-like.
Adv Exp Med Biol. 653:15-34 - Schmidt M. et al. (2010) Rôle crucial du récepteur humain Toll-like 4 dans le développement de l’allergie de contact au nickel.
Nat Immunol. 2010 Aug 15.