L’élément chimique hydrogène est classé comme un non-métal. Il peut devenir métallique à de très hautes pressions. Il a été découvert en 1766 par Henry Cavendish.

Data Zone
| Classification | L’hydrogène est un non-métal. Il peut devenir métallique à de très hautes pressions. |
| Couleur | incolore |
| Poids atomique | 1.0079 |
| Etat | gazeux |
| Point de fusion | -259,14 oC, 14,01 K |
| Point d’ébullition | -252,87 oC, 20.28 K |
| Électrons: | 1 |
| Protons: | 1 |
| Neutrons dans l’isotope le plus abondant : | 0 |
| Ecoquilles électroniques | 1 |
| Configuration électronique | 1s1 |
| Densité à 20oC | 0.0000899 g/cm3 |
Afficher plus, y compris : Chaleur, énergies, oxydation,
réactions, composés, rayons, conductivités
| Volume atomique | 14.4 cm3/mol | |
| Structure | hcp : hexagonal serré (sous forme solide à basse température) | |
| Dureté | – | |
| Capacité thermique spécifique | 14.304 J g-1 K-1 | |
| Chaleur de fusion | 0,117 kJ mol-1 de H2 | |
| Chaleur d’atomisation | 218 kJ mol-1 | |
| Chaleur de vaporisation | 0. 904 kJ mol-1 de H2.904 kJ mol-1 de H2 | |
| 1ère énergie d’ionisation | 1312 kJ mol-1 | |
| 2ème énergie d’ionisation | kJ mol-1 | |
| 3ème énergie d’ionisation | 11815.0 kJ mol-1 | |
| Affinité électronique | 72.7711 kJ mol-1 | |
| Nombre minimum d’oxydation | -1 | |
| Nombre minimum d’oxydation commune | -1 | |
| Nombre maximum d’oxydation | 1 | |
| Nombre maximum d’oxydation commune | . | 1 |
| Electronégativité (échelle de Pauling) | 2,18 | |
| Volume de polarisabilité | 0.7 Å3 | |
| Réaction à l’air | vigoureuse, ⇒ H2O | |
| Réaction avec 15 M HNO3 | aucun | |
| Réaction avec 6 M HCl | aucun | |
| Réaction avec 6 M NaOH | aucune | |
| Oxyde(s) | H2O | |
| Hydrure(s) | H2 | |
| Chlorure(s) | HCl | |
| Rayon atomique | 25 pm | |
| Rayon ionique (ion 1+) | – | |
| Rayon ionique (2+ ion) | – | |
| Rayon ionique (3+ ion) | – | |
| Rayon ionique (1- ion) | – | |
| Rayon ionique (2- ion) | – | |
| Rayon ionique (3- ion) | – | |
| Conductivité thermique | 0.1805 W m-1 K-1 | |
| Conductivité électrique | – | |
| Point de congélation/fusion : | -259,14 oC, 14,01 K |

Image de la Nasa : De vastes quantités d’hydrogène dans des galaxies lointaines.

Théophraste Paracelse – Le premier à avoir généré de l’hydrogène : « L’air surgit et éclate comme un vent. »
Découverte de l’hydrogène
Une expérience de chimie favorite des écoles consiste à ajouter un métal tel que le magnésium à un acide. Le métal réagit avec l’acide, formant un sel et libérant l’hydrogène de l’acide. L’hydrogène gazeux s’échappe du liquide sous forme de bulles et les élèves le recueillent en petites quantités pour d’autres expériences, comme le « pop-test ».’
Le premier cas enregistré d’hydrogène fabriqué par l’action humaine remonte à la première moitié des années 1500, par une méthode similaire à celle utilisée dans les écoles actuellement.Theophrastus Paracelsus, un médecin, a dissous du fer dans de l’acide sulfurique et a observé le dégagement d’un gaz. Il aurait dit de cette expérience : « L’air surgit et se répand comme un vent ». Il n’a cependant découvert aucune des propriétés de l’hydrogène.(1)
Turquet De Mayerne a répété l’expérience de Paracelse en 1650 et a constaté que le gaz était inflammable.(2) Ni Paracelse ni De Mayerne n’ont proposé que l’hydrogène puisse être un nouvel élément. En effet, Paracelse pensait qu’il n’existait que trois éléments – les tria prima – le sel, le soufre et le mercure – et que toutes les autres substances étaient constituées de différentes combinaisons de ces trois éléments. (3) (La chimie avait encore un long chemin à parcourir !)
En 1670, le scientifique anglais Robert Boyle a ajouté du fer à de l’acide sulfurique. Il a montré que le gaz (hydrogène) résultant ne brûlait que si de l’air était présent et qu’une fraction de l’air (que nous appellerions aujourd’hui oxygène) était consommée par la combustion.(4)
L’hydrogène a été reconnu pour la première fois comme un élément distinct en 1766 par le scientifique anglais Henry Cavendish, lorsqu’il l’a préparé en faisant réagir de l’acide chlorhydrique avec du zinc. Il a décrit l’hydrogène comme « l’air inflammable des métaux » et a établi qu’il s’agissait de la même matière (par ses réactions et sa densité) quels que soient le métal et l’acide qu’il utilisait pour le produire.(1) Cavendish a également observé que lorsque la substance était brûlée, elle produisait de l’eau.
Le scientifique français Antoine Lavoisier a ensuite nommé l’élément hydrogène (1783). Le nom vient du grec « hydro » qui signifie eau et « genes » qui signifie former – l’hydrogène est l’un des deux éléments formant l’eau.
En 1806, l’hydrogène étant bien établi comme élément, le chimiste anglais Humphry Davy a poussé un fort courant électrique à travers de l’eau purifiée.
Il a constaté que de l’hydrogène et de l’oxygène se formaient. L’expérience a démontré que l’électricité pouvait séparer les substances en leurs éléments constitutifs. Davy réalisa que les substances étaient liées entre elles par un phénomène électrique ; il avait découvert la véritable nature de la liaison chimique.(5)
Visitez la page de faits sur l’hydrogène de Chemicool.

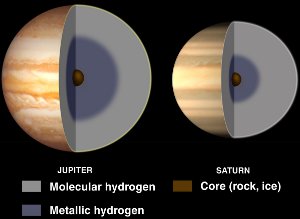
Intérieurs de Jupiter et de Saturne, avec de l’hydrogène métallique liquide. Courtoisie de NASA/JPL-Caltech.

Nasa : Le réservoir externe de carburant de la navette spatiale (orange) rempli d’hydrogène et d’oxygène liquides.

Les voitures à hydrogène émettent de l’eau plutôt que des polluants.

Électrolyse de l’eau en laboratoire. L’énergie électrique est utilisée pour fendre l’eau. L’hydrogène se rassemble dans une éprouvette, l’oxygène dans l’autre.
Apparence et caractéristiques
Effets nocifs :
L’hydrogène est hautement inflammable et possède une flamme presque invisible, ce qui peut entraîner des brûlures accidentelles.
Caractéristiques:
L’hydrogène est l’élément le plus simple de tous, et le plus léger. C’est aussi de loin l’élément le plus commun dans l’Univers. Plus de 90 % des atomes de l’Univers sont de l’hydrogène.
Sous sa forme la plus courante, l’atome d’hydrogène est constitué d’un proton, d’un électron et d’aucun neutron. L’hydrogène est le seul élément qui peut exister sans neutrons.
L’hydrogène est un gaz incolore et inodore qui existe, à température et pression standard, sous forme de molécules diatomiques, H2.
Il brûle et forme des mélanges explosifs dans l’air et il réagit violemment avec les oxydants.
Sur Terre, l’emplacement principal de l’hydrogène est dans l’eau, H2O. Il y a peu d’hydrogène libre sur Terre car l’hydrogène est si léger qu’il n’est pas retenu par la gravité de la planète. Tout hydrogène qui se forme finit par s’échapper de l’atmosphère vers l’espace.
Bien que l’hydrogène soit généralement un non-métal, il devient un métal liquide lorsque d’énormes pressions lui sont appliquées.
De telles pressions se trouvent à l’intérieur des planètes géantes gazeuses telles que Jupiter et Saturne. Le champ magnétique élevé de Jupiter (14 fois celui de la Terre) serait dû à un effet dynamo résultant de l’hydrogène métallique conducteur d’électricité circulant lors de la rotation de la planète.
Utilisations de l’hydrogène
De grandes quantités d’hydrogène sont utilisées dans le procédé Haber (production d’ammoniac), l’hydrogénation des graisses et des huiles, la production de méthanol, l’hydrocraquage et l’hydrodésulfuration. L’hydrogène est également utilisé dans le raffinage des métaux.
L’hydrogène liquide est utilisé comme carburant de fusée, alimentant par exemple le décollage et la montée en orbite de la navette spatiale. L’hydrogène liquide et l’oxygène sont contenus dans le grand réservoir externe de la navette. (Voir image à gauche.)
Les deux isotopes les plus lourds de l’hydrogène (deutérium et tritium) sont utilisés dans la fusion nucléaire.
L’économie de l’hydrogène a été proposée comme un remplacement de notre économie actuelle basée sur les hydrocarbures (pétrole, gaz et charbon).
La base de l’économie de l’hydrogène est que l’énergie est produite lorsque l’hydrogène brûle avec l’oxygène et que le seul sous-produit de la réaction est l’eau.
Pour le moment, cependant, l’hydrogène pour les voitures à hydrogène est produit à partir d’hydrocarbures. Ce n’est que lorsque les énergies solaire ou éolienne, par exemple, pourront être utilisées commercialement pour scinder l’eau en hydrogène et en oxygène qu’une véritable économie de l’hydrogène sera possible.
Abondance et isotopes
Abondance croûte terrestre : 1400 parties par million en poids (0,14%), 2,9% en moles
Abondance système solaire : 75% en poids, 93% en moles
Coût, pur : 12 $ par 100g
Coût, en vrac : $ par 100g
Source : L’hydrogène est préparé commercialement en faisant réagir de la vapeur surchauffée avec du méthane ou du carbone. En laboratoire, l’hydrogène peut être produit par l’action d’acides sur des métaux comme le zinc ou le magnésium, ou par l’électrolyse de l’eau (illustrée à gauche).
Isotopes : L’hydrogène possède trois isotopes, 1H (protium), 2H (deutérium) et 3H (tritium). Ses deux isotopes les plus lourds (deutérium et tritium) sont utilisés pour la fusion nucléaire. Le protium est l’isotope le plus abondant, et le tritium le moins abondant. Le tritium est instable et sa demi-vie est d’environ 12 ans et 4 mois. L’hydrogène naturel est un mélange des deux isotopes 1H et 2H avec des abondances naturelles de 99,99% et 0,01% respectivement.

- Peter Hoffmann, Tomorrow’s Energy : Hydrogen, Fuel Cells, and the Prospects for a Cleaner Planet, (2001) p22. MIT Press, Cambridge, MA.
- P. Litherland Teed, The Chemistry and Manufacture of Hydrogen., (2008) p2. Dabney Press.
- John S. Davidson, Annotations to Boyle’s « The Sceptical Chymist ».
- Andreas Züttel, Andreas Borgschulte, Louis Schlapbach, Hydrogen as a future energy carrier., (2008) p8. Wiley-VCH, Weinheim.
- Kendall Haven, 100 Greatest Science Discoveries of All Time., (2007) p62. Libraries Unlimited.
Citer cette page
Pour un lien en ligne, veuillez copier et coller l’un des éléments suivants:
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen</a>
ou
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen Element Facts</a>
Pour citer cette page dans un document académique, veuillez utiliser la citation conforme à la norme MLA suivante:
"Hydrogen." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hydrogen.html>.
.