Différence principale – Contrainte stérique vs contrainte de torsion
La contrainte est la répulsion entre les électrons de liaison d’une molécule. L’arrangement d’une molécule dépend de la contrainte puisque les paires d’électrons de liaison sont arrangées de manière à minimiser la contrainte. Il existe trois principaux types de déformations que l’on peut trouver dans une molécule. Il s’agit de la déformation angulaire, de la déformation de torsion et de la déformation stérique. La déformation angulaire se produit lorsque les angles de liaison des molécules réelles sont différents de ceux des molécules idéales. La déformation de torsion se produit lorsqu’une molécule est tournée autour d’une liaison. La contrainte stérique se forme lorsque deux groupes volumineux ou plus se rapprochent l’un de l’autre. La principale différence entre la contrainte stérique et la contrainte de torsion est que la contrainte stérique ne peut pas être diminuée par la rotation de la molécule autour d’une liaison alors que la contrainte de torsion peut être diminuée par la rotation de la molécule autour d’une liaison.
Domaines clés couverts
1. Qu’est-ce que la déformation stérique
– Définition, explication avec exemples
2. Qu’est-ce que la déformation de torsion
– Définition, explication avec exemples
3. Quelle est la différence entre la déformation stérique et la déformation de torsion
– Comparaison des principales différences
Termes clés : Contrainte angulaire, paire d’électrons de liaison, contrainte stérique, contrainte de torsion

Qu’est-ce que la contrainte stérique
La contrainte stérique est la répulsion entre deux atomes ou groupes d’atomes lorsque la distance qui les sépare diminue. Elle est également appelée encombrement stérique. La contrainte stérique est très importante pour déterminer l’arrangement d’une molécule puisque chaque molécule est arrangée de manière à ce que la contrainte stérique soit minimisée. Lorsque la contrainte stérique est minimisée, l’énergie potentielle de cette molécule est réduite. Puisque la matière est stable lorsqu’elle a un niveau d’énergie inférieur, le niveau d’énergie inférieur d’une molécule en fait une molécule stable.
Le concept de contrainte stérique est très important pour prédire les produits d’une réaction chimique. En effet, les groupes d’atomes sont attachés à un atome de carbone de telle manière que l’encombrement stérique est minimisé. Par conséquent, une réaction chimique donnera un mélange de molécules comprenant des produits stables et des produits instables. Mais le constituant principal de ce mélange sera toujours le produit stable avec un encombrement stérique minimisé.

Figure 1 : Souche stérique dans les composés organiques
Comme le montre l’image ci-dessus, l’énergie potentielle d’une molécule est augmentée en fonction de la souche stérique qu’ils ont. Lorsque la distance entre deux groupes méthyles diminue, l’énergie potentielle augmente.
Figure 2 : La souche stérique augmente lorsque des groupes volumineux sont présents
L’image ci-dessus montre que la souche stérique augmente lorsque des groupes volumineux sont présents. Les molécules plus encombrées stériquement ont une énergie potentielle plus élevée par rapport aux molécules moins encombrées stériquement. Par conséquent, les molécules moins stériquement encombrées sont plus stables.
Qu’est-ce que la contrainte de torsion
La contrainte de torsion est la répulsion qui se produit entre les atomes ou le groupe d’atomes lorsqu’une molécule est tournée autour d’une liaison sigma. Il s’agit de la répulsion que l’on peut observer lorsque les électrons de la liaison passent les uns à côté des autres. Ce type de contrainte est important pour déterminer les conformations stables des composés organiques. Ces conformations peuvent être représentées par des projections de Newman. La projection de Newman d’une molécule est la conformation de cette molécule lorsqu’on regarde à travers la liaison C-C dans la direction avant-arrière.
La déformation de torsion apparaît lorsque l’angle dièdre des groupes volumineux est faible. L’angle dièdre est l’angle entre deux liaisons de deux atomes de carbone différents dans une projection de Newman. Si l’angle dièdre est élevé, alors la déformation de torsion est faible.
Les projections de Newman peuvent être trouvées dans deux types comme la conformation décalée et la conformation éclipsée. La conformation éclipsée montre une déformation de torsion élevée que celle de la conformation décalée.
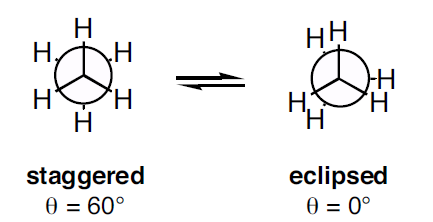
Figure 3 : Deux types de projection de Newman
Comme le montre l’image ci-dessus, la conformation décalée montre un angle dièdre de 60o et la conformation éclipsée montre un angle dièdre de 0o. Mais lorsque la molécule subit une rotation, la conformation est modifiée. La déformation de torsion dans la conformation décalée est inférieure à celle de la conformation éclipsée. Lorsque la molécule est tournée, la conformation éclipsée peut devenir la conformation décalée ; ainsi, la déformation de torsion est réduite.
Différence entre la déformation stérique et la déformation de torsion
Définition
Déformation stérique : La déformation stérique est la répulsion entre deux atomes ou groupes d’atomes lorsque la distance qui les sépare est diminuée.
Déformation de torsion : La contrainte de torsion est la répulsion qui se produit entre les atomes ou le groupe d’atomes lorsqu’une molécule est tournée autour d’une liaison sigma.
Rotation de la molécule
Contrainte stérique : La contrainte stérique ne peut être diminuée par la rotation de la molécule autour d’une liaison sigma.
Déformation de torsion : La contrainte de torsion peut être diminuée en faisant tourner la molécule autour d’une liaison sigma.
Cause de la contrainte
Contrainte stérique : La déformation stérique se produit lorsque la distance entre les groupes volumineux d’une molécule est diminuée.
Déformation de torsion : La contrainte de torsion se produit lorsque les électrons de liaison passent les uns à côté des autres lorsque la molécule tourne.
Conclusion
La contrainte d’une molécule est la répulsion entre les électrons de liaison ou les paires d’électrons solitaires présents dans cette molécule. Cette répulsion entraîne une augmentation de l’énergie potentielle d’une molécule. Elle rend alors la molécule instable. La contrainte stérique d’une molécule est déterminée par les groupes volumineux présents dans une molécule et la distance entre ces groupes volumineux. La projection de Newman est une structure simple qui montre l’arrangement des atomes ou des groupes d’atomes dans une molécule organique. Elle peut être utilisée pour déterminer la contrainte de torsion d’une molécule. La principale différence entre la contrainte stérique et la contrainte de torsion est que la contrainte stérique ne peut pas être diminuée par la rotation de la molécule autour d’une liaison alors que la contrainte de torsion peut être diminuée par la rotation de la molécule autour d’une liaison.
1. « Contrainte de torsion ». OChemPal, Disponible ici. Consulté le 28 août 2017.
2. « Déformation (chimie) ». Wikipédia, Wikimedia Foundation, 25 juillet 2017, Disponible ici. Consulté le 28 août 2017.
3. » Angle dièdre « . OChemPal, Disponible ici. Consulté le 28 août 2017.
Image Courtesy:
1. « Napthalene phenanthraene methyl-methyl strai » Par DMacks – Travail propre (Domaine public) via Commons Wikimedia
2. « Steric hindrance disp » Par Mwolf37 – Travail propre (CC BY-SA 3.0) via Commons Wikimedia
3. « Escalonada e eclipsada » Par Pauloquimico – Travail propre (CC BY-SA 3.0) via Commons Wikimedia
![]()
.