Cyclopentane Propriétés chimiques,utilisations,production
Propriétés physiques et chimiques
Le cyclopentane, également connu sous le nom de « pentaméthylène », est une sorte de cycloalcane dont la formule est C5H10. Il a un poids moléculaire de 70,13. Il existe sous la forme d’un liquide inflammable. Il a un point de fusion de 94,4 °C, un point d’ébullition de 49,3 °C, une densité relative de 0,7460 et un indice de réfraction de 1,4068. Il est soluble dans l’alcool, l’éther et les hydrocarbures et n’est pas soluble dans l’eau. Le cyclopentane n’est pas un anneau plan et présente deux conformations : les conformations d’enveloppe et les conformations de demi-chair. L’angle de liaison carbone-carbone est proche de 109 ° 28 ‘, la tension moléculaire n’est pas grande et le cycle est relativement stable. Il a une propriété chimique similaire à celle des alcanes. La concentration létale dans l’air pour les rats était de 3,8 × 10-2. Il présente une couleur rouge-jaune lorsqu’il réagit avec de l’acide sulfurique fumant et génère du nitrocyclopentane et de l’acide glutarique par réaction avec de l’acide nitrique. Méthode : il peut être obtenu à partir du distillat d’éther de pétrole, par craquage à haute pression du cyclohexane en présence d’aluminium ou par hydrogénation catalytique du cyclopentène et du cyclopentadiène. Buts : principalement utilisé comme solvant.
Figure 1 la structure du cyclopentane.
Cycloalcane
Les cycloalcanes sont des hydrocarbures saturés dans lesquels les atomes de carbone de la molécule sont disposés dans un cycle et un nombre suffisant d’atomes d’hydrogène sont combinés. Les cycloalcanes présentés dans le pétrole sont principalement le cyclopentane et le cyclohexane.
Les cycloalcanes ont un point de fusion, un point d’ébullition et une densité relative plus élevés que les alcanes à chaîne droite correspondants. Nous pouvons utiliser le pétrole brut aromatique naphténique pour produire de l’essence à haut indice d’octane et dont l’anti-explosion est meilleure que celle de la paraffine normale. Le pétrole brut naphténique paraffinique à faible teneur en soufre est non seulement facile à traiter, mais constitue également une excellente matière première pour la production de lubrifiants avancés. Le pétrole contenant relativement beaucoup de composés naphténiques polycycliques à longue chaîne latérale est un matériau idéal pour les lubrifiants de haute qualité.
À température ambiante et à la pression atmosphérique, le cycloalcane contenant quatre atomes de carbone ou moins est sous forme gazeuse avec ceux qui contiennent plus de quatre carbones existant sous forme liquide. Le cyclopropane et le cyclobutane apparaissent sous forme de gaz, le cyclopentane à cycloundécane apparaît sous forme liquide ; le cyclododécane et plus apparaît sous forme solide.
La nature chimique du cycloalcane est liée au nombre d’atomes de carbone formant le cycle. On parle de cycle à trois et quatre chaînons, comme petit cycle ; le cycle à cinq à sept chaînons comme cycle normal ; le cycle à huit-onze comme cycle normal ; le cycle à douze chaînons et plus comme grand cycle. Les lignes des noyaux de carbone dans les petits cycles ne correspondent pas à l’axe de l’orbitale de liaison. Dans le cyclopropane, l’anneau formé par les lignes des noyaux des atomes de carbone est un triangle équilatéral dont chaque angle est de 60° alors que l’angle de l’axe de l’orbitale hybride sp3 des liaisons simples carbone-carbone formées par chaque carbone est de 104° (voir figure 2 ci-dessous). Par conséquent, l’orbite n’a pas réussi à atteindre le plus grand degré de chevauchement, ce qui entraîne une grande tension angulaire. Le cyclobutane présente également une tension angulaire, mais plus faible. Cela entraîne une faible stabilité du petit cycle, ce qui lui confère une propriété chimique similaire à celle des oléfines qui peuvent avoir une réaction d’addition par ouverture de cycle avec de nombreux réactifs. Les autres cycles ont une tension angulaire moindre ou nulle. Les cycloalcanes et les alcanes ont des propriétés chimiques similaires, ils sont moins susceptibles d’avoir une réaction d’ouverture de cycle, comme une réaction avec l’hydrogène. Le cyclohexane et le cycloalcane supérieur sont plus difficiles à subir une hydrogénation.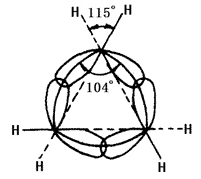
La figure 2 est une représentation schématique du chevauchement des orbitales d’hybridation sp3 dans le cyclopropane.
Le cyclopropane (à température ambiante) et le cyclobutane (dans les conditions de chauffage) peuvent avoir une réaction d’addition avec un halogène et un halogénure d’hydrogène.
La boucle ouverte se produit entre les deux atomes reliant les nombres les plus et les moins élevés d’hydrogène. L’addition satisfait à la règle markovienne. Alors que le cycle normal, sous la stimulation de la lumière ou de la chaleur peut avoir une réaction de substitution avec l’halogène.
A la température ambiante, le cycloalcane ne peut pas être oxydé par le permanganate de potassium.
Le cyclopentane, le cyclohexane et ses produits substitués par un alkyle sont présentés dans certaines huiles de pétrole. Les cycloalcanes peuvent également être synthétisés par des méthodes appropriées, telles que la cyclisation des dihaloalcanes et l’hydrogénation des hydrocarbures aromatiques.
Cette information a été éditée par Xiaonan à partir de Chemicalbook (2015-08-17).
Situation dangereuse
L’ingestion et l’inhalation sont modérément toxiques. (2) Étant inflammable avec un plus grand risque de combustion. La concentration admissible dans l’air est de 600ppm (1720mg/m3) aux États-Unis.
Effets nocifs et symptômes d’empoisonnement
L’inhalation de fortes concentrations de cyclopentane peut provoquer une inhibition du système nerveux central, bien que sa toxicité aiguë soit faible. Les symptômes d’une exposition aiguë sont d’abord l’excitation, puis l’apparition de troubles de l’équilibre, voire la stupeur, le coma. Il existe de rares cas de décès dus à une insuffisance respiratoire. Il a été signalé que les animaux nourris avec cette marchandise peuvent avoir une diarrhée sévère, entraînant un effondrement vasculaire du cœur, des poumons et du foie et une dégénérescence cérébrale.
Mesures de protection
Il peut être utilisé pour améliorer l’équipement de production. Utiliser des crèmes de protection de la peau ou des gants pour protéger la peau.
Soins médicaux
Lors d’un examen physique régulier, faites attention à l’effet d’irritation potentiel de la peau et des voies respiratoires ainsi qu’aux éventuelles complications des reins et du foie.
Conditions de transport
Liquide inflammable de catégorie I. Code des règlements sur les dangers : 61013. Le récipient doit être marqué d’une marque « liquide inflammable » lors du transport.
Agent extincteur
Voir « cyclohexane ».
Méthodes recommandées d’élimination des déchets
Incinération ;
Propriétés chimiques
Il se présente comme un liquide incolore avec un point de fusion de-93,9 °C, le point d’ébullition de 49,26 ° C, la densité relative de 0,7460 (20/4 ° C), l’indice de réfraction de 1,4068 et le point d’éclair de-37 °C. Il est miscible avec l’alcool, l’éther et d’autres solvants organiques, n’étant pas facile à dissoudre dans l’eau.
Utilisations
(1) Il peut être utilisé comme solvant pour la polymérisation en solution du caoutchouc polyisoprène et de l’éther de cellulose. Il peut être utilisé comme substitut du fréon comme matériaux d’isolation dans les réfrigérateurs et les congélateurs, ainsi que comme agent moussant pour d’autres mousses PU dures, et comme norme d’analyse chromatographique.
(2) Utilisé comme substance standard pour l’analyse chromatographique, les solvants, les carburants pour moteurs, les agents de distillation azéotropique.
Méthode de production
Le cyclopentane est un composant de l’éther de pétrole dans la gamme de point d’ébullition de 30-60 °C, la teneur étant généralement de 5%-10%. Appliquer la distillation atmosphérique ; à un rapport de reflux de 60 : 1 et réaliser dans une tour de 8 m de hauteur ; distiller d’abord l’isopentane et le n-pentane ; poursuivre le fractionnement pour obtenir un cyclopentane dont la pureté est supérieure à 98 %. Le cyclopentane peut également être obtenu par réduction de la cyclopentanone ou par hydrogénation catalytique du cyclopentadiène.
Dangers &Informations de sécurité
Catégorie Liquides inflammables
Classement de toxicité : Faible toxicité
Toxicité aiguë : DL50 orale-rat : 11400 mg/kg ; DL50 orale-souris : 12800 mg/kg
Propriété dangereuse des explosifs : être explosif en cas de mélange avec l’air
Inflammabilité et situations dangereuses : être inflammable en cas d’incendie, température élevée et oxydant avec combustion dégageant une fumée irritante
Caractéristiques de stockage : Stockage : ventilé, basse température et sec ; Stockez-le avec l’oxydant séparément
Agent extincteur : Poudre sèche, dioxyde de carbone, mousse, agent extincteur 1211
Norme professionnelle : TWA 1720 mg/m3 ; STEL 2150 mg/kg
Propriétés chimiques
liquide incolore avec une odeur de pétrole
Propriétés chimiques
Le cyclopentane est un liquide incolore.
Propriétés physiques
Liquide incolore, mobile, inflammable et dont l’odeur ressemble à celle du cyclohexane.
Utilisations
Le cyclopentane est un produit pétrolier. Il est formé à partir du craquage catalytique à haute température du cyclohexane ou par réduction du cyclopentadiène. Il est présent dans les fractions d’éther de pétrole et dans de nombreux solvants commerciaux.Il est utilisé comme solvant pour la peinture, dans l’extraction de la cire et de la graisse, et dans l’industrie de la chaussure.
Utilisations
Comme réactif de laboratoire ; dans la fabrication de produits pharmaceutiques ; présent dans les solvantset dans l’éther de pétrole ; agent de pressurisation des propulseurs.
Méthodes de production
Le cyclopentane se trouve dans les fractions d’éther de pétrole et estpréparé par craquage du cyclohexane en présence d’alumine à haute température et pression ou par réduction du cyclopentadiène.
Définition
ChEBI : Un cycloalcane qui consiste en cinq carbones liés chacun à deux hydrogènes au-dessus et au-dessous du plan. Le parent de la classe des cyclopentanes.
Description générale
Un liquide incolore clair avec une odeur de pétrole. Point d’éclair de -35°F. Moins dense que l’eau et insoluble dans l’eau. Les vapeurs sont plus lourdes que l’air.
Air &Eau Réactions
Hautement inflammable. Insoluble dans l’eau.
Profil de réactivité
CYCLOPENTANE est incompatible avec les agents oxydants forts tels que le chlore, le brome, le fluor….
Danger pour la santé
L’inhalation provoque des vertiges, des nausées et des vomissements ; les vapeurs concentrées peuvent provoquer une perte de connaissance et un effondrement. Les vapeurs provoquent un léger picotement des yeux. Le contact avec le liquide provoque une irritation des yeux et peut irriter la peau si on le laisse agir. L’ingestion provoque une irritation de l’estomac. L’aspiration produit une grave irritation des poumons et un œdème pulmonaire à développement rapide ; une excitation du système nerveux central suivie d’une dépression.
Danger pour la santé
Le cyclopentane est un toxique de faible intensité. Son exposition à des concentrations élevées peut produire une dépression du système nerveux central avec des symptômes d’excitabilité, de perte d’équilibre, de stupeur et de coma. Une insuffisance respiratoire peut survenir chez les rats après 30 à 60 minutes d’exposition à 100 000-120 000 ppm dans l’air. C’est un irritant pour les voies respiratoires supérieures, la peau et les yeux. Aucune information n’est disponible dans la littérature sur les effets chroniques d’une exposition prolongée au cyclopentane.
Danger d’incendie
Comportement en cas d’incendie : Les conteneurs peuvent exploser.
Réactivité chimique
Réactivité avec l’eau Aucune réaction ; Réactivité avec les matériaux courants : Aucune réaction ; Stabilité pendant le transport : Stable ; Agents de neutralisation des acides et des caustiques : Non pertinent ; Polymérisation : Non pertinent ; Inhibiteur de polymérisation : Non pertinent.
Profil de sécurité
Légèrement toxique par ingestion et inhalation. Les concentrations élevées ont une action narcotique. Risque d’incendie très dangereux en cas d’exposition à la chaleur ou aux flammes ; peut réagir avec les oxydants. Pour combattre le feu, utiliser de la mousse, du CO2, de la poudre chimique. Lorsqu’il est chauffé jusqu’à décomposition, il émet une fumée et des émanations âcres.
Exposition potentielle
Le cyclopentane est utilisé comme solvant.
Source
Composant de l’essence à haut indice d’octane (cité, Verschueren, 1983). Harley et al. (2000)ont analysé les vapeurs de l’espace de tête de trois catégories d’essence sans plomb où de l’éthanol a été ajouté pour remplacer l’éther tert-butylique de méthyle. Le cyclopentane a été détecté à une concentration identique de 1,4 % en poids dans les vapeurs de l’espace de tête pour les catégories régulière, intermédiaire et supérieure.
Schauer et al. (1999) ont signalé la présence de cyclopentane dans les gaz d’échappement d’un camion de poids moyen à moteur diesel à un taux d’émission de 410 μg/km.
L’essence reformulée Phase II de la Californie contenait du cyclopentane à une concentration de 4,11 g/kg. Les taux d’émission en phase gazeuse des gaz d’échappement des automobiles à essence avec et sans convertisseur catalytique étaient respectivement de 0,78 et 85,4 mg/km (Schauer et al., 2002).
Faits environnementaux
Biologique. Le cyclopentane peut être oxydé par des microbes en cyclopentanol, qui peut oxyder la tocyclopentanone (Dugan, 1972).
Photolytique. Les constantes de vitesse suivantes ont été rapportées pour la réaction de l’octane et des radicaux OH dans l’atmosphère : 3,7 x 10-12 cm3/molécule?sec à 300 K (Hendry et Kenley, 1979) ; 5,40 x 10-12 cm3/molécule?sec (Atkinson, 1979) ; 4,83 x 10-12 cm3/molécule?sec à 298 K (DeMore et Bayes, 1999) ; 6,20 x 10-12, 5,24 x 10-12, et 4.43 x 10-12 cm3/molécule?sec à 298, 299, et 300 K, respectivement (Atkinson, 1985), 5,16 x 10-12 cm3/molécule?sec à 298 K (Atkinson, 1990), et 5,02x 10-12 cm3/molécule?sec à 295 K (Droege et Tilly, 1987).
Chemique/Physique. Le cyclopentane ne s’hydrolyse pas car il ne possède aucun groupe fonctionnel hydrolysable. La combustion complète dans l’air donne du dioxyde de carbone et de l’eau.
A des températures élevées, la rupture du cycle se produit en formant de l’éthylène et vraisemblablement de l’allène et de l’hydrogène (Rice et Murphy, 1942).
Envoi
UN1146 Cyclopentane, Classe de danger : 3 ; Étiquettes : 3-liquide inflammable.
Méthodes de purification
Le libérer du cyclopentène par deux passages dans une colonne de gel de silice activé soigneusement séché et dégazé. Il se trouve dans le pétrole et est HAUTEMENT INFLAMMABLE.
Incompatibilités
Peut former un mélange explosif avec l’air.Peut accumuler des charges électriques statiques, et peut provoquer une ignition de ses vapeurs. Le contact avec des oxydants forts peut provoquer un incendie et une explosion.
Élimination des déchets
Dissoudre ou mélanger la matière avec un solvant combustible et brûler dans un incinérateur chimique équipé d’une postcombustion et d’un épurateur. Toutes les réglementations environnementales fédérales, nationales et locales doivent être respectées.