Carcinome in situ chez un patient atteint d’érythroleucoplasie : défis dans le diagnostic et dans le choix thérapeutique
Titre court : Carcinome in situ dans une érythroleucoplasie
Willian Pecin JacomacciI ; Liogi Iwaki FilhoII ; Lilian Cristina Vessoni IwakiII ; Mariliani Chicarelli da SilvaII ; Neli PielarisiII ; Vanessa Cristina VeltriniII ; Rafael de Oliveira LazarinIII ; Elen de Souza TolentinoIV
I Étudiant de premier cycle à l’Université d’État de Maringá, Maringá-PR, Brésil.
II DDS, MA, PhD, professeur associé, département de dentisterie, Université d’État de Maringá, Maringá-PR, Brésil.
III DDS, MA candidat en dentisterie à l’Université d’État de Maringá, Maringá-PR, Brésil.
IV DDS, MA, PhD, professeur adjoint, département de dentisterie, Université d’État de Maringá, Maringá-PR, Brésil.
Endereço para correspondência
ABSTRACT
Un homme caucasien de 41 ans, fumeur, a présenté une plaque rouge et blanche sur la muqueuse jugale gauche évoquant une érythroleucoplasie orale (ELO). La biopsie suivie d’un examen microscopique a révélé un carcinome in situ. L’érythroleucoplasie buccale étant considérée comme une lésion précancéreuse à fort potentiel de transformation maligne, le présent cas a pour but de discuter des difficultés à diagnostiquer cette affection et à choisir le traitement le plus approprié. La discussion porte sur des questions telles que l’existence d’une limite pour le choix d’une approche radicale ou plus conservatrice du traitement et l’importance d’utiliser une procédure qui permet un examen microscopique de la lésion entière. Le carcinome in situ associé à l’OEL a rendu la planification du traitement encore plus complexe dans le cas présent. Afin d’éviter une approche mutilante, des excisions multiples avec des marges de sécurité ont été réalisées, et le patient a reçu l’instruction de ne pas fumer. Un suivi strict à 12 mois ne montre aucun signe de récidive de l’OEL.
Descripteurs : Erythroplasie ; Leucoplasie ; Traitement primaire.
INTRODUCTION
L’érythroleucoplasie orale (EEL), parfois assimilée à une leucoplasie mouchetée ou nodulaire, est une plaque rouge et blanche présentant un risque relativement élevé de transformation maligne1. Le tabac et l’alcool sont les principaux facteurs de risque associés à son potentiel malin.2,3
L’OEL présente un potentiel de transformation maligne plus élevé que la leucoplasie homogène,2-4 ce qui peut être partiellement démontré par des examens histologiques et immunohistochimiques et des études de cohorte. Le taux de transformation maligne de l’OEL varie de 18 % à 47 %, alors qu’il est d’environ 1 à 7 % pour la leucoplasie orale épaisse homogène (OL), et de 4 à 15 % pour l’OL granuleuse ou verruciforme.5 Histologiquement, les lésions de l’OEL sont caractérisées par des changements épithéliaux d’hyperkératose, d’hyperplasie, d’atrophie, un certain degré de dysplasie épithéliale, un carcinome in situ ou un carcinome superficiellement invasif. En outre, les lésions OEL présentent des indices mitotiques et apoptotiques plus élevés que les lésions OL homogènes et nodulaires6.
La gestion des troubles potentiellement malins peut être un défi. Le traitement clinique consiste en l’élimination des facteurs de risque,7 le suivi,8 l’utilisation de rétinoïdes,9 de vitamines A, C, E, de kétorolac, de célécoxib, de thé vert, de fénrétinide, de lycopène,10 et de thérapie photodynamique.5,11-14 Le traitement chirurgical consiste en l’ablation des lésions, la cryochirurgie et l’ablation au laser15.
Les objectifs de cette étude étaient (1) de rapporter les détails cliniques et histologiques de l’OEL sur la muqueuse jugale, et (2) d’examiner la littérature concernant les caractéristiques démographiques, cliniques et histologiques de l’OEL, ainsi que son pronostic et son traitement.
RAPPORT DE CAS
Un homme caucasien fumeur de 41 ans s’est présenté à la clinique de médecine buccale de l’Université d’État de Maringá, au Brésil, signalant une lésion asymptomatique sur le côté gauche de la muqueuse jugale dont le moment de développement est inconnu. L’examen intrabuccal a montré une plaque rouge près de la région prémolaire et une plaque nodulaire blanche autour de la région molaire (figure 1).
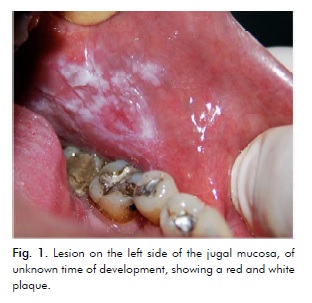
Le diagnostic présumé était soit une OEL, soit un carcinome épidermoïde. Des échantillons de biopsie ont été prélevés dans la région nodulaire blanche plus postérieure et dans la région rouge plus antérieure.
L’examen histopathologique par coloration à l’hématoxyline et à l’éosine a révélé une hyperkératose et une atrophie, avec un carcinome in situ focal dans la région rouge plus antérieure, compatible avec le carcinome in situ de l’OEL. L’examen a également révélé une hyperkératose avec une dysplasie modérée dans la région blanche plus postérieure, compatible avec un diagnostic de LO. L’épithélium pavimenteux stratifié recouvrant la muqueuse présentait des degrés variables d’ortho et de parakératose, les cellules de la crête rhomboïde présentant un hyperchromatisme et un pléomorphisme dans environ la moitié de l’épaisseur de l’épithélium. Cependant, une zone plus petite présentait des caractéristiques dysplasiques plus évidentes dans l’ensemble de l’épithélium, mais sans aucun signe d’un modèle infiltrant (Fig. 2A). Les caractéristiques consistaient en une stratification désorganisée et altérée, des projections de gouttes alternant avec une atrophie (Fig. 2A et 2B), un rapport nucléocytoplasmique inhabituel, un hyperchromatisme, un pléomorphisme, une perte d’adhésion intercellulaire avec des figures mitotiques peu fréquentes (Fig. 2C), et des foyers dyskératosiques (Fig. 2D). Le tissu conjonctif sous-jacent à ces zones présentait des modifications inflammatoires plus intenses.
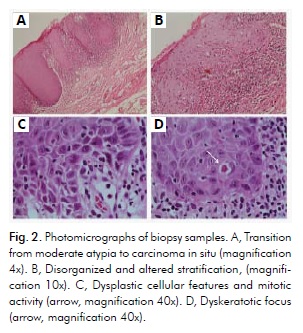
Les caractéristiques cliniques et microscopiques étaient compatibles avec un diagnostic d’OEL associé à un carcinome in situ focal. A ce stade, le patient a reçu une explication approfondie sur ses options de traitement : (1) il pouvait être adressé à un chirurgien du cou et de la tête, qui utiliserait probablement une approche invasive, associée ou non à une radiothérapie ; (2) il pouvait suivre un traitement ambulatoire à la clinique de médecine buccale avec une approche plus conservatrice qui préserverait les aspects esthétiques et fonctionnels. Le patient a choisi la deuxième option et a signé le formulaire de consentement éclairé approprié (annexe A).
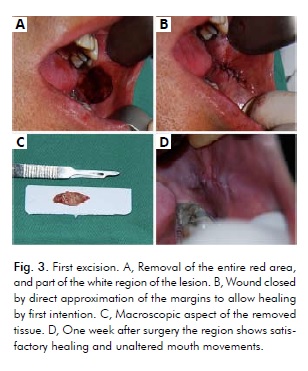
En raison de la taille étendue de la lésion et du fait qu’une seule grande excision pourrait restreindre les mouvements de la bouche, les procédures chirurgicales ont consisté en trois excisions multiples à l’aide d’un scalpel, réalisées sur une période de 2 mois, avec un intervalle de 30 jours entre chaque procédure. En raison de la présence d’un carcinome in situ dans la région rouge, la première procédure a consisté en son excision complète, ainsi qu’une partie de la région blanche de la lésion, en utilisant une marge de sécurité de 5 mm (Fig. 4). En outre, le patient a reçu l’instruction d’arrêter de fumer.
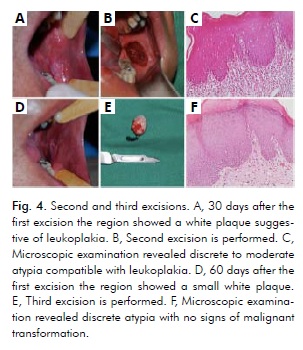
L’examen clinique un mois après la première excision a montré une plaque blanche évocatrice de leucoplasie (Fig. 4A). La seconde excision a alors été réalisée (Fig. 4B), et l’examen microscopique a révélé des atypies discrètes à modérées (Fig. 4C). L’examen intrabuccal, deux mois après la première excision, a montré une petite plaque blanche située encore plus postérieurement qu’auparavant (Fig. 4D). Ensuite, la troisième excision a été réalisée (Fig. 4E), qui a révélé des atypies discrètes (Fig. 4F). Les deuxième et troisième excisions ont été réalisées dans la région molaire plus postérieure en utilisant la même marge de sécurité de 5 mm. Les tissus de ces deux excisions étaient compatibles avec une leucoplasie sans aucun signe de transformation maligne (Fig. 4C, Fig. 4F).
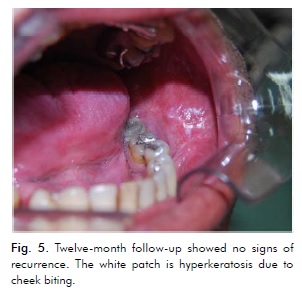
Le patient a arrêté de fumer et fait l’objet d’un suivi strict, ayant été vu toutes les semaines pendant les trois premiers mois, tous les mois jusqu’à un an, et tous les trois mois ensuite. Aucun signe de récidive n’a été observé 15 jours après la troisième et dernière excision, confirmé lors du rendez-vous de suivi à 12 mois (Fig. 5).
DISCUSSION
L’OEL est considérée comme une leucoplasie non homogène avec des plaques mixtes blanches et rouges et présente un risque élevé de transformation maligne2-4. Les zones rouges ou érythroplasiques semblent être plus susceptibles de subir des changements dysplasiques que les zones blanches hyperkératosiques,7 comme cela a été constaté dans le cas présent, les cellules les plus atypiques étant observées dans la région rouge. Yen et al. (2008)16 ont constaté que la consommation de chique de bétel et de cigarettes entraînait un risque de 42,2 % de développer une leucoplasie et un risque de 95,0 % de développer une OEL après 20 ans de suivi. Le patient dans le cas présent avait fumé environ dix cigarettes par jour pendant 20 ans et la biopsie initiale a révélé un carcinome in situ associé à une OEL.
Parce que les modalités de traitement de l’OEL sont variables, le choix de la thérapie appropriée peut être un défi. Compte tenu de son stade de développement et de son potentiel malin élevé, on peut se demander si le traitement doit être conservateur ou invasif. Afin de vérifier les modalités de traitement les plus utilisées, nous avons passé en revue la littérature sur cette question. Les sources étaient les bases de données Medline et Lilacs, les textes devaient être rédigés en anglais, et les termes de recherche étaient oral AND nonhomogeneous OR no homogeneous AND leukoplakia OR erythroleukoplakia. La leucoplasie non homogène a été utilisée, car de nombreux auteurs la considèrent comme un synonyme d’érythroleucoplasie. Huit études sur le traitement de l’OEL ont été trouvées,5,7,14,16-19 publiées entre 1987 et 2010. Sur un total de 226 cas, 211 ont été traités par une approche clinique (thérapie photodynamique et suivi clinique), et 15 ont été traités par excision chirurgicale (tableau 1).
Pour ce qui est de l’approche clinique, la thérapie photodynamique (TPD) est utilisée dans le traitement des troubles potentiellement malins car elle est non invasive, bien tolérée par les patients, peut être utilisée de manière répétée sans effets secondaires cumulatifs et entraîne une faible formation de cicatrices. 5,11,13,14 Cependant, cette technique a montré un succès variable, des résultats de suivi incohérents et des récidives.17 En effet, la récidive de la maladie en utilisant la TPD peut varier entre 21%5 et 29%14.
Une étude en double aveugle contrôlée par placebo 17 a révélé que la vitamine A et le bêta-carotène, utilisés seuls, donnaient de meilleurs résultats sur les leucoplasies homogènes et les lésions plus petites. Ainsi, l’utilisation de la vitamine A ou du bêtacarotène était discutable dans le cas présent, en raison de la taille de la lésion et du carcinome in situ associé.
Le traitement traditionnel de l’OEL consiste en son excision complète,15,21,22 en particulier pour les lésions présentant une dysplasie sévère.21,22 L’excision complète permet une analyse histologique de la totalité de la lésion, ce qui peut révéler des altérations non diagnostiquées lors de la biopsie préopératoire.8 De plus, à notre connaissance, les études à long terme n’ont pas encore démontré si une récidive survient ou non après un traitement non chirurgical.20,23 Deux des huit études examinées ont utilisé l’excision chirurgicale pour traiter l’OEL,8,19 avec des taux de récidive variant de 10,1 %19 à 20 %8.
La présente étude a opté pour une approche chirurgicale car la biopsie avait révélé une transformation maligne initiale. De plus, des excisions multiples associées à des marges de sécurité ont été choisies en raison de la grande taille de la lésion, car une grande plaie pouvait limiter les mouvements de la bouche et compliquer la récupération postopératoire. Cette option a également permis de réaliser des examens microscopiques supplémentaires, qui ont révélé différents degrés d’atypie, ce qui a orienté le traitement. Lors de l’intervention chirurgicale, une attention particulière a été portée à ne pas couvrir l’ouverture du canal parotidien afin de prévenir l’atrophie glandulaire et d’éviter d’autres complications telles qu’une mucocèle ou une réduction du flux salivaire. La plaie a été fermée par rapprochement direct des bords, permettant une cicatrisation de première intention, sans réduction significative de l’ouverture buccale.
Vedtofte et al (1987)8 déclarent que le défaut muqueux causé par les excisions peut être réparé par seconde intention ou fermé en utilisant d’autres techniques, telles que l’approximation directe des marges de la plaie, la transposition par un lambeau muqueux local, la greffe muqueuse libre et la greffe de peau divisée libre. À notre connaissance, il n’existe aucune étude utilisant des greffes alloplastiques sur des lésions potentiellement malignes dont le traitement peut provoquer de grands défauts. Bien que les greffes puissent être utilisées pour récupérer de larges sites chirurgicaux, comme le préconisent plusieurs auteurs,8,24 elles peuvent être infectées par Candida sp, subir une contraction postopératoire, des déformations et masquer des signes précoces de récidive8.
Le laser et la cryothérapie peuvent être utilisés seuls ou associés aux méthodes chirurgicales traditionnelles pour le traitement de l’OEL. Cantarelli Morosolli et al. (2006)7 rapportent un cas réussi de la maladie traité par excision et rayonnement laser au dioxyde de carbone. Des études de cohorte ont montré que la chirurgie laser joue un rôle important dans le diagnostic et le traitement des lésions potentiellement malignes.10,18,25,26 L’utilisation de la cryochirurgie, bien que rapportée dans la littérature9, partage avec l’ablation laser l’inconvénient majeur de ne pas fournir la totalité de la lésion pour l’examen histologique.27,28 En outre, la cryothérapie provoque une douleur et un gonflement postopératoires considérables, et les lésions potentiellement malignes sont rarement complètement détruites.10
Vedtofte et al. (1987)8 ont constaté que les lésions prémalignes traitées par excision chirurgicale présentaient un taux de récidive général de 20 %, souvent diagnostiqué dans la première année postopératoire. La plupart des récidives d’OEL ont été trouvées dans les zones adjacentes à la lésion précédemment traitée. La récurrence de l’érythroplasie et de la leucoplasie verruqueuse était de 40 % et 55,6 %, respectivement. La leucoplasie n’a montré aucune récurrence. Deux cas d’OEL se sont transformés en carcinome, ainsi qu’un cas de leucoplasie verruqueuse. Les récidives de lésions potentiellement malignes étaient souvent adjacentes à la lésion excisée, peut-être parce que la marge de sécurité de 3 à 5 mm n’a pas permis d’enlever la totalité du tissu pathologiquement modifié. Les auteurs considèrent que l’excision chirurgicale est un traitement satisfaisant pour les lésions potentiellement malignes et soulignent l’importance d’utiliser une technique permettant l’examen histologique de la totalité de la lésion.
Les difficultés à déterminer la marge exacte d’une lésion sont particulièrement fréquentes pour l’érythroplasie ou l’OEL,8 ce qui peut expliquer le taux élevé de récidive de ces lésions. Afin d’éviter de laisser des tissus pathologiques sur le site chirurgical et de minimiser le risque de récidive, la présente étude a opté pour des excisions multiples. Les mouvements buccaux sont normaux et il n’y a aucun signe de récidive. En outre, le risque de récidive et de transformation maligne est réduit avec l’élimination des facteurs de risque, comme l’arrêt du tabac et de l’alcool. Le patient a reçu l’instruction d’arrêter de fumer, et a effectivement arrêté la cigarette, étant actuellement sous un suivi strict.
Dans le présent rapport de cas, une modalité conservatrice de traitement chirurgical de l’OEL a été proposée. Bien qu’il s’agisse toujours d’une procédure chirurgicale, elle est peu invasive par rapport aux approches traditionnelles utilisées par les chirurgiens de la tête et du cou et les oncologues. Leur approche typique consiste en des excisions plus radicales et étendues qui entraînent généralement une mutilation et une altération de l’aspect esthétique et de la fonction. La décision d’adopter une approche radicale ou plus conservatrice est difficile à prendre, car la recherche n’a pas encore établi de protocole unique pour traiter ces cas. Le choix du traitement de cas comme celui-ci nécessite une évaluation minutieuse des circonstances individuelles, en tenant compte du degré d’atypie cellulaire, de la localisation et de l’accès à la lésion, ainsi que de sa taille. Nous pensons qu’en principe, ces lésions ne devraient pas être traitées comme des tumeurs malignes, ce qui nous permet d’éviter le protocole de routine des grandes résections et des thérapies adjuvantes, comme la radiothérapie. En outre, nous pensons qu’il faut garder à l’esprit que le carcinome in situ n’est pas invasif. Son élimination chirurgicale, ainsi que l’arrêt des facteurs de risque, comme le tabac, et une surveillance constante peuvent se traduire par un traitement réussi. De plus, les interventions chirurgicales multiples permettent de multiples examens microscopiques, ce qui offre au patient une perspective plus rassurante et l’assurance qu’il n’y a pas de cellules malignes dans la région.
REFERÊNCIAS
1. Küffer R, Lombardi T. Lésions prémalignes de la muqueuse buccale. Une discussion sur la place de la néoplasie intraépithéliale orale (NIO). Oral Oncol. 2002;38:125-30.
2. Van der Waal I. Troubles potentiellement malins de la muqueuse buccale et oropharyngée ; terminologie, classification et concepts actuels de prise en charge. Oral Oncol. 2009;45:317-23.
4. Warnakulasuriya S, Johnson NW, van der Waal I. Nomenclature et classification des troubles potentiellement malins de la muqueuse orale. J Oral Pathol Med. 2007;36:575-80.
5. Yu CH, Lin HP, Chen HM, Yang H, Wang YP, Chiang CP. Comparaison des résultats cliniques de l’érythroleukoplakie orale traitée par thérapie photodynamique utilisant soit une diode électroluminescente, soit un laser. Lasers Surg Med. 2009;41:628- 33.
6. Kövesi G, Szende B. Changements dans l’apoptose et l’indice mitotique, l’expression de p53 et Ki67 dans divers types de leucoplasie orale. Oncologie. 2003;65:331-6.
7. Cantarelli Morosolli AR, Schubert MM, Niccoli- Filho W. Traitement chirurgical de l’érythroleukoplakie dans la lèvre inférieure avec le rayonnement laser de dioxyde de carbone. Lasers Med Sci. 2006;21:181-4.
8. Vedtofte P, Holmstrup P, Hjørting-Hansen E, Pindborg JJ. Traitement chirurgical des lésions prémalignes de la muqueuse buccale. Int J Oral Maxillofac Surg. 1987;16:656-64.
10. Thomson P. Oral Precancer – Diagnosis and Management of Potentially Malignant Disorders. Hoboken : Wiley-Blackwell : 2012 ; p. 107-136.
11. Dolmans DE, Fukumura D, Jain RK. La thérapie photodynamique pour le cancer. Nat Rev Cancer. 2003;3:380-7.
12. Lee MR, Ryman W. Erythroplasie du Queyrat traitée par thérapie photodynamique topique à l’aminolevulinate de méthyle. Australas J Dermatol. 2005;46:196-8.
13. Chen HM, Yu CH, Tsai T, Hsu YH, Kuo RC, Chiang CP. Topical 5-aminolevulinic acidmediated photo-dynamic therapy for oral verrucous hyperplasia, oral leukoplakia and oral erythroleukoplakia. Photodiagn Photodyn Ther. 2007;4:44-52.
14. Lin HP, Chen HM, Yu CH, Yang H, Wang YP, Chiang CP. La thérapie photodynamique topique est très efficace pour l’hyperplasie verruqueuse orale et l’érythroleukoplakie orale. J Oral Pathol Med. 2010;39:624-30.
15. Reichart PA, Philipsen P. Erythroplakie orale : une revue. Oral Oncol. 2005 ; 41:551-61.
16. Yen AM, Chen SC, Chang SH, Chen TH. The effect of betel quid and cigarette on multistate progression of oral pre-malignancy. J Oral Pathol Med. 2008;37 : 417-22.
17. Sankaranarayanan R, Mathew B, Varghese C, Sudhakaran PR, Menon V, Jayadeep A, Nair MK, Mathews C, Mahalingam TR, Balaram P, Nair PP. Chemoprevention of oral leukoplakia with vitamin A and beta carotene : an assessment. Oral Oncol 1997 ; 33 : 231-6.
18. Schoelch ML, Sekandari N, Regezi JA, Silverman S Jr. Gestion au laser des leucoplasies orales : une étude de suivi de 70 patients. Laryngoscope 1999 ; 109 : 949-53.
19. Pandey M, Thomas G, Somanathan T, Sankaranarayanan R, Abraham EK, Jacob BJ, Mathew B. Evaluation of surgical excision of nonhomogeneous oral leukoplakia in a screening intervention trial, Kerala, India. Oral Oncol. 2001;37:103-9.
20. Spinola Ribeiro A, Ribeiro Salles P, da Silva TA, Alves Mesquita R. Une revue du traitement non chirurgical de la leucoplasie orale. Int J Dent 2010 ; Article ID 186018, 10 pages, 2010. doi:10.1155/2010/186018.
21. Marley JJ, Cowan CG, Lamey PJ, Linden GJ, Johnson NW, Warnakulasuriya KA. Gestion des lésions potentiellement malignes de la muqueuse buccale par les chirurgiens buccaux et maxillofaciaux consultants du Royaume-Uni. Br J Oral Maxillofac Surg. 1996;34:28-36.
22. Marley JJ, Linden GJ, Cowan CG, Lamey PJ, Johnson NW, Warnakulasuriya KAAS, Scully C. A comparison of the management of potentially malignant oral mucosa lesions by oral medicine practitioners and oral and maxillofacial surgeons in the UK. J Oral Pathol Med. 1998;27 : 489-95.
23. Lodi G, Sardella A, Bez C, Demarosi F, Carrasi A. Intervations for treatings oral leukoplakia. Cochrane Database Syst Ver. 2006;4:CD001929.
24. Frame JW, Das Gupta AR, Dalton GA, Evans EH. Utilisation du laser à dioxyde de carbone dans la gestion des lésions prémalignes de la muqueuse buccale. J Laryngol Otol. 1984;98:1251-60.
25. Stocker J, Thomson PJ, Hamadah O. Laser surgery in oral oncology – the Newcastle experience. The Surgeon 2005 ; Suppl 3 : S32-33.
26. Hamadah O, Thomson PJ. Facteurs affectant le traitement au laser à dioxyde de carbone pour le précancer oral : une étude de cohorte de patients. Lasers Surg Med 2009 ; 41 : 17-25.
28. Sako K, Marchetta FC, Hayes RL Cryothérapie de la leucoplasie intraorale. Am. J. Surg. 1972:124:482-4.