Au cours des derniers mois, des variantes du SRAS-CoV-2 ont été détectées qui sont inhabituelles car elles présentent beaucoup plus de mutations génomiques que celles trouvées précédemment. Ces variantes ont été appelées « variantes préoccupantes » (VOC) car il a été suggéré que les mutations du génome pourraient avoir un impact sur la transmission, le contrôle immunitaire et la virulence. Ci-dessous, j’aborde chacune de ces questions séparément.
Transmission
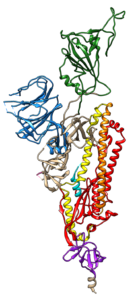
La lignée de SRAS-CoV-2 appelée B.1.1.7 est apparue au Royaume-Uni en septembre 2020 et abrite 17 mutations génomiques, dont certaines entraînent des modifications d’acides aminés dans la protéine spike (photo). Des variantes similaires mais distinctes ont été détectées dans d’autres endroits, notamment en Afrique du Sud (B.1.135) et au Brésil, mais c’est la lignée B.1.1.7 qui a été la mieux étudiée. Un bon résumé des modifications se trouve dans ce manuscrit. Un certain nombre d’éléments de preuve ont permis de conclure que les virus de la lignée B.1.1.7 peuvent avoir une transmissibilité accrue par rapport aux isolats précédents. Il s’agit notamment du déplacement rapide des variants précédents au Royaume-Uni dans un court laps de temps ; d’une augmentation apparente de l’indice R pour ces variants ; et de l’augmentation des niveaux d’ARN viral dans les lavages nasopharyngés, mesurés par PCR ou séquençage de l’ARN.
La définition virologique de la transmission est le déplacement des virus d’un hôte à un autre. Dans le cas du SRAS-CoV-2, une telle transmission se produit lorsque des particules virales infectieuses sont exhalées dans des gouttelettes respiratoires et arrivent chez un autre hôte, où elles initient l’infection. Les preuves citées ci-dessus d’une transmission accrue de la lignée B.1.1.7 sont toutes indirectes et ne prouvent pas que les variants se transmettent effectivement, au sens virologique, mieux entre les hôtes. La croissance de la population du variant pourrait, par exemple, être la conséquence de changements dans le comportement humain. L’indice R, une mesure de la transmissibilité, est influencé non seulement par le virus mais aussi par le comportement humain. La découverte de niveaux accrus d’ARN dans le lavage nasopharyngé n’est pas non plus concluante en ce qui concerne la transmission. L’ARN viral n’est pas la même chose que le virus infectieux, et aucune étude n’a été réalisée pour mesurer l’excrétion du virus infectieux chez les personnes infectées par des variantes de la lignée B.1.1.7 par rapport à d’autres variantes.
Il ne fait aucun doute que la lignée B.1.1.7 a rapidement supplanté les autres au Royaume-Uni. Il n’a pas été démontré si ce comportement est dû à une capacité accrue du virus à se transmettre d’un hôte à l’autre. Le variant a également été détecté dans d’autres pays et sa dispersion dans ces endroits ne correspond pas à une augmentation de la transmission (telle que je l’ai définie ci-dessus). Par exemple, nous savons maintenant que la lignée B.1.1.7 était présente aux États-Unis 5 à 6 semaines avant sa détection au Royaume-Uni, mais en janvier, elle ne représentait que 0,3 % des cas au niveau national. Après deux mois de circulation en Californie, on estime que la lignée représente 0,4 % des cas, contre 1,2 % à un moment similaire au Royaume-Uni. En Floride, la lignée est associée à une plus grande propagation, 0,7% des cas, mais ce n’est pas la situation dans les autres Etats américains.
Ces données soulignent que nous ne pouvons pas conclure que la lignée B.1.1.7 est biologiquement plus transmissible. De multiples facteurs sont probablement en jeu, et c’est pourquoi il est préférable de considérer les variantes de la lignée B.1.1.7 et les autres en termes de fitness – le succès reproductif du virus. De nombreux facteurs peuvent influencer l’aptitude, et pas seulement la transmission. Il peut s’agir d’une plus grande stabilité physique de la particule, d’une résistance accrue aux réponses immunitaires, d’une durée plus longue de présence du virus dans le nasopharynx, d’une production accrue de virus infectieux chez l’hôte, d’un établissement plus efficace de l’infection chez un hôte, etc. Une légère augmentation de l’un de ces facteurs peut entraîner une variante particulière au sein d’une population sans pour autant affecter la transmission interhumaine. Il faut également prendre en compte la question de savoir si ces mutations se propagent par effet fondateur – le fait d’être au bon endroit au bon moment.
Les modèles statistiques qui ont été utilisés pour approximer la transmission des variantes du SRAS-CoV-2 ne peuvent pas prouver une propriété biologique car l’entraînement au sein d’une population peut être une conséquence de divers paramètres de fitness. Des expériences sur des modèles animaux (auquel cas la pertinence pour l’homme est inconnue) ou la mesure du virus infectieux chez l’homme sont nécessaires. Jusqu’à présent, aucune de ces dernières n’a été faite pour les variantes actuelles.
Contrôle immunitaire
Une préoccupation plus immédiate est de savoir si l’une des modifications de la protéine spike dans le COV a un impact sur la capacité de la réponse immunitaire à contrôler les infections. Cette question a été directement abordée pour les anticorps neutralisants, par exemple ceux qui peuvent bloquer une infection. Les anticorps reconnaissent des séquences protéiques spécifiques sur la particule virale, et plus particulièrement la protéine spike pour les personnes ayant reçu le vaccin à ARNm. Certaines des modifications de la protéine spike identifiées dans les variants se trouvent dans des régions connues pour fixer les anticorps. Par conséquent, une question importante est de savoir si la vaccination peut inhiber l’infection par les virus variants.
Cette question a été abordée pour les vaccins à ARNm Moderna et Pfizer. Les sérums des personnes vaccinées avec l’ARNm-1273 ont efficacement neutralisé les virus pseudotypés portant la glycoprotéine de pointe du SRAS-CoV-2 de la lignée B.1.1.7. Ces sérums présentaient un titre de neutralisation réduit (6,4 fois) lorsque la lignée sud-africaine B.1.351 était utilisée. Cependant, ces sérums neutralisaient encore complètement le B.1.351 avec un titre de 1:290, ce qui pourrait être suffisant pour prévenir les cas graves de COVID-19. Néanmoins, Moderna a annoncé qu’elle allait avancer un vaccin modifié (ARNm-1273.351) codant pour les modifications des acides aminés du B.1.Dans une étude distincte, le sérum de personnes vaccinées avec le vaccin à ARNm BNT162b2 de Pfizer a été testé dans des essais de neutralisation avec des virus SRAS-CoV-2 présentant des modifications d’acides aminés de pointe sélectionnées dans les lignées B.1.1.7 (délétion des acides aminés 69/70, N501Y, D614G) ou B.1.351 (E484K + N501Y + D614G). Ces modifications ont eu de faibles effets sur la neutralisation par les sérums. Cependant, les virus modifiés ne contiennent pas l’ensemble des changements trouvés dans les virus B.1.1.7 et B.1.351, ce qui pourrait expliquer les différents résultats obtenus en comparant les sérums avec les anticorps induits par l’ARNm-1273.
Ces observations permettent de croire que les deux vaccins à ARNm offriront une protection contre le COVID-19 causé par les variantes actuellement en circulation. Cependant, la surveillance génomique doit être accrue pour s’assurer que les nouveaux changements de pics qui pourraient survenir soient détectés rapidement et que leurs effets sur la neutralisation soient déterminés.
Sévérité de la maladie
Une étude précédente n’a pas montré de preuves que les virus de la lignée B.1.1.7 étaient associés à un risque accru d’hospitalisation ou de décès. Cependant, après examen de données supplémentaires provenant de trois études distinctes, le NERVTAG conclut qu’il existe une « possibilité réaliste que l’infection par le VOC B.1.1.7 soit associée à un risque accru de décès par rapport à l’infection par des virus non VOC ». Cette conclusion est le résultat d’analyses statistiques des taux de mortalité rapportés chez les personnes infectées par le virus VOC B.1.1.7 ou par des virus non VOC. Par exemple, dans une étude, le risque relatif de décès était de 1,35 (avec un intervalle de confiance à 95 % de 1,08-1,68). Dans une autre étude, le rapport moyen des taux de létalité entre les cas causés par des virus COV ou non COV était de 1,36 (IC à 95 % : 1,18-1,56). Il s’agit de petites différences avec de larges intervalles de confiance allant d’un effet nul à un effet plus important, et les auteurs notent que le risque absolu de décès reste faible. Les statistiques sont calculées en analysant un ensemble limité de données sur tous les décès liés au COVID-19 (8 %) et peuvent donc être erronées. En outre, il ne semble pas y avoir de risque accru d’hospitalisation associé à l’infection par les virus COV. Ma lecture de ce rapport est qu’il sert principalement d’avertissement pour continuer la surveillance génomique des variants en ce qui concerne le risque de décès et n’arrive pas à une conclusion sur la causalité.
Mise à jour : Novavax vient de publier les premiers résultats de leur phase 3, le vaccin COVID-19 basé sur la protéine de pointe. L’efficacité était de près de 90% au Royaume-Uni, mais dans un essai plus petit en Afrique du Sud, elle était de 50% contre la variante B.1.135.