Comme nous l’avons vu, notre alimentation comprend de nombreux glucides, et vous pourriez vous demander s’il existe un moyen d’analyser un échantillon pour savoir s’il s’agit de saccharose, ou d’un des édulcorants synthétiques comme le sorbitol ou le sirop de maïs à haute teneur en fructose, ou même d’un composé comme la vitamine C, qui est synthétisée à partir de sucres et qui, comme eux, ne contient que C, H et O. Il existe une telle méthode, et c’est l’une des formes d’analyse les plus fondamentales, appelée analyse élémentaire. C’est l’une des premières méthodes que les chercheurs utilisent pour identifier un nouveau composé.
Jusqu’ici, nous avons obtenu tous les rapports stœchiométriques à partir des coefficients des équations chimiques équilibrées. Cependant, les formules chimiques indiquent également des quantités relatives de substance, et les rapports stœchiométriques peuvent également en être dérivés. Par exemple, la formule CO2 nous indique que quelle que soit la taille de l’échantillon de dioxyde de carbone que nous avons, il y aura toujours 2 moles d’atomes d’oxygène pour chaque mole d’atomes de carbone. Autrement dit, à partir de la formule CO2, nous avons le rapport stœchiométrique
\
Nous pourrions également déterminer que pour le CO2
\
\
(Les réciproques de ces rapports stœchiométriques sont également valables pour le CO2.)
Des rapports stœchiométriques dérivés de formules au lieu d’équations sont impliqués dans la procédure la plus courante pour déterminer les formules empiriques des composés qui ne contiennent que C, H et O. Une quantité pesée de la substance à analyser est placée dans un train de combustion et chauffée dans un courant d’O2 sec. Tout le H du composé est converti en H2O(g) qui est piégé sélectivement dans un tube d’absorption préalablement pesé. Tout le C est converti en CO2(g) et celui-ci est absorbé sélectivement dans un second tube. L’augmentation de la masse de chaque tube indique, respectivement, la quantité de H2O et de CO2 produite par la combustion de l’échantillon
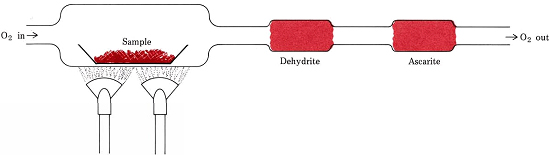
Figure \(\PageIndex{1}\) Un train de combustion. H2O et CO2, produits par la combinaison de O2 avec H et C dans l’échantillon, sont absorbés sélectivement par des tubes contenant de la déshydrite et de l’ascarite (NaOH sur amiante).
Exemple \(\PageIndex{1}\) : Formule empirique de l’acide ascorbique
Un échantillon de 6,49 mg d’acide ascorbique (vitamine C) a été brûlé dans un train de combustion. 9,74 mg de CO2 et 2,64 mg de H2O ont été formés. Déterminez la formule empirique de l’acide ascorbique.
Solution Nous devons connaître la quantité de C, la quantité de H et la quantité de O dans l’échantillon. Le rapport entre ces éléments donne les indices de la formule. Les deux premiers peuvent être obtenus à partir des masses de CO2 et de H2O en utilisant les masses molaires et les rapports stœchiométriques
\
\
Donc
\
Le composé peut aussi avoir contenu de l’oxygène. Pour savoir si c’est le cas, calculez les masses de C et de H et soustrayez-les de la masse totale de l’échantillon
\
On a donc
et
Les rapports des quantités des éléments dans l’acide ascorbique sont donc
\5619>
Puisque nC :nH:nO est de 3 mol C:4 mol H:3 mol O, la formule empirique est C3H4O3.
Un dessin d’une molécule d’acide ascorbique est présenté ici. Vous pouvez déterminer en comptant les atomes que la formule moléculaire est C6H8O6 – exactement le double de la formule empirique. Il est également évident qu’il y a plus à savoir sur une molécule que le simple nombre d’atomes de chaque type présents. Dans l’acide ascorbique, comme dans d’autres molécules, la façon dont les atomes sont reliés entre eux et leur disposition dans l’espace tridimensionnel sont très importantes. Une image montrant quels atomes sont reliés à quels autres est appelée formule développée. Les formules empiriques peuvent être obtenues à partir de la composition en pourcentage ou d’expériences sur le train de combustion et, si le poids moléculaire est connu, les formules moléculaires peuvent être déterminées à partir des mêmes données. Des expériences plus complexes sont nécessaires pour trouver les formules structurelles. Dans l’exemple 2, nous avons obtenu la masse de O en soustrayant les masses de C et H de la masse totale de l’échantillon. Cela supposait que seuls C, H et O étaient présents. Parfois, une telle hypothèse peut s’avérer incorrecte. Lorsque la pénicilline a été isolée et analysée pour la première fois, on n’a pas remarqué qu’elle contenait du soufre. Cette erreur n’a pas été découverte avant un certain temps car le poids atomique du soufre est presque exactement le double de celui de l’oxygène. Deux atomes d’oxygène ont été substitués à la place d’un atome de soufre dans la formule.
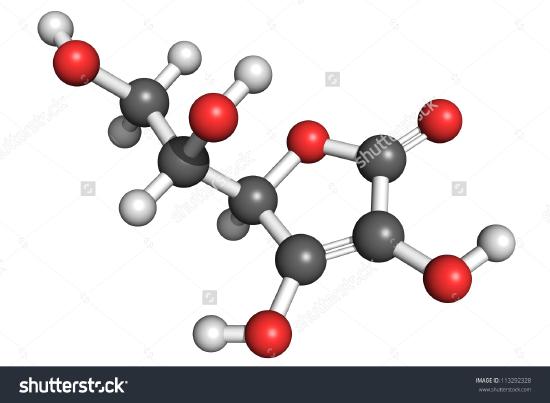
Figure \(\PageIndex{2}\) Une représentation 3D de l’acide L-ascorbique 1
From ChemPRIME : 3.4 : Analyse des composés