Introduction
Peut-être la première référence dans l’histoire humaine à l’absorption du fer et de l’alcool remonte à 1200 avant JC, une légende de Thessalie raconte qu’Apolodorus d’Iphycus, debout dans un champ à regarder son père castrer des agneaux, fut menacé de la même punition ; devenu adulte, Apolodorus était impuissant. Un sorcier nommé Melampus, inspiré par un vautour, guérit Apolodorus en lui faisant boire dans un verre de vin la rouille du couteau avec lequel son père castrait les agneaux et dont il avait été menacé.
Nombreuse est la population des malades alcooliques vus dans notre hôpital ainsi que ceux qui nécessitent une hospitalisation, compte tenu de toutes les entités morbides qui l’accompagnent.
Notre objectif à travers cette communication est de rappeler une des pathologies hématologiques présentes dans l’alcoolisme qui peut souvent rétrograder avec la seule abstinence : l’anémie sidéroblastique et l’hémosidérose.
Bjorkman en 1956 a décrit quatre patients présentant des anémies chroniques réfractaires et des anneaux sidéroblastiques avec une coloration au bleu de Prusse des cellules de la moelle osseuse.
La première preuve que ces anneaux sidéroblastiques étaient associés à l’alcool a été proposée par Mac Gibbon et Mollin en 1965, depuis lors l’alcoolisme est devenu la cause la plus fréquente de cette pathologie.
En 1969, Hines (remplaçant le i par un 1) a décrit dans l’alcoolisme chronique la survenue d’une anémie sidéroblastique réversible due à l’abstinence.
Effets de l’alcool
Les multiples effets pathologiques de l’alcool(remplacer par 2) sur le tissu hématopoïétique peuvent être divisés en :
Ceux résultant de l’effet direct de l’alcool
Ceux résultant d’effets secondaires à des carences nutritionnelles
Ceux causés par une maladie du foie
L’anémie est une cause fréquente chez les alcooliques.(remplacer par 3) Parmi celles-ci, les plus courantes sont l’anémie mégaloblastique et l’anémie sidéroblastique.
Ces derniers seraient liés à des facteurs nutritionnels et à des perturbations du métabolisme de la vitamine B6.
Une diminution de la capacité de la pyridoxine à se transformer en pyridoxal phosphate, forme active de la vitamine B6, a été mise en évidence suite à l’inhibition de l’activité pyridoxal phosphokinase érythrocytaire.
Il a également été suggéré que l’éthanol pourrait agir comme un stimulant de la phosphatase alcaline membranaire en accélérant la dégradation du phosphate de pyridoxal cellulaire (remplacer par 4). Cette altération du métabolisme de la pyridoxine est corroborée par une diminution de l’excrétion urinaire de l’acide pyridoxique 4-pyridoxique, qui est un métabolite de la pyridoxine, et une diminution du phosphate pyridoxal sérique.
Le pyridoxal phosphate agit également comme un facteur adjuvant dans la synthèse de l’acide delta-aminolévulinique, qui est l’un des précurseurs de la fraction d’hémoglobine contenant du fer, c’est-à-dire l’hémo.
D’autres études ont montré que l’éthanol agit non seulement directement mais aussi par l’intermédiaire de son métabolite l’acétaldéhyde. L’acétaldéhyde a également été crédité d’une augmentation de la dégradation du phosphate de pyridoxal, entraînant une diminution du phosphate de pyridoxal sérique et aggravant la formation de phosphate de pyridoxal dans les globules rouges humains in vitro en accélérant la dégradation des composés phosphorylés de la vitamine B6.
Lorsque les méthodes de coloration du fer (bleu de Prusse et coloration des perles) sont utilisées, les granules métalliques contenant du fer non hémique, vraisemblablement sous forme d’hémosidérine ou de ferritine ont tendance à former un anneau autour du noyau des érythroblastes. On les appelle anneaux de sidéroblastes ou sidéroblastes annulaires.
La microscopie électronique a montré que ces sidéroblastes ont les dépôts de fer au niveau des mitochondries ou des corps cytoplasmiques.
Ces anomalies morphologiques sont associées à toutes les caractéristiques d’une érythropoïèse inefficace : hyperplasie érythroïde, augmentation de la captation du fer par les précurseurs érythroïdes de la moelle osseuse, incorporation subnormale du fer dans l’hémoglobine circulante avec reflux du fer dans la circulation, provoquant une hyperferémie, une destruction intra-nucléaire des normoblastes, une anémie et une réticulocytopénie.
La fréquence de l’anneau sidéroblastique dans la moelle érythroïde est plus fréquente chez le malade chronique, et chez les patients alcooliques mal nourris.
Les données cliniques et expérimentales suggèrent qu’un facteur nutritionnel est important dans la pathogenèse de l’anémie sidéroblastique chez les patients alcooliques.
L’administration chronique expérimentale d’alcool chez des volontaires humains a produit des modifications sidéroblastiques dans la moelle osseuse.
Lorsque l’alcool était administré avec une faible quantité de pyridoxine et de folates alimentaires, des anneaux de
sidéoblastes se sont développés après plusieurs semaines chez la plupart des sujets étudiés.
En 1970, Hines et Cowan mentionnent une altération de la phosphorylation de la pyridoxine en pyridoxal phosphate confirmant ainsi la perturbation du métabolisme de la pyridoxine par trois axes d’investigation :
Une diminution du pyridoxal phosphate et des anneaux sidéroblastiques ont été produits chez 2 des 3 sujets maintenus dans un régime pauvre en folates avec supplémentation en alcool. Ils ont ensuite montré une réponse hématologique après l’administration de phosphate de pyridoxal mais pas avec l’acide folique ou les thérapeutiques à base de pyridoxine.
Après l’administration de pyridoxine chez les alcooliques malades chroniques, il y a un déficit dans la formation de phosphate de pyridoxal par rapport aux témoins.
Ils décrivent une réduction in vitro de la conversion de la pyridoxine en pyridoxal phosphate par une enzyme érythrocytaire chez des sujets alcooliques. Ceci conduit à postuler une suppression directe de la pyridoxine phosphorylase érythrocytaire par l’alcool. Cependant, une autre explication de la diminution du phosphate de pyridoxal suggère que l’acétaldéhyde, le principal métabolite de l’alcool, stimule l’activité de la phosphatase membranaire et réduit également la quantité de phosphate de pyridoxal transférée du globule rouge au compartiment plasmatique.
Cependant, quel que soit le mécanisme, le résultat est le même, tous conduisant à une augmentation de la quantité de Fe contenue dans les érythroblastes (sidéroblastes)
La sidéroblastose implique une mauvaise incorporation du fer dans le globule rouge, ce qui entraîne une hypochromie, une érythropoïèse inefficace et une sidérose accrue.
Hémosidérose chez les alcooliques(remplacer par 5) Une grande variété de causes de surcharge en fer chez les alcooliques a été impliquée seule ou collectivement, y compris l’augmentation significative du fer de certaines boissons alcoolisées(surtout les vins), une augmentation de la sécrétion d’acide chlorhydrique gastrique induite par l’éthanol, une hémolyse, une perte de sang gastro-intestinale, une carence en acide folique, une augmentation de l’absorption intestinale due à des lésions hépatiques, et des lésions pancréatiques, augmentant encore la sidération et entraînant une hémosidérose.
Plusieurs études documentent une augmentation des taux de ferritine sérique chez les patients alcooliques, reflétant une augmentation des réserves en fer.
Après administration de chélateurs du fer tels que la desferroxamine et mesure ultérieure de la sidérurgie, les réserves en fer peuvent être évaluées de manière semi-quantitative. Chez les alcooliques, l’excrétion de fer après ces chélateurs est également augmentée par rapport aux témoins.
Par contre, d’autres études montrent chez les patients alcooliques hospitalisés que les concentrations sériques de fer et/ou de ferritine sont toutes deux dans les limites de la normale ou plus rarement élevées. Ces différences peuvent être dues au choix des patients inclus dans l’étude ; si les patients ont des saignements gastro-intestinaux dus à des varices œsophagiennes, ils peuvent avoir des réserves en fer épuisées, même si avant les saignements elles étaient supérieures à la normale.
Enfin, il faut noter que dans la plupart des études réalisées pour mesurer le fer sérique, ceux-ci se sont toujours révélés élevés chez les alcooliques, avec une corrélation entre les dépôts de fer et la quantité d’alcool consommée, ce qui suggère que cet élément est la cause de la sidérose.
Absorption du fer
Environ 5 à 15 mg de fer ingéré quotidiennement, seuls 10% sont absorbés.
Les facteurs influençant l’absorption du fer peuvent intervenir à trois niveaux : intraluminal, muqueux et général.
Au niveau intraluminal, on sait que l’absorption du fer dépend de l’interaction de différents aliments, de sorte que certains, comme les acides aminés, facilitent l’absorption et d’autres peuvent la diminuer. L’absence de sécrétions digestives peut être un facteur modifiant l’absorption.
Pour tenter d’expliquer l’hémosidérose, on a d’abord pensé que l’alimentation des malades alcooliques était très riche en cet élément. Cette observation était basée sur ce que l’on appelle l’hémosidérose des bantous ou l’hémosidérite des bantous. Des études menées par des Sud-Africains sur ces tribus ont révélé qu’une boisson qu’ils préparaient, appelée kéfir, une sorte de bière, était brassée dans des récipients en fer, avec une teneur en fer de 30 à 100 mg par litre. La teneur en alcool de la boisson était très faible, et ils en consommaient de grandes quantités, jusqu’à 1000 mg de fer par jour. La fabrication du kéfir n’est plus pratiquée avec pour conséquence la disparition de l’hémosidérose dans cette tribu.
Les quantités de fer présentes dans les différentes boissons alcoolisées sont très variables, atteignant dans certains cas jusqu’à 350 mg par litre (Roumanie), bien qu’en général on puisse considérer que le vin (blanc, bordeaux ou rouge) est riche en ce métal.
Mais il existe aussi de nombreux alcooliques dont la boisson principale n’est pas le vin mais le whisky, la bière ou autres, qui contiennent des quantités négligeables de fer.
D’autre part, malgré l’étude sur les bantous, un excès de fer dans l’alimentation n’est pas une raison suffisante pour développer une hémosidérose. Ainsi, en Éthiopie, la base de l’alimentation est le teff, une graine qui contient une grande quantité de fer, avec un apport quotidien de 300 à 500 mg de ce métal. Malgré cet apport, les dépôts ne sont pas augmentés et la fréquence de l’anémie ferriprive n’est pas différente de celle de la population générale.
Il est donc évident que la quantité de fer contenue dans les aliments n’a aucune valeur.
A ce jour, il semblerait que l’alcool ne joue aucun rôle au niveau intraluminal dans l’absorption du fer.
Au niveau général, on sait que l’état des réserves de fer va conditionner leur absorption ; si elles sont diminuées, l’absorption augmente et inversement. L’érythropoïèse intervient également à ce niveau, en augmentant son absorption lorsqu’elle augmente. L’alcool ne semble pas accélérer le turn over du fer plasmatique, ce qui pourrait expliquer l’augmentation de son absorption.
Au niveau des muqueuses, la quantité de fer contenue dans la muqueuse, ainsi que le niveau de synthèse des protéines, peuvent influencer l’absorption du fer. Il a été démontré que la carence en acide folique consécutive à l’ingestion d’alcool peut être responsable d’une augmentation de l’absorption du fer et de la sidérose qui s’ensuit, ce qui aggrave les effets néfastes de l’alcool sur le parenchyme et plus particulièrement sur le foie.
Dans des études animales, il a été démontré que l’administration chronique d’alcool peut s’accompagner d’une augmentation de l’absorption intestinale du fer, dont le mécanisme est inconnu.
Au moins trois mécanismes impliqués dans la translocation du fer à travers la muqueuse duodénale ont été démontrés au cours de la dernière décennie :
Médiée par un transporteur(régulé)
Mécanisme passif médié par des acides gras non estérifiés
(non régulé) entrée paracellulaire
Des études in vivo et in vitro ont montré une augmentation de la perméabilité intestinale chez les alcooliques chroniques offrant un mécanisme possible pour l’absorption intestinale du fer.
D’autres études suggèrent qu’il pourrait y avoir une augmentation de la capacité intrinsèque de la muqueuse intestinale des patients alcooliques à absorber le fer.
Il a été observé que chez ceux qui avaient une augmentation du fer sérique, les mesures du fer diminuaient au cours de la première semaine d’hospitalisation avec le développement des réticulocytes. Il a également été observé que les changements sidéroblastiques étaient réversibles, en accord avec d’autres auteurs. Les anneaux caractéristiques ont disparu de la moelle au cours de la première semaine d’hospitalisation, bien que certains aient persisté pendant douze jours.
Récemment(remplacer par 6), des taux sériques accrus d’asialotransferrine ont été trouvés chez des patients souffrant d’alcoolisme chronique ; cela montre une capacité accrue à libérer le fer dans les tissus, en particulier les hépatocytes, par rapport aux variantes normales de la transferrine.
Il a été souligné qu’il peut également y avoir une forte relation entre les changements sidéroblastiques et les carences en folates. Il est suggéré que cette carence pourrait être la condition préalable nécessaire à l’expression des changements sidéroblastiques chez les alcooliques, bien que d’autres auteurs ne soient pas d’accord, car malgré une anémie marquée, ils ne présentaient pas de changements mégaloblastiques dans la moelle, ni de macrocytose ou d’hypersegmentation neutrophile dans le sang périphérique et les concentrations de folates sériques et érythrocytaires étaient normales.
Il est important de noter que chez les patients alcooliques, l’anémie des maladies chroniques dues à la tuberculose, aux maladies malignes ou à l’insuffisance rénale est souvent associée à une anémie sidéroblastique, très fréquente dans cette population.
En résumé, la consommation d’alcool associée à un régime alimentaire inadéquat est susceptible d’entraîner le développement d’une anémie sidéroblastique et d’une hémosidérose dont la pathogénie n’est pas encore établie et dont les facteurs probables comprennent :
Effet toxique de l’alcool sur une ou plusieurs étapes de la synthèse de l’hème.
Association avec un mauvais état nutritionnel entraînant une déplétion en phosphate de pyridoxal et un catabolisme accéléré causé par l’acétaldéhyde, une maladie du foie ou les deux
Exacerbation de la carence en folate et où le retrait et le remplacement nutritionnel jouent un rôle majeur.
Cas clinique:
Un homme de 55 ans a été admis pour un œdème des membres inférieurs (1/6 suprapatellaire, 2/6 infrapatellaire) et du sacrum de consistance molle, une distension abdominale, une pâleur cutanée des muqueuses, une asthénie et une adynamie progressive depuis trois mois.
Histoire:
Alcoolisme chronique (2 ou 3 litres de vin et/ou de bière par jour) et tabagisme (40 cigarettes par jour), tous deux depuis 30 ans.
Résultats des examens effectués dans le service:
Radiographie pulmonaire : effacement du sinus costodiaphragmatique droit. Index cardiothoracique légèrement augmenté.
Paracentèse : caractéristiques exsudatives.
Transfusions : En raison de l’HTO. transfusion de 2 unités de globules rouges déplasmés indiquée.
Diagnostic présomptif :
Etiologique : éthylisme chronique. Tabagisme.
Pathophysiologique : syndrome ascitico-œdémateux. Syndrome ascitico-œdémateux. Tache ascitique-œdémateuse. Anémique. Epanchement pleural. Insuffisance hépatique.
Anatomopathologique : Hépatomégalie. Cardiomégalie.
Résultats des examens réalisés au cours de l’hospitalisation :
FEDA : gastrite chronique.
Double contraste lavement colon : transit intestinal préservé.
Echocardiogramme : Epanchement péricardique modéré.
Echopleural : épanchement pleural droit.
Echoabdominal : foie compatible avec une stéatose hépatique.
Sérologie : négatif pour VDRL, Chagas, hépatite B et C.
PAMO et BMO : moelle osseuse avec dyspoïèse sévère de la série rouge.
Perls : on observe une augmentation des granules de fer intra et extracellulaires.
PBH : le matériel obtenu était peu représentatif pour conclure au diagnostic.
Laboratoire
Hématocrite (%) : variait de 11.8 à 19
Globules rouges (x10E12/l) : a présenté une variation de 1,1 à 1,94
Globules blancs (x10E9/l):a présenté une variation de 7,7 à 9.2
Hémoglobine (g/dL) : varie de 4,4 à 6.8
Plaquettes (x10E9/l) : varie de102 à 346
Ferrimie (mg/dl) : varie de248 à 75
Ferritine ( ng/dl) : 594
TIBC (capacité totale de fixation du fer) (mg/dl) : 360
Pourcentage de saturation de la transferrine : a présenté une variation de 95 à 24
Bilirubine totale (mg/dl) : a présenté une variation de 1.6 à 0,51
Bilirubine directe (mg/dl) : a montré une variation de 1,92 à 0,18
Bilirubine indirecte (mg/dl) : a montré une variation de 2,99 à 0,33
Traitement médical :
Hyposodium et régime hypoprotéique. Restriction d’eau.
PHP à 21 gouttes par minute en alternance. Albumine : un flacon en parallèle toutes les 8 heures, suivi d’une ampoule de furosémide. Spironolactone : un comprimé toutes les 12 heures. Phytoménadione (Konakion) une ampoule toutes les 12 heures.
Lactulose (Lactulon) une cuillère à soupe toutes les 6 heures. Complexe de vitamine B un comprimé toutes les 12 heures.
En raison de la bonne réponse du patient, le traitement médical oral avec diurétiques et complexe B est poursuivi. Le lactulose et la phytoménadione ont été arrêtés.
Le patient a présenté une évolution clinique favorable pour son état oedémateux ascitique, raison pour laquelle il est sorti de l’hôpital, étant médicamenté avec de la vitamine B et conseillé de ne pas boire d’alcool.
Continuant son contrôle médical par les consultations externes de la Clinique Médicale de notre Hôpital et par le Service d’Hématologie de l’Hôpital Álvarez..
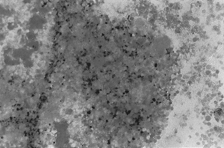
PAMO X 100
– Coloration de Perls. On remarque une masse médullaire avec un intense dépôt de fer extracellulaire.
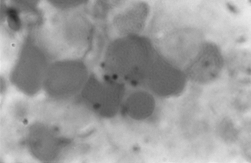
PAMO X 1000
– Coloration de Perls. On observe un dépôt de fer intraérythroblastique.
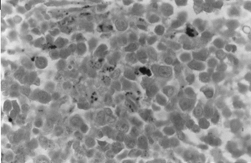
BMOX100
– Coloration de Perls. Où l’on observe des accumulations denses de fer intra- et extra-érythroblastique.
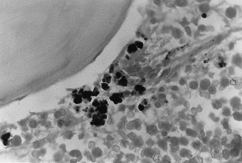
BMO X 1000
– Coloration de Peris. Où l’on observe des accumulations denses de fer intra- et extraitroblastique.
Le patient a eu une bonne évolution post-internat. A soixante jours, il a bénéficié d’une prise de sang dont les résultats sont les suivants : HTO 43%, GR 5,1 X 10E12/L, GB 8,7 X10E9/L, HB 13,9 g/di, Plaq,354 X10E9/L, avec uniquement une observance du traitement.
Après cent vingt jours, il a été à nouveau surveillé avec les mêmes résultats de prise de sang.
Après cent vingt jours, il a été à nouveau surveillé avec les mêmes résultats de prise de sang.
Après cent vingt jours, il a été à nouveau surveillé avec les mêmes résultats de prise de sang.