Un adduit (du latin adductus, « tiré vers » alternativement, contraction de « produit d’addition ») est un produit d’une addition directe de deux ou plusieurs molécules distinctes, résultant en un seul produit de réaction contenant tous les atomes de tous les composants. Le produit résultant est considéré comme une espèce moléculaire distincte. Par exemple, l’addition de bisulfite de sodium à un aldéhyde pour donner un sulfonate. Il peut juste être considéré comme un produit unique résultant de la combinaison directe de différentes molécules qui comprend tous les atomes des molécules réactives.
Les adduits se forment souvent entre les acides et les bases de Lewis. Un bon exemple est la formation d’adduits entre l’acide de Lewis borane et l’atome d’oxygène dans les bases de Lewis, le tétrahydrofurane (THF) : BH3-O(CH2)4 ou l’éther diéthylique : BH3-O(CH3CH2)2. De nombreux acides et bases de Lewis réagissant en phase gazeuse ou dans des solvants non aqueux pour former des adduits ont été examinés dans le modèle ECW. Le triméthylbore, le chlorure de triméthylétain et le bis(hexafluoroacétylacétonato)cuivre(II) sont des exemples d’acides de Lewis qui forment des adduits présentant des effets stériques. Par exemple : le chlorure de triméthylétain, lorsqu’il réagit avec l’éther diéthylique, présente une répulsion stérique entre les groupes méthyle sur le Sn et les groupes éthyle sur l’oxygène. Mais lorsque la base de Lewis est le tétrahydrofurane, la répulsion stérique est réduite. Le modèle ECW peut fournir une mesure de ces effets stériques.
-
.
Molécule de THF
-
Molécule de HB3
.
-
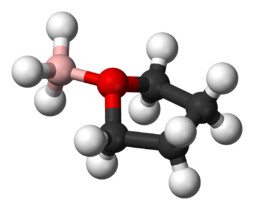
Adduct de Lewis entre BH3 et THF
Les composés ou les mélanges qui ne peuvent pas former un adduit en raison d’un empêchement stérique sont appelés paires de Lewis frustrées.
Les adduits ne sont pas nécessairement de nature moléculaire. Un bon exemple tiré de la chimie de l’état solide est celui des adduits de l’éthylène ou du monoxyde de carbone sur CuAlCl4. Ce dernier est un solide avec une structure de réseau étendu. Lors de la formation de l’adduit, une nouvelle phase étendue se forme dans laquelle les molécules de gaz sont incorporées (insérées) comme ligands des atomes de cuivre au sein de la structure. Cette réaction peut également être considérée comme une réaction entre une base et un acide de Lewis, l’atome de cuivre jouant le rôle de récepteur d’électrons et les électrons pi de la molécule de gaz jouant le rôle de donneur d’électrons.


