Le principe le plus général régissant la force des acides peut être énoncé ainsi : les acides forts ont des bases conjuguées relativement stables. En général, plus la base conjuguée est stable, plus l’acide est fort. Une chose importante à retenir est que la stabilité et la réactivité sont inverses. Plus une substance est stable, moins elle est réactive, et vice versa. Par conséquent, une autre façon d’énoncer la règle ci-dessus est de dire que les acides forts ont des bases conjuguées faibles. HCl et H3O+ sont des acides forts. Par conséquent, les bases conjuguées correspondantes, Cl- et H2O, sont faibles (très stables). L’ion chlorure est stable car la charge négative réside sur un atome très électronégatif. La molécule d’eau est l’une des substances les plus stables connues.
Comment savoir quel proton est le plus acide dans une molécule (comme l’acide acétique) qui contient plus d’un type de proton ? Rappelez-vous que plus le degré de caractère positif du proton est élevé, plus il est acide. L’examen d’un tableau de pKa révèle certaines tendances pour les protons acides. Les lignes directrices suivantes peuvent être utilisées pour prédire l’acidité.
1. Les hydrogènes directement attachés à des atomes très électronégatifs comme l’oxygène, le soufre et les halogènes portent un degré d’acidité substantiel.
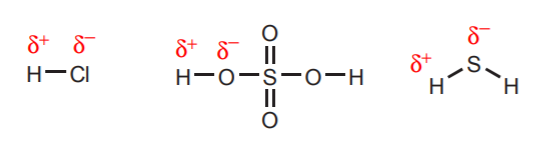
2. Les hydrogènes attachés à un azote, un oxygène ou un soufre chargés positivement sont acides. L’électronégativité élevée de ces atomes les rend mal à l’aise avec la charge positive. Ils cherchent à diffuser la charge parmi les atomes voisins en retirant la densité électronique de ces derniers. On peut le montrer en dessinant des structures de résonance comme indiqué.
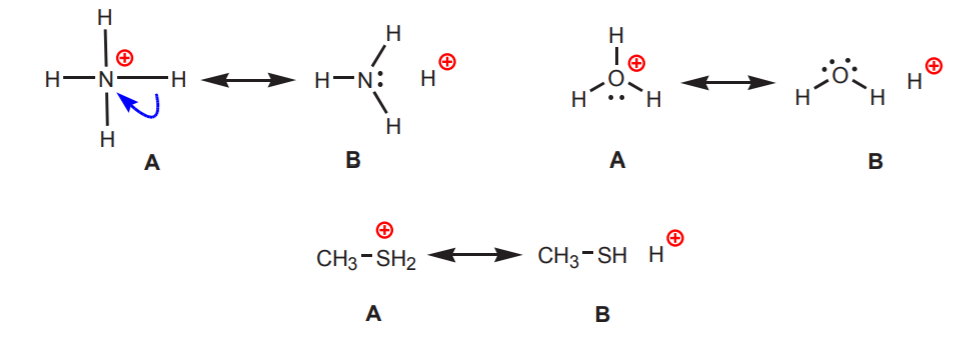
Dans tous les cas, la structure B révèle le caractère positif de l’hydrogène, et donc sa nature acide.
3. Comme le montrent les valeurs de pKa des alcanes et des alcènes, les hydrogènes attachés au carbone ont une acidité très faible. Ces substances ne sont normalement pas du tout considérées comme des acides. Cependant, certains hydrocarbures peuvent être faiblement acides si leurs bases conjuguées sont des ions stables. Cela peut se produire dans les cas suivants.
a) Il y a un ou plusieurs atomes électronégatifs près du proton considéré. L’effet inductif de ces atomes électronégatifs laisse les hydrogènes du voisinage privés de densité électronique, et donc avec un caractère positif partiel.
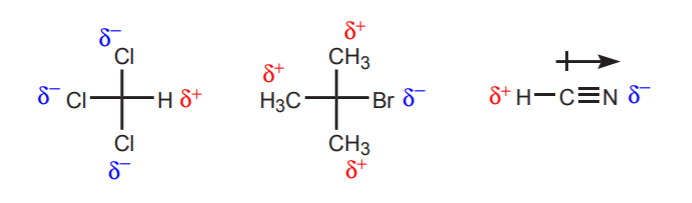
b) Un atome d’hydrogène lié à un carbone qui est à son tour lié à un autre carbone qui porte une charge positive partielle ou totale est acide.
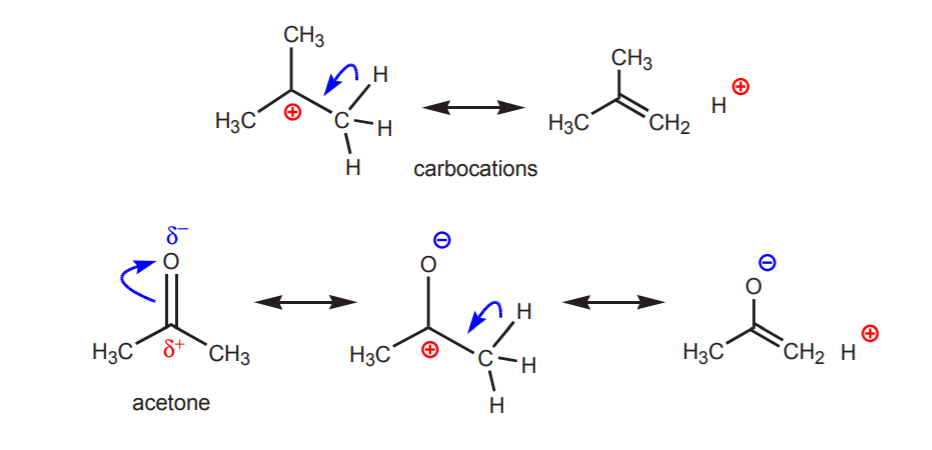
L’acidité des protons présentés devient apparente dans les réactions d’élimination (chapitre 6) et dans la chimie des énols (chapitre 22), lorsque la présence d’une base conduit à la formation d’alcènes ou d’ions énolates par une étape impliquant un transfert de proton.
c) La base conjuguée est stabilisée par résonance. Cet effet est plus important lorsqu’il y a un autre facteur renforçant l’acidité, comme la présence d’un dipôle ou d’un atome électronégatif (comme dans le groupe fonctionnel nitrile, -CN). Sinon, la stabilisation par résonance seule ne suffit pas à augmenter considérablement l’acidité d’un hydrogène attaché au carbone (comme dans le toluène, où le pKa n’est que de 40).
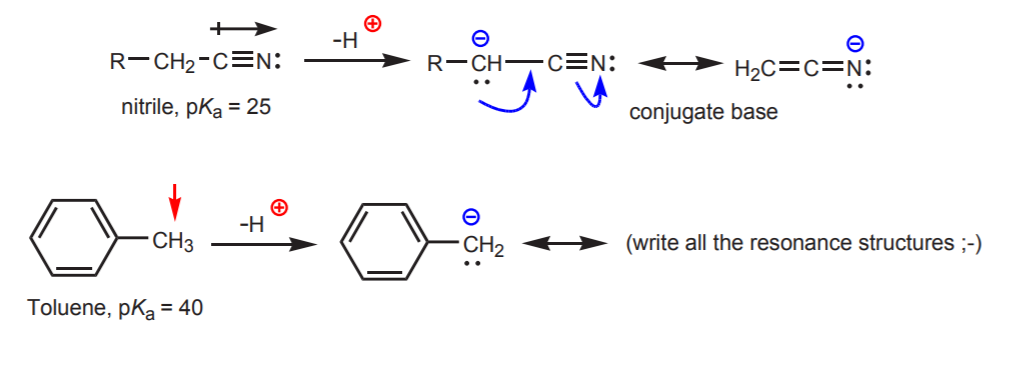
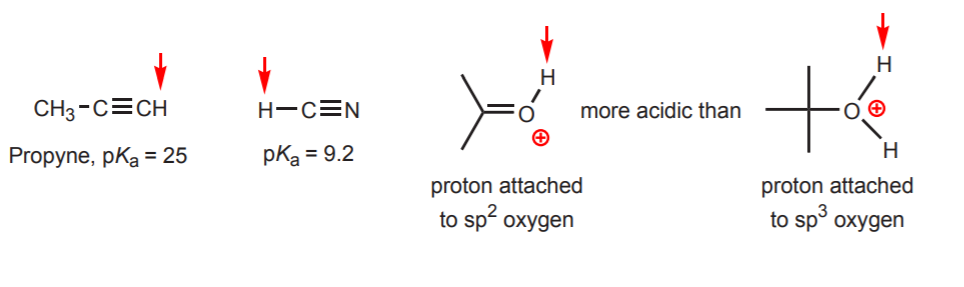
d) L’hydrogène est attaché à un carbone hybridé sp. Les effets de l’hybridation sur l’acidité sont discutés dans le chapitre 9. Les tendances de l’hybridation peuvent être étendues à l’oxygène et à l’azote en plus du carbone, comme dans l’exemple de droite.
.