Kemiallinen alkuaine vety luokitellaan ei-metalliin. Se voi muuttua metalliseksi hyvin korkeissa paineissa. Henry Cavendish löysi sen vuonna 1766.

Tietovyöhyke
| Luokitus | Vety on epämetalli. Se voi muuttua metalliseksi hyvin korkeissa paineissa. |
| Väri | väritön |
| Atomipaino | 1.0079 |
| Tila | kaasu |
| Sulamispiste | -259.14 oC, 14.01 K |
| Kiehumispiste | -252.87 oC, 20.28 K |
| Elektronit: | 1 |
| Protonit: | 1 |
| Neutronit runsaslukuisimmassa isotoopissa: | 0 |
| Elektronikuoret | 1 |
| Elektronikonfiguraatio | 1s1 |
| Tiheys @ 20oC | 0.0000899 g/cm3 |
Näytä lisää, mm: Lämmöt, energiat, hapettuminen,
reaktiot, yhdisteet, säteet, johtavuudet
| Atomin tilavuus | 14.4 cm3/mol |
| Rakenne | hcp: heksagonaalinen tiiviisti pakattu (kiinteänä matalissa lämpötiloissa) |
| Kovuus | – |
| Ominaislämpökapasiteetti | 14.304 J g-1 K-1 |
| Sulamislämpö | 0,117 kJ mol-1 H2 |
| Höyrystymislämpö | 218 kJ mol-1 |
| Höyrystymislämpö | 0.904 kJ mol-1 H2 |
| 1. ionisaatioenergia | 1312 kJ mol-1 |
| 2. ionisaatioenergia | kJ mol-1 |
| 3. ionisaatioenergia | 11815.0 kJ mol-1 |
| Elektronien affiniteetti | 72.7711 kJ mol-1 |
| Minimi hapetusluku | -1 |
| Min. yleinen hapetusluku | -1 |
| Maksimi hapetusluku | 1 |
| Maks. yleinen hapetusluku. | 1 |
| Elektronegatiivisuus (Paulingin asteikko) | 2.18 |
| Polarisoituvuuden määrä | 0.7 Å3 |
| Reaktio ilman kanssa | voimakas, ⇒ H2O |
| Reaktio 15 M HNO3:n kanssa | ei mitään |
| Reaktio 6 M HCl:n kanssa | ei mitään |
| Reaktio 6 M NaOH:n kanssa | ei ole |
| Oksidi(t) | H2O |
| Hydridi(t) | H2 |
| Kloridi(s) | HCl |
| Atomisäde | 25 pm |
| Ionisäde (1+-ioni) | – – |
| Ionisäde (2+-ioni) | – |
| Ionisäde (3+-ioni) | – |
| Ionisäde (1- ioni) | – |
| Ionisäde (2-ioni) | – |
| Ionisäde (3-ioni) | – |
| Lämmönjohtavuus | 0.1805 W m-1 K-1 |
| Sähkönjohtavuus | – |
| Jäätymis-/sulamispiste: | -259.14 oC, 14.01 K |

Nasa kuva: Valtavat määrät vetyä kaukaisissa galakseissa.

Theophrastus Paracelsus – Ensimmäinen vetyä synnyttänyt ihminen: ”Ilma syntyy ja puhkeaa kuin tuuli.”
Vedyn löytäminen
Koulun suosikkikemian koe on lisätä happoon metallia, kuten magnesiumia. Metalli reagoi hapon kanssa muodostaen suolan ja vapauttaa haposta vetyä. Vetykaasu kuplii ylös nesteestä, ja oppilaat keräävät sitä pieniä määriä myöhempiä kokeita, kuten ”pop-testiä” varten.
Ensimmäinen kirjattu tapaus, jossa vetyä on tuotettu ihmisen toimesta, tapahtui 1500-luvun alkupuoliskolla samankaltaisella menetelmällä kuin kouluissa nykyään käytetään.Lääkäri Theophrastus Paracelsus liuotti rautaa rikkihappoon ja havainnollisti kaasun vapautumisen. Hänen kerrotaan sanoneen kokeesta: ”Ilma syntyy ja puhkeaa kuin tuuli”. Hän ei kuitenkaan havainnut mitään vedyn ominaisuuksista.(1)
Turquet De Mayerne toisti Paracelsuksen kokeen vuonna 1650 ja havaitsi, että kaasu oli syttyvää.(2) Paracelsus eikä De Mayerne ehdottaneet, että vety voisi olla uusi alkuaine. Paracelsus uskoi, että oli olemassa vain kolme alkuainetta – tria prima – suola, rikki ja elohopea – ja että kaikki muut aineet koostuivat näiden kolmen erilaisista yhdistelmistä. (3) (Kemialla oli vielä pitkä matka edessään!)
Vuonna 1670 englantilainen tiedemies Robert Boyle lisäsi rautaa rikkihappoon. Hän osoitti, että syntynyt (vety)kaasu paloi vain, jos läsnä oli ilmaa, ja että osa ilmasta (kutsuisimme sitä nykyään hapeksi) kului palamisessa.(4)
Vety tunnistettiin erilliseksi alkuaineeksi ensimmäisen kerran vuonna 1766 englantilaisen tiedemiehen Henry Cavendishin toimesta, kun hän valmisti sitä reagoimalla suolahappoa sinkin kanssa. Hän kuvasi vetyä ”metalleista peräisin olevaksi syttyväksi ilmaksi” ja totesi, että se oli samaa ainetta (reaktioidensa ja tiheytensä perusteella) riippumatta siitä, mitä metallia ja mitä happoa hän käytti sen tuottamiseen.(1) Cavendish havaitsi myös, että kun ainetta poltettiin, se tuotti vettä.
Ranskalainen tiedemies Antoine Lavoisier nimesi alkuaineen myöhemmin vedyksi (1783). Nimi tulee kreikan sanoista ”hydro”, joka tarkoittaa vettä, ja ”genes”, joka tarkoittaa muodostumista – vety on toinen kahdesta vettä muodostavasta alkuaineesta.
Vuonna 1806, kun vety oli vakiintunut alkuaineeksi, englantilainen kemisti Humphry Davy työnsi voimakkaan sähkövirran puhdistetun veden läpi.
Hän havaitsi vetyä ja happea muodostuvan. Koe osoitti, että sähkö voi vetää aineet erilleen alkuaineisiinsa. Davy tajusi, että aineita sitoi toisiinsa sähköinen ilmiö; hän oli havainnut kemiallisen sidoksen todellisen luonteen. 5.
Käy Chemicoolin Cool Hydrogen Facts -sivulla.

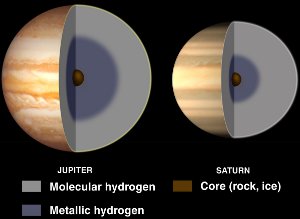
Jupiterin ja Saturnuksen sisätilat, joissa on nestemäistä metallivetyä. Courtesy NASA/JPL-Caltech.

Nasa: Avaruussukkulan ulkoinen polttoainesäiliö (oranssi), joka on täytetty nestemäisellä vedyllä ja hapella.

Vetyautot päästävät vettä saasteiden sijaan.

Veden elektrolyysi laboratoriossa. Sähköenergiaa käytetään veden jakamiseen. Vety kerääntyy yhteen koeputkeen, happi toiseen.
Eritys ja ominaisuudet
Haitalliset vaikutukset:
Vety on erittäin helposti syttyvää ja sillä on lähes näkymätön liekki, joka voi aiheuttaa vahingossa palovammoja.
Ominaisuudet:
Vety on kaikista alkuaineista yksinkertaisin ja kevyin. Se on myös ylivoimaisesti yleisin alkuaine maailmankaikkeudessa. Yli 90 prosenttia maailmankaikkeuden atomeista on vetyä.
Tavallisimmassa muodossaan vetyatomi koostuu yhdestä protonista, yhdestä elektronista ja yhdestä neutronista. Vety on ainoa alkuaine, joka voi olla olemassa ilman neutroneita.
Vety on väritön ja hajuton kaasu, joka esiintyy vakiolämpötilassa ja -paineessa kaksiatomisina molekyyleinä, H2.
Vety palaa ja muodostaa räjähdysherkkiä seoksia ilmassa, ja se reagoi rajusti hapettimien kanssa.
Maapallolla vetyä esiintyy pääasiassa vedessä, H2O:ssa. Maassa on vähän vapaata vetyä, koska vety on niin kevyttä, ettei planeetan painovoima pidättele sitä. Kaikki muodostuva vety karkaa lopulta ilmakehästä avaruuteen.
Vaikka vety on tavallisesti epämetalli, se muuttuu nestemäiseksi metalliksi, kun siihen kohdistuu valtavia paineita.
Tällaisia paineita on kaasujättiläisplaneetoilla, kuten Jupiterissa ja Saturnuksessa. Jupiterin suuren magneettikentän (14-kertainen Maan magneettikenttään verrattuna) uskotaan johtuvan dynamiovaikutuksesta, joka johtuu sähköä johtavasta metallisesta vedystä, joka kiertää planeetan pyöriessä.
Vedyn käyttökohteet
Suuria määriä vetyä käytetään Haberin prosessissa (ammoniakin valmistuksessa), rasvojen ja öljyjen vetykäsittelyssä, metanolin valmistuksessa, vedyn hiilihydraattisessa krakkauksessa ja vedyn rikinpoistossa. Vetyä käytetään myös metallien jalostuksessa.
Nestemäistä vetyä käytetään rakettipolttoaineena, esimerkiksi avaruussukkulan lentoonlähtöön ja kiertoradalle nousuun. Nestemäistä vetyä ja happea säilytetään sukkulan suuressa, ulkoisessa polttoainesäiliössä. (Katso kuva vasemmalla.)
Vedyn kahta raskaampaa isotooppia (deuterium ja tritium) käytetään ydinfuusiossa.
Vetytaloutta on ehdotettu korvaamaan nykyinen hiilivetyyn (öljyyn, kaasuun ja hiileen) perustuva taloutemme.
Vetytalouden perustana on se, että energiaa syntyy, kun vety palaa hapen kanssa ja ainoa reaktion sivutuote on vesi.
Tällä hetkellä vetyautojen vetyä tuotetaan kuitenkin hiilivedyistä. Vasta kun esimerkiksi aurinko- tai tuulienergiaa voidaan käyttää kaupallisesti veden jakamiseen vedyksi ja hapeksi, todellinen vetytalous on mahdollista.
Runsaus ja isotoopit
Runsaus maankuori: 1400 miljoonasosaa painosta (0,14 %), 2,9 % mooleista
Runsaus aurinkokunta: 75 % painosta, 93 % mooleista
Kustannus, puhdas: 12 dollaria/100g
Kustannus, irtotavarana: 100 dollaria/100g
Lähde: Vetyä valmistetaan kaupallisesti reagoimalla ylikuumennetun höyryn ja metaanin tai hiilen kanssa. Laboratoriossa vetyä voidaan tuottaa happojen vaikutuksesta metalleihin, kuten sinkkiin tai magnesiumiin, tai veden elektrolyysillä (kuvassa vasemmalla).
Isotoopit: Vedyllä on kolme isotooppia, 1H (protium), 2H (deuterium) ja 3H (tritium). Sen kahta raskaampaa isotooppia (deuterium ja tritium) käytetään ydinfuusiossa. Protium on runsain isotooppi ja tritium vähiten esiintyvä. Tritium on epävakaa, ja sen puoliintumisaika on noin 12 vuotta 4 kuukautta. Luonnossa esiintyvä vety on kahden isotoopin, 1H:n ja 2H:n, seos, jonka luonnollinen esiintyvyys on 99,99 % ja 0,01 %.

- Peter Hoffmann, Tomorrow’s Energy: Hydrogen, Fuel Cells, and the Prospects for a Cleaner Planet., (2001) s22. MIT Press, Cambridge, MA.
- P. Litherland Teed, The Chemistry and Manufacture of Hydrogen., (2008) s2. Dabney Press.
- John S. Davidson, Annotations to Boyle’s ”The Sceptical Chymist”.
- Andreas Züttel, Andreas Borgschulte, Louis Schlapbach, Hydrogen as a future energy carrier., (2008) s8. Wiley-VCH, Weinheim.
- Kendall Haven, 100 Greatest Science Discoveries of All Time., (2007) s62. Libraries Unlimited.
Cite this Page
Verkkolinkitystä varten kopioi ja liitä jompikumpi seuraavista:
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen</a>
tai
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen Element Facts</a>
Jos haluat siteerata tätä sivua akateemisessa asiakirjassa, käytä seuraavaa MLA-standardin mukaista viittausta:
"Hydrogen." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hydrogen.html>.