TOIMINTA
Amyloidoosi on laskeumasairaus, joka johtuu solunulkoisten fibrillien kertymisestä, joiden lähteenä on rakenteeltaan epävakaita proteiineja, jotka taittuvat, aggregaatoituvat ja laskeutuvat.1 Tällainen laskeuma voi muuttaa kudoksen rakennetta ja heikentää eri elinten ja järjestelmien toimintaa.2
Amyloidifibrillit ovat liukenemattomia ja proteolyysille vastustuskykyisiä, ja ne värjäytyvät tyypillisesti kongopunaisella väriaineella, ja niissä näkyy voimakkaan kellanvihreää kaksoiskatkoa polarisoidussa valossa.3 Yli 30 proteiinia voi aiheuttaa amyloidikerrostumia, mutta vain 5 aiheuttaa merkittäviä kerrostumia sydänkudoksessa1:
- –
Kevytketjut, jotka aiheuttavat primaarisen amyloidoosin (AL).
- –
Transtyretiini (TTR), joka aiheuttaa TTR-amyloidoosin (ATTR).
- –
Apolipoproteiini A.
- –
Fibrinogeeni.
- –
Serumin amyloidi-proteiini A, joka aiheuttaa sekundaarisen amyloidoosin.
Primäärinen amyloidoosi ja ATTR-amyloidoosi ovat yleisimpiä sydänamyloidoosin muotoja, ja AL-muotoa on historiallisesti pidetty tavallisempana kehittyneissä maissa.3
Suuri osa sydänamyloidoosia koskevasta tiedosta on perustunut AL:ään. Vaikka AL-potilaiden määrä on pysynyt vakaana, ATTR-diagnoosien määrä on kuitenkin viime aikoina lisääntynyt, ja nyt ajatellaan, että ATTR saattaa olla paljon yleisempi kuin AL.2
Transtyretiiniamyloidoosi on hyvin usein ollut väärän diagnoosin tai merkittävien viivytysten kohteena, ennen kuin sen oikea diagnoosi on tehty. Syitä ovat muun muassa sen muotojen heterogeenisuus, histologisen varmistuksen tarve, erikoislaitteiden puute ja joidenkin kardiologien virheellinen uskomus siitä, että kyseessä on harvinainen sairaus, jolla ei ole hoitovaihtoehtoja.2,3
Nämä näkökohdat ovat kuitenkin muuttumassa. Diagnoosilla on vaikutuksia potilaan hoitoon. On kehitetty erityisiä hoitomuotoja, jotka voivat viivästyttää tai vakauttaa laskeumaa ja jotka ovat tehokkaampia alkuvaiheessa. Varhainen diagnoosi on siksi ratkaisevan tärkeää. Tässä katsauksessa kuvataan merkittäviä viimeaikaisia edistysaskeleita ATTR:n diagnosoinnissa ja hoidossa, mikä antaa toivoa tätä sairautta sairastaville potilaille.
TRANSTHYRETIININ KARDIALLINEN AMYLOIDOOSI
Transthyretiini on tetrameerinen plasman proteiini, joka vastaa tyroksiinin ja retinoliin sitoutuneen proteiinin kuljetuksesta. Sitä syntetisoidaan ensisijaisesti maksassa ja toissijaisesti suonikalvopleksuksessa ja verkkokalvon pigmenttiepiteelissä.4
Transtyretiinillä on taipumus dissosioitua dimeereiksi ja monomeereiksi, jotka hajoavat fibrilleiksi ja laskeutuvat. Pistemutaatiot tai iän vaikutus voivat lisätä tätä taipumusta, jolloin syntyy ATTR:n kaksi kliinistä muotoa: mutantti (ATTRm) ja villityyppi (ATTRwt).
MUTANTTI TRANSTHYRETIN AMYLOIDOSIS
Tänään tiedetään yli 120 mutaatiota, jotka aiheuttavat ATTRm:n. Näillä mutaatioilla on autosomaalinen dominantti periytymismalli, jonka penetranssi vaihtelee.4 Laajan maantieteellisen monimuotoisuuden vuoksi ATTR:n esiintyvyyttä on vaikea määrittää, mutta sitä pidetään harvinaisena sairautena, jonka esiintyvyys on alle 1/100 000 asukasta2 (taulukko 1).
Mutanttien ja villien sairauksien kliiniset ja diagnostiset pääpiirteet.Tyypin transtyretiini-sydänamyloidoosi
| ATTRwt | ATTRm | |
|---|---|---|
| Esiintyvyys | Tuntematon. Ilmeisesti hyvin yleinen | |
| Geneettinen tutkimus | Mutaatioiden puuttuminen TTR:stä | Mutaatio TTR:stä |
| Tyypillinen ikä ilmaantuessa | > 60 v | Vaihtelee aiheuttajamutaation mukaan |
| Sukupuoli | Miesvaltaisuus. 80 % potilaista | Miesvaltaisuus, aggressiivisempi fenotyyppi |
| Ekstrakardiaaliset ilmenemismuodot | – Karpaalitunneli-oireyhtymä (33-49 %) – Lannerangan selkärangan stenoosi – Traumaattinen hauislihasjänteen repeämä (32 %) |
– Nouseva bilateraalinen sensoris-toiminnallinen polyneuropatia – Dyssätonomia: Ortostaattinen hypotensio, ripuli- ja ummetusoireet, erektiohäiriöt – Silmien osallistuminen: Glaukooma, intravitreaalinen laskeuma, hilseilevät pupillit |
| Sydämen vajaatoiminta | Vakioitu | Vaihtelee aiheuttajamutaation mukaan |
| Sydämen vajaatoiminta | – Sydämen vajaatoiminta (53%-86%) – Johtumishäiriöt – AF (43%-67%) – Degeneratiivinen AoS |
– Johtumishäiriöt – Sydämen vajaatoiminta – Harvinainen AF (10%) |
| Diagnostiset menetelmät | ||
| EKG | – Pseudoinfarkti kuvio (63%-66%) – Alhainen jännite (22%-33%) – Sokolow LVH (6%-13%) |
– Pseudoinfarkti kuvio (18%-69%) – Alhainen jännite (2%-25%) – Sokolow LVH (3%-8%) |
| ECHO | – Kohtalainen-vaikea hypertrofia – Lievä- kohtalainen alentunut LVEF (30%) |
– Kohtalainen hypertrofia – LVEF, tyypillisesti säilynyt |
| Sydämen magneettikuvaus | – Myöhäinen tehostuminen – Kohonnut natiivi T1 ja EV |
|
| 99mTc DPD -skintigrafia | – Luokka 2-3 | – Luokka 0: – Aste 1: sydämen alkuvaiheen osallistuminen – Aste 2-3: |
AF, eteisvärinä; AoS, aortan ahtauma; ATTRm, mutantti transtyretiiniamyloidoosi; ATTRwt, villityyppinen transtyretiiniamyloidoosi; EKG, elektrokardiogrammi; ECO, kaikukardiogrammi; EV, solunulkoinen tilavuus; LVEF, vasemman kammion ejektiofraktio; LVH, vasemman kammion hypertrofia; TTR, transtyretiini.
Ensimmäiset TTR-mutaatiot raportoitiin familiaalisena amyloidipolyneuropationa (tai Andraden tautina), ja näin ollen ATTRm:ää on viime aikoihin asti pidetty neurologisena sairautena. Viimeaikaiset havainnot osoittavat kuitenkin, että yli puolessa tapauksista on sydänsairaus.3
Genotyypin ja fenotyypin välinen korrelaatio on vahva, ja mutaatioihin liittyy puhtaasti neurologinen sairaus tai puhtaasti sydänsairaus.3 ATTRm:n jako sydän- tai neurologiseen tautiin voi kuitenkin olla liiallinen yksinkertaistaminen, sillä tautispektrin kahden kliinisen muodon välillä on huomattavaa päällekkäisyyttä.
Val30Met-mutaatio (tunnetaan nykyisin nimellä Val50Met sen jälkeen, kun ATTRm:n perinteiseen mutaationimeen lisättiin 20 paikkaa) on maailmanlaajuisesti yleisin mutaatio, ja se on endeeminen Portugalissa, Japanissa ja Ruotsissa. Sen arvioitu esiintyvyys Portugalissa on 1 538 asukasta kohti.2 Mallorcaa (Espanja) ja Valverde del Caminoa (Huelva, Espanja) pidetään myös alueina, joilla ATTRm on endeeminen. Arvioitu esiintyvyys Mallorcalla oireilevilla potilailla on 3/100 000 asukasta.5
Val30Met-mutaatio aiheuttaa pääasiassa neurologisen tilan, johon liittyy symmetrinen sensoris-motorinen polyneuropatia, joka alkaa alaraajoista ja noudattaa nousevaa mallia. Siihen voi liittyä dysautonomiaa, johon liittyy ortostaattinen hypotensio, erektiohäiriöitä, virtsainkontinenssia ja ruoansulatuskanavan oireita. Se alkaa tyypillisesti toisen tai kolmannen elinvuosikymmenen lopulla, ja jopa 43 %:lla potilaista on sydänvaurio, joka on yleinen kuolinsyy4 (taulukko 1).
Erityisen merkityksellinen on Val122Ile-mutaatio (p. Val142Ile), jota esiintyy 3 4 %:lla Pohjois-Amerikan mustaihoisesta väestöstä.3 Vaikka sen läpäisevyys on epätäydellinen,3 tämä mutaatio on yhdistetty 47 %:lla suurentuneeseen riskiin sairastua sydämen vajaatoimintaan (HF).6 Äskettäinen tutkimus osoitti, että Val122Ile-amyloidoosi oli neljänneksi yleisin HF:n syy Ison-Britannian afrokaribialaisessa väestössä.7 Vaikka jopa 30 %:lla potilaista, joilla on tämä mutaatio, voi olla lievän neuropatian piirteitä,6 kliininen fenotyyppi on tavallisesti samankaltainen kuin atr-trwt:llä sairastavilla potilailla.4 Val122Ile:aa ei pidä pitää mustan väestön yksinomaisena mutaationa, koska sitä voi esiintyä myös valkoihoisessa väestössä. Olemme esimerkiksi tunnistaneet tämän mutaation neljässä valkoisessa espanjalaisessa perheessä, joissa ei ole mustia sukujuuria.
WILD-TYYPPINEN TRANSTHYRETINAMYLOIDOOSI
Wild-tyyppinen transtyretiiniamyloidoosi kuvattiin ensimmäisen kerran vuonna 1876. Sitä kutsuttiin aiemmin seniiliseksi amyloidoosiksi, mutta sen diagnosointi 40-60-vuotiailla potilailla on tehnyt tämän termin vanhentuneeksi. Mielenkiintoista on, että varhaisin tunnettu tämän mutaation tapaus löydettiin 47-vuotiaalta amerikkalaiselta potilaalta.8
ATTRwt:n tarkka esiintyvyys on edelleen tuntematon. Tutkimukset viittaavat kuitenkin siihen, että se on alidiagnosoitu ja että se saattaa olla sydämen amyloidoosin yleisin muoto.2,3 Seuraavat tulokset tukevat tätä hypoteesia:
- –
Yli 80-vuotiailla potilailla TTR-laskeuman esiintyvyys ruumiinavauksessa on 25 %.3
- –
Potilailla, joilla on HF, jonka ejektiofraktio on säilynyt (HFpEF), keskivaikea ja vaikea TTR-kertymä on 5 % ruumiinavauksessa.9
- –
Yli 60-vuotiailla potilailla, jotka on otettu hoitoon HFpEF:n ja vasemman kammion hypertrofian (LVH) ≥ 12 mm vuoksi, ryhmämme havaitsi hiljattain 13 %:n esiintyvyyden.10
Toisin kuin ATTRm:ssä, ATTRwt:ssä on kyse sporadisesta taudista, joka tyypillisesti puhkeaa 70 ikävuoden jälkeen.4 Sitä esiintyy pääasiassa miehillä, ja julkaistuissa sarjoissa on raportoitu 89-98 prosentin osuuksia.11,12 Ryhmämme havaitsi kuitenkin äskettäin kahdessa sairaalassa (Madridissa, Espanjassa ja Bolognassa, Italiassa) ATTRwt-diagnoosin saaneiden potilaiden sarjassa, että 20 prosenttia oli naisia. Lisäksi muut ruumiinavaustutkimukset ovat viitanneet siihen, että ATTRwt saattaa olla naisilla yleisempi kuin aiemmin on raportoitu. Siksi naissukupuolen ei pitäisi vähentää ATTRwt:n kliinistä epäilyä (taulukko 1).13
Autopsialöydökset osoittavat, että TTR-laskeuma on ATTRwt:ssä hajallaan eri elimissä. Laskeuma on kuitenkin paljon suurempi sydämessä, mikä johtuu TTR:n sydäntrooppisuudesta, ja sydämen osallistuminen on tärkein kliininen oire.4 Potilailla voi esiintyä ekstrakardiaalisen TTR-laskeuman oireita, kuten lannerangan kanavan ahtauma, hauislihasjänteen atraumaattinen repeämä eli ”Popeye-merkki” ja karpaalitunnelioireyhtymä (Carpal Tunnel Syndrome, CTS)3 (kuva 1). Kaikki nämä piirteet voivat auttaa diagnoosin määrittämisessä ja nopeassa toteamisessa. CTS voi liittyä muihin amyloidoosin alatyyppeihin, mutta se on yleisempää ATTRwt:ssä. Laskeuma voi edeltää sydänmanifestaatioita useita vuosia.6 Sitä voidaan käyttää indikaationa iäkkäillä potilailla, joilla on LVH, erityisesti jos heillä on molemminpuolinen CTS, joka ei liity tiettyihin ammatillisiin toimintoihin, ja jos he kuuluvat New York Heart Associationin toiminnalliseen luokkaan ≥ II (julkaisematon tieto).
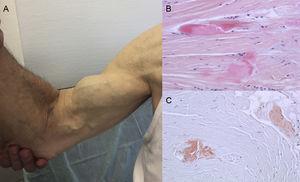
Transtyretiiniamyloidoosin merkit ja oireet. A: oikean hauislihasjänteen ei-traumaattinen repeämä (”Popeye-merkki”). B ja C: hematoksyliini-eosiini- (B) ja kongopunavärjäys (C), molemmat × 200, karpaaliligamenttinäytteestä, jossa näkyy tiheitä kollageeninippuja, joissa on solunulkoista materiaalia. Courtesy of Dr Clara Salas Antón.
DIAGNOSTIIKKA LIIKKUVAN AMYLOIDIININKIINTIINKIININEN ESITYS
Amyloidit voivat infiltroida mitä tahansa sydämen rakennetta.1 Tyypillisesti laskeuma lisää kammion seinämän paksuutta, mikä aiheuttaa distensiivisyyden asteittaista vähenemistä, mikä johtaa vaikeaan diastoliseen toimintahäiriöön. ATTR on siksi perinteisesti luettu restriktiivisen kardiomyopatian syyksi.
AtTR:n kliininen kirjo on kuitenkin paljon laajempi ja heterogeenisempi. ATTR:n yleisin oire on HF. Kuten mainittiin, ryhmämme vuonna 2015 julkaisemassa tutkimuksessa esitettiin, että 99mTc-3,3-difosfono-1,2-propaanidikarboksyylihappoon (99mTc-DPD) perustuva protokolla voi olla hyödyllinen ATTRwt:n diagnosoinnissa merkittävällä osalla (13 %) yli 60-vuotiaista potilaista, jotka otettiin vastaan HFpEF:n vuoksi.10 Tämän tuloksen perusteella 99mTc-DPD-tutkimus sisällytettiin vuonna 2016 laadittuihin eurooppalaisiin HF:tä koskeviin ohjeisiin hyödyllisenä välineenä ATTR:aa sairastavien potilaiden tunnistamisessa.14 ATTR:ää ei kuitenkaan pitäisi epäillä yksinomaan potilailla, joilla on HFpEF, koska amyloidikerrostuman edetessä supistumiskyky heikkenee, ja näin ollen ATTR:ään voi liittyä eriasteisia systolisia toimintahäiriöitä.
Transtyretiiniamyloidoosi on hypertrofisen kardiomyopatian (HCM) fenokopio, ja se voidaan sekoittaa siihen. Tuoreessa ranskalaisessa monikeskustutkimuksessa raportoitiin, että 5 %:lla HCM-potilaista on ATTRm.15 Tuloksemme eivät kuitenkaan vastaa tätä korkeaa osuutta, mikä saattaa liittyä Ranskan suureen mustaihoiseen väestöön.
Sydämen johtumishäiriöt voivat olla ATTR:n ensimmäinen ilmentymä. Sinus- ja eteis-kammiosolmukkeiden1 amyloidi-infiltraatio voi viitata tahdistimen implantoinnin tarpeeseen (taulukko 1). Aiemmin mainitussa Espanjassa ja Italiassa tehdyssä tutkimuksessa todettiin, että johtumishäiriöt olivat ensimmäinen ATTRwt:n ilmenemismuoto 7 prosentilla tätä tautia sairastavista potilaista.13
Kammioperäiset rytmihäiriöt ovat myös hyvin yleisiä ATTRwt:tä sairastavilla potilailla13 (kuva 2A), ja taudin ensimmäinen ilmenemismuoto voi olla aivohalvaus.4 Mayo Clinicin ryhmä ehdottikin hiljattain, että ATTRwt tulisi sulkea pois, jos iäkkäillä potilailla diagnosoidaan ei-valvulaarinen eteisvärinä (AF).8 Sen sijaan AF on paljon harvinaisempi potilailla, joilla on ATTRm (taulukko 1).
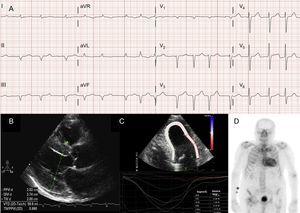

Diagnostiikkatekniikat transtyretiini- sydänamyloidoosissa (ATTR). A: villityyppistä transtyretiiniamyloidoosia (ATTRwt) sairastavan potilaan elektrokardiogrammi, jossa näkyy eteisvärinä ja pseudoinfarktikuvio alemmissa johtimissa. B: Kaikututkimus potilaalta, jolla on Val30Met-mutaatiota sisältävä transthyretiiniamyloidoosi, jossa on merkittävää vasemman kammion keskittynyttä hypertrofiaa ja lievä sydänpussin effuusio. C: ATTRwt-potilaan pituussuuntainen alueellinen rasitus, jossa näkyy säilyneitä arvoja apikaalisegmentissä ja alentuneita arvoja tyvi- ja keskikammiosegmenteissä. D, 99mTc-DPD (99mTc-3,3-difosfono-1,2-propaanidikarboksyylihappo) -skannaus ATTRwt-potilaalta, jossa näkyy biventrikulaarinen uptake, joka on parempi kuin luun uptake, mikä vastaa Perugini-luokkaa 3.
Viimeiseksi toteamme, että ATTR-tauti ja degeneratiivinen aorttaläpän ahtauma (aorttaläpän ahtauma) voivat esiintyä samanaikaisina samoilla potilailla. Vuonna 2016 useat tutkimukset kiinnittivät huomiota tähän mahdollisuuteen, ja eräässä prospektiivisessa tutkimuksessa raportoitiin, että ATTRwt:n esiintyvyys oli 6 % yli 65-vuotiailla potilailla, joille tehtiin aorttaläpän vaihto.16 17 Vaikeaa aorttastenoosia ja ATTRwt:tä sairastavilla potilailla on sama demografinen profiili, ja molempia sairauksia sairastavien potilaiden asianmukainen hoito on vielä määrittelemättä.
Diagnostiikkamenetelmien käyttökelpoisuus
ATTR:n diagnosointi on haaste päivittäisessä kliinisessä käytännössä. Vaikka elektrokardiografialla ja kaikukardiografialla on merkitystä diagnosoinnissa, uudet ei-invasiiviset tekniikat ovat saaneet keskeisen aseman ATTR-potilaiden arvioinnissa.
Elektrokardiogrammi
Matalajännitteen ja sydämen amyloidoosin välistä yhteyttä on pidetty pitkään kiistattomana.3 Kliinisessä käytännössä yleisimmin käytetyt kriteerit ovat QRS-amplitudi 1 Vaikka matalan elektrokardiografisen jännitteen pitäisi LVH:n yhteydessä herättää epäilys, esiintyvyys nykyaikaisessa ATTR-sarjassa oli vain 20-25 %.3,4,13 Esiintyvyys vaihtelee myös käytettyjen kriteerien mukaan. Esimerkiksi Sokolowin kriteerin (S-aalto johtimessa V1 + R-aalto johtimessa V5 tai V6
1,5 mV) käyttö voi nostaa laskennallisen esiintyvyyden 46-58 %:iin.13 Vasemman kammion seinämän paksuuden suhdetta QRS-jännitteen kokonaismäärään on suositeltu, jotta voidaan paremmin arvioida kahden tekniikan tulosten välisiä eroja.2,3,3 Kuitenkin jopa 20 % ATTR-potilaista voi täyttää LVH:n elektrokardiografiset kriteerit.2,3
Useimmissa sydänamyloidoosia sairastavien potilaiden sarjoissa pseudoinfarktikuvio on yleisin elektrokardiografinen löydös2,3,13 (kuva 2A). Mahdollisen johtumisjärjestelmän osallistumisen vuoksi myös täydelliset tai epätäydelliset kimppuhaaralohkot ovat yleisiä.3
Ekokardiografia
Vaikka kaikukardiografia on ATTR:n alkuperäisen diagnoosin kulmakivi, mikään löydös ei ole spesifinen.3 Transtyretiiniamyloidoosiin on tyypillisesti liittynyt normaali tai pieni vasen kammio, jossa on konsentrinen hypertrofia.3 Vuonna 2004 pidetyssä 10. kansainvälisessä amyloidi- ja amyloidoosisymposiumissa vahvistettiin AL:n aiheuttaman sydänsairauden echokardiografiseksi kriteeriksi muiden LVH:n syiden puuttuessa LVH:n esiintyminen ja kammioväliseinän seinämäpaksuuden raja-arvoksi 12 mm.4 Tämä kriteeri ekstrapoloitiin myöhemmin muihin amyloidoosin muotoihin (kuva 2B), ja se antoi korkean spesifisyyden mutta alhaisen herkkyyden.
Vaikka konsentrinen LVH on klassisesti kuvattu, nykyiset sarjat viittaavat siihen, että noin 20 %:lla on epäsymmetristä LVH:ta.13
Klassisesta assosiaatiosta huolimatta, joka liittyy normaaliin tai lievästi alentuneeseen vasemman kammion ulostyöntymiskykyyn (LVEF, left ventricular ejection fraction) ja sydänamyloidoosiin,2 LVEF:n vaihteluväli vaihtelee suuresti.8 Mayo Clinicissä hiljattain tehdyssä tutkimuksessa LVEF 8, kun taas meidän sarjassamme LVEF 13 Lisäksi LVEF:n käyttö systolisen toiminnan arvioinnissa sydänamyloidoosissa on rajoitettua, koska lievästi alentuneet arvot viittaavat jo merkitykselliseen sydänsairauteen. Tämä rajoitus voidaan poistaa käyttämällä kudosdopplerinopeuksia, rasituskuvantamista ja sydänlihaksen supistumisfraktiota, joita on ehdotettu sopivammiksi indekseiksi sydämen toiminnan arvioimiseksi.2
Muita klassisia kaikukardiografisia merkkejä ovat oikean kammion hypertrofia, kaksoiskammiolaajentuma, lievä sydänpussin effuusio, eteiskammioläpän paksuuntuminen, eteisen väliseinän seinämän paksuuntuminen ja rakeinen kimaltelevan näköinen sydänlihaksen ulkonäkö3,6 . Koska jotkin näistä piirteistä havaittiin kuitenkin hyvin valikoidussa potilassarjassa taudin pitkälle edenneissä vaiheissa, kaikkia niitä ei tarvitse esiintyä epäilyn herättämiseksi.1
Regionaalinen rasituskuvantaminen on erittäin käyttökelpoinen tekniikka ATTR-potilaiden varhaisdiagnostiikassa. ATTR:ää sairastavilla potilailla pituussuuntainen venymä on alentunut tyvi- ja keskikammiosegmenteissä, mutta säilyy apikaalisissa segmenteissä18 (kuva 2C). Tämä tyypillinen kuvio voi olla hyödyllinen ATTR:n erotusdiagnostiikassa muista sydänsairauksista.4
Biomarkkerit
Aivojen natriureettisen propeptidin N-terminaalisen prohormonin (NT-proBNP) ja troponiinin merkityksestä ATTR:ssä on vähemmän tietoa kuin AL:ssa.4 NT-proBNP:n pitoisuudet ATTR:ssä ovat tyypillisesti alhaisemmat kuin AL:ssä,4 mikä heijastaa kahta erilaista patofysiologista mekanismia: suoraa kevytketjujen toksisuutta AL:ssä ja protofibrillien aiheuttamaa kudosvauriota ATTR:ssä.
Juuri hiljattain Mayo Clinicin työryhmä ehdotti samanlaista stratifiointijärjestelmää kuin se, joka on voimassa AL:n osalta. Kohortissa, johon kuului 360 ATTRwt-potilasta, molemmat biomarkkerit osoittautuivat kuolleisuutta ennustaviksi tekijöiksi. Vaiheen III potilaiden (NT-proBNP > 3000 pg/ml ja troponiini T > 0,05 ng/ml) eloonjäämisajan mediaani oli 20 kuukautta, kun taas vaiheen I ja II potilaiden eloonjäämisajan mediaani oli 66 kuukautta ja 40 kuukautta (ei yhtään biomarkkeria tai vain yksi biomarkkeri vakiintuneiden raja-arvojen yläpuolella).
Sydämen magneettitutkimus
Sydämen magneettitutkimuksen (CMRI, Cardiac Magnetic Resonance Imaging)
Monitorikuvantamisen (CMRI, Cardiac Magnetic Resonance Imaging)
avulla pystytään hankkimaan rakenteellista ja funktionaalista informaatiota ja luonnehtimaan sydänlihassolujen kudoskokoonpanoja.3 CMRI on olennaisen tärkeä ATTR:n varhaisessa tunnistamisessa ja sen erotusdiagnostiikassa muista sydänsairauksista.
Kudoksen karakterisointi CMRI:llä perustuu seuraaviin ominaisuuksiin:
- –
Myöhäinen tehostuminen: Globaali subendokardiaalinen kuvio on käytännössä patognomoninen sydämen amyloidoosille, mutta sitä esiintyy vain noin neljänneksellä potilaista. Myös muut kuvioinnit, kuten transmuraalinen (yleisin) tai paikoittainen, ovat yhteensopivia (kuva 3). Korkeasta herkkyydestä ja spesifisyydestä huolimatta on otettava huomioon, että myöhäistä tehostumista saattaa puuttua (15 %:lla potilaista) ja että kokemuksemme mukaan teknisistä syistä johtuen vääriä negatiivisia tuloksia on huomattava määrä.3 Transmuraalinen tehostumiskuvio liittyy huonompaan ennusteeseen ja on itsenäinen kuolleisuuden ennustaja.19
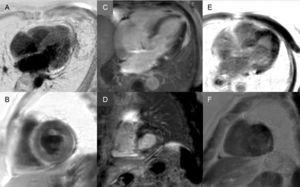 Kuvio 3. Transmuraalinen tehostuminen.
Kuvio 3. Transmuraalinen tehostuminen.Sydämen magneettikuvauksen myöhäisten tehostumiskuvioiden monimuotoisuus transtyretiiniamyloidoosissa. A ja B: myöhäisrikastumissekvenssit 4-kammiotasossa ja lyhyellä akselilla keskitasolla potilaalta, jolla on mutanttinen transtyretiiniamyloidoosi (ATTRm) ja jossa näkyy diffuusi patologinen transmuraalinen gadoliniumkerrostuma. C ja D: ATTRm:ää sairastavan potilaan myöhäiset tehostussekvenssit, 4-kammiotaso ja lyhytakselinen tyvitaso, joissa näkyy patologinen gadoliniumkerrostuma, jossa on laikukas kuvio ja jossa on alempana inferoseptalinen ja inferolateraalinen tyvitason polttopistealue. E ja F, ATTRm-potilaiden myöhäiset vahvistussekvenssit, 4-kammiotaso ja lyhytakselinen apikaalitaso, joissa näkyy laaja patologinen transmuraalinen laskeuma lukuun ottamatta basaalista ja keskimmäistä anterolateraalista segmenttiä. Courtesy of Dr Jesús González Mirelis.
(0.15MB).- –
Pitkät T1-ajat: T1-kartoitus on tekniikka, jossa sydänlihaksen kvantitatiivinen signaali mitataan ennen (natiivi T1) tai jälkeen kontrastin antamisen. Natiivit T1-ajat ovat hyvin pitkiä sydämen amyloidoosissa.3 T1-kartoitus ei edellytä kontrastin antamista, joten sitä voidaan käyttää munuaisten vajaatoiminnassa. T1-ajat voivat olla poikkeavia jopa ennen kuin LVH havaitaan.3 T1-ajat ovat ATTR:ssä pidempiä kuin HCM:ssä ja kontrolleissa (1097 ms ± 43 ms vs. 1026 ms ± 64 ms vs. 9,67 ms ± 34 ms; P
ms ± 68 ms; P = 0,01).20
- –
Kontrastin antoa voidaan käyttää solunulkoisen tilavuuden (ECV) laskemiseen ja solunulkoisen tilan lisääntymisen arviointiin. ECV-arvot sydämen amyloidoosissa ovat korkeammat kuin muissa sydänsairauksissa, lukuun ottamatta sydäninfarktialueita.21 Vuonna 2016 ryhmämme raportoi yhteistyössä muiden kansallisten keskusten kanssa, että ECV:n kvantifioinnilla voidaan tunnistaa sydämen osallisuus ATTRm:ssä ja korreloida se ensimmäistä kertaa neurologisen vajaatoiminnan asteen kanssa, mikä tukee tämän tekniikan käyttöä ATTRm:n varhaisdiagnostiikassa ja seurannassa.22
T1-kartoitus, ennen ja jälkeen kontrastin, modifioidulla look-locker inversion-recovery (MOLLI) -menetelmällä 3T:n sydämen magneettikuvauksessa terveellä kontrollilla, transtyretiiniamyloidoosia sairastavalla potilaalla ja potilaalla, jolla on primaarinen kevytketjuinen amyloidoosi. A ja B: natiivi T1-kartoitus ja ekstrasellulaarinen tilavuus (EV) terveessä kontrollissa, jossa normaalit arvot (EV = 0,214). C ja D: natiivinen T1-kartoitus ja EV vastaavasti potilaalla, jolla on mutanttinen transtyretiiniamyloidoosi, jolla on neurologinen vaurio ja alkava sydänvaurio, kohonnut natiivinen T1 ja hieman kohonnut EV (0,361). E ja F: natiivinen T1-kartoitus ja EV vastaavasti potilaalla, jolla on villityyppinen transtyretiini sydänamyloidoosi, kohonnut natiivinen T1 ja erittäin korkea EV (0,626), mikä heijastaa massiivista amyloidi-infiltraatiota. Courtesy of Dr Jesús González Mirelis.
(0.68MB). - –
Sydänskintigrafia
1980-luvulla havainto useiden luun difosfonaattimerkkiaineiden ottamisesta sydämeen korreloitiin histologisesti sydänamyloidoosin esiintymiseen.23 Imeytymismekanismia ei tunneta hyvin, mutta se saattaa liittyä amyloidiesiintymien kalsiumpitoisuuteen.
Bolognan ryhmän varhaisessa 99mTc-DPD:tä käyttävässä tutkimuksessa todettiin sydämen imeytyminen 15 ATTR-potilaalla ja sen puuttuminen 10 AL-potilaalla käyttäen pistemäärää, joka perustui siihen, että biventrikulaarinen imeytyminen oli yhtä suuri tai suurempi kuin luun imeytyminen (Peruginin pistemäärä)24 (kuva 2D). Ryhmämme ja muut ovat sittemmin raportoineet samankaltaisia löydöksiä.25 Lievää (pistemäärä 1) ja keskivaikeaa (pistemäärä 2) uptakea esiintyy 30 prosentilla ja 10 prosentilla AL-potilaista.24
Korkean herkkyytensä ja spesifisyytensä vuoksi tämä tekniikka on erittäin hyödyllinen ATTR-diagnoosin asettamisessa, ja se voi osoittaa sydänlihaksen osallistumisen myös silloin, kun kaikukardiografia- ja magneettikuvauslöydökset pysyvät vielä normaaleina. Itse asiassa onkologisten tai reumatologisten indikaatioiden vuoksi tehdyn skintigrafian jälkeen ATTR:n satunnaislöydökset eivät ole harvinaisia.26
Tc-DPD:tä ei ole saatavilla Yhdysvalloissa, mutta samankaltaisia tuloksia on raportoitu 99mTc-PYP (pyrofosfaatti)-kuvantamisella.27
Muita radiotraktoreita tutkitaan parhaillaan. Esimerkiksi 18F-florbetapiria, joka on jo hyväksytty aivojen beeta-amyloidin kuvantamiseen,4 on tutkittu AL- ja ATTR-potilailla. Tulokset osoittavat, että 18F-florbetapirilla voidaan havaita sydänlihaksen AL- ja ATTR-esiintymät.28 Vaikka käytettävissä olevat tiedot on saatu tapaustutkimuksissa29 ja tämän radiosädesäteilijän korkeat kustannukset rajoittavat sen käyttöä, useita tutkimuksia on meneillään, joissa selvitetään, olisiko sen käytöstä mahdollisesti enemmän hyötyä kuin Tc-DPD:n käytöstä kahden yleisimmän amyloidoosin seulontamenetelmänä.
Invasiivinen diagnostiikka
AtTR:n definitiivinen diagnoosi perustuu histologiseen näytteeseen, jossa osoitetaan amyloidifibrillejä. Vaikka sydämen ulkopuolista laskeumaa voi olla, todennäköisyys osoittaa histologisesti amyloidia vaihtelee elimittäin.2 Sydämen ulkopuolisen biopsian (esim. vatsaontelon rasvasta, ientaskusta, sylkirauhasista, ruoansulatuskanavasta) kustannusvaikuttavuudesta ATTR:ssä on vain vähän tutkimuksia, ja ATTRm:ssä kustannusvaikuttavuus on ATTRm:ssä suurempi kuin ATTRwt:ssä. Kliinisesti sairastumattoman elimen negatiivinen biopsia ei kuitenkaan sulje pois ATTR-diagnoosia.4
Kuten ATTRwt:ssä, endomyokardiaalinen biopsia on indikoitu potilailla, joilla ei ole ekstrakardiaalista sairastumista tai joilla on pelkkä sydänsairaus.3,4 Endomyokardiaalinen biopsia on vähäriskinen toimenpide (erityisesti kokeneissa keskuksissa), ja näytteenottovirheet ovat epätodennäköisiä.6
Ammyloidoosin histologisen varmistuksen jälkeen, joka saattaa joskus vaatia koulutetun henkilökunnan tulkintaa,6 alatyypin oikea luokittelu on ratkaisevan tärkeää.4 Nykyisin luokittelu perustuu immunohistokemian, geneettisen analyysin ja proteomiikan yhdistelmään:
- –
Immunohistokemia perustuu spesifisten tunnettuja amyloidiproteiineja vastaan tarkoitettujen vasta-aineiden käyttöön. Vaikka tämän tekniikan tulokset ovat yleensä lopullisia, se ei ole yhtä herkkä kevyiden ketjujen tunnistamisessa.4
- –
Tämä rajoitus voidaan poistaa käyttämällä massaspektrometriaa, jolla saadaan lopullisia tuloksia ja joka on kriteeristandardi amyloidin alatyypin vahvistamisessa.2 Vaikka tämä tekniikka on käytettävissä vain erikoistuneissa keskuksissa, se on erityisen hyödyllinen epäselvissä tapauksissa tai tapauksissa, joissa immunohistokemian tulokset ovat positiivisia useiden vasta-aineiden suhteen, mitä esiintyy kokemuksemme mukaan noin 20-30 prosentissa tapauksista. 4
- –
Koska kliinisillä tai histologisilla tekniikoilla ei voida erottaa ATTRm:ää ATTRwt:stä, geneettisiä tutkimuksia suositellaan kaikissa ATTR-tapauksissa. Aiheuttajamutaation löytämisellä voi olla merkitystä geneettisen neuvonnan ja seurannan tarjoamisessa oireettomille kantajille, 4,30 jotka voivat hyötyä tulevista hoidoista, jotka viivästyttävät tai jopa ehkäisevät taudin puhkeamista.31
Noninvasiivinen diagnoosi
Viime aikoihin histologisia tutkimuksia pidettiin välttämättöminä ATTR:n diagnosoinnissa.3 Diagnoosin helpottamiseksi ehdotettiin kuitenkin vuonna 2016 kansainvälisessä monikeskustutkimuksessa uutta algoritmia ATTR:n noninvasiivista diagnoosia varten.32
Tutkimuksessa analysoitiin 1217 potilaan tuloksia. Sydämen amyloidoosin klassisten merkkien esiintyminen kuvantamismenetelmillä, asteen 2 tai 3 Tc-DPD/PYP-uptake skintigrafiassa ja monoklonaalisen proteiinin puuttuminen olivat ATTR:n spesifisyys ja positiivinen ennustearvo 100 %32 (kuva 5) (kuva 5).
Diagnostinen algoritmi potilaille, joilla epäillään sydämen amyloidoosia. 99mTc-DPD-skintigrafian luokitusjärjestelmä: aste 0, ei sydämen uptakea; aste 1, hieman pienempi uptake kuin luun uptake; aste 2, kohtalainen uptake, joka vastaa luun uptakea; aste 3, vakava uptake, joka on parempi kuin luun uptake. ACV, aivohalvaus; AL, primaarinen kevytketjuamyloidoosi; AoS, aorttastenoosi; ATTR, transtyretiiniamyloidoosi; ATTRm, mutantti transtyretiiniamyloidoosi; ATTRwt, villityyppinen transtyretiiniamyloidoosi; CMRI, sydämen magneettikuvaus; EKG, elektrokardiogrammi; HCM, hypertrofinen kardiomyopatia; HF, sydämen vajaatoiminta; RCM, restriktiivinen kardiomyopatia; TTR, transtyretiini.
Tärkeä piirre tässä algoritmissa on se, että siinä ei esiinny monoklonaalista valkuaista, joka voisi aiheuttaa AL:n seerumin ketjupitoisuusmäärityksessä (Freelite, The Binding Site, Iso-Britannia) ja veren ja virtsan immunofiksaatio-elektroforeesissa. Monoklonaalisen proteiinin esiintyminen on indikaatio endomyokardiaaliseen biopsiaan ATTR:n ja AL:n erottamiseksi toisistaan.32 Jopa 5 prosentilla yli 65-vuotiaasta väestöstä on määrittelemättömän merkityksen omaava monoklonaalinen gammopatia.2 Iäkkäillä henkilöillä verenkierrossa olevien kevyiden ketjujen maltillisen lisääntymisen ei pitäisi johtaa suoraan AL-diagnoosiin. On raportoitu, että jopa 10 prosentilla iäkkäistä potilaista, joilla oli ATTRwt ja määrittelemättömän merkityksen monoklonaalinen gammopatia viitekeskuksissa, oli aiemmin tehty väärä AL-diagnoosi.3,33 Oikea diagnoosi on tarpeen, jotta voidaan välttää epätarkoituksenmukainen kemoterapia. Mielenkiintoista on, että sairaalassamme on dokumentoitu 2 tapausta potilaista, joilla on ollut multippeli myelooma ja samanaikainen ATTRwt massaspektrometrisesti.
TRANSTHYRETIN KARDIALLISEN AMYLOIDOOSIN HOITO
ATTR-potilaiden hoidolla on kaksi tavoitetta: antaa lääketieteellistä tukea ja mahdollisuuksien mukaan pysäyttää tai viivästyttää amyloidin laskeutumista erityishoidoilla.
Lääketieteellinen hoito
Seuraavissa kohdissa kuvataan ATTR-potilaiden tukihoitoa.
Sydämen vajaatoiminnan hoito
Euvolemia on pidettävä yllä potilailla, joilla on sydämen amyloidoosi. Ruokavalio ja elämäntapatoimenpiteet ovat erittäin tärkeitä. Diureetit ovat avainasemassa ATTR:n HF:n hoidossa. Koska diureettien liiallinen käyttö voi kuitenkin johtaa hypotensioon (usein autonomisen toimintahäiriön vuoksi) ja pahentaa kliinistä tilannetta erityisesti ATTRm:ssä, sen hoidossa on noudatettava äärimmäistä varovaisuutta.
AtTR:n HF:n hoidossa on otettava huomioon, että heikentynyt diastolinen toimintahäiriö ja pienentynyt aivohalvaustilavuus johtavat kompensoivaan takykardiaan, jolla pyritään pitämään yllä sydämen tehoa. Siksi beetasalpaajia on käytettävä varoen ja yksilöllisesti kullekin potilaalle. Vakiokäytäntö on poistaa ne, jos sykkeen hallinnassa ei ole vaikeuksia. Tämä lähestymistapa on vielä tärkeämpi, jos se on mahdollista ATTRwt:ssä, koska johtumishäiriöitä esiintyy usein.6 Kalsiumantagonistit ja digoksiini voivat sitoutua amyloidifibrilleihin, ja siksi ne ovat vasta-aiheisia ATTR:ssä toksisuusriskin vuoksi jopa terapeuttisina annoksina.6
Toisin kuin HF:ssä, jossa on muista syistä johtuva systolinen toimintahäiriö, sydämen amyloidoosissa ei ole näyttöä siitä, että beetasalpaajien, angiotensiinikonvertaasientsyymin estäjien tai angiotensiini II -reseptoriantagonistien käytöstä olisi ennusteellista hyötyä. Itse asiassa niiden käyttö voi johtaa kliinisen tilan huononemiseen hypotension ja alhaisen tehon vuoksi: tuoreessa julkaisussa on raportoitu huonommasta ennusteesta ATTRm:ssä ja neutraalista vaikutuksesta ATTRwt:ssä.34
Kammioperäisten rytmihäiriöiden hoito
Kammiovärinän hoito ATTR:ssä on haasteellista. Pitkäaikaisen sinusrytmin ylläpitäminen on vaikeaa. Sähköistä kardioversiota voidaan kuitenkin yrittää, koska se voi johtaa kliiniseen paranemiseen.
Tromboemboliariski ATTR-potilailla on hyvin suuri. Lisäksi krooninen amyloidi-infiltraatio voi johtaa mekaaniseen eteisen toimintahäiriöön, joka voi olla perimmäinen syy eteisperäisen trombin kehittymiseen joillakin potilailla, joilla ei ole AF:ää. Antikoagulanttihoidon ei pitäisi ATTR:ssä perustua CHADS2-VASC-pisteytykseen, vaan sen pitäisi olla vakiohoitoa AF:ssä. Verenvuototapahtumat ovat harvinaisempia kuin AL:ssa, joten joissakin sairaaloissa suositellaan antikoagulanttihoitoa sinusrytmissä oleville potilaille, jos eteisen toiminta on huono lähetysdopplerinopeuksien perusteella. Vaikka suorien suun kautta otettavien antikoagulanttien ja K-vitamiiniantagonistien tehosta ei ole vertailevia tutkimuksia, sairaalassamme on annettu suoria suun kautta otettavia antikoagulantteja valikoiduille potilaille.
LAITTEIDEN ROOLI
Tämänhetkiset suositukset sydämentahdistimen istuttamisesta ovat samat ATTR:llä ja yleisväestöllä. Jotkin ryhmät kuitenkin suosivat profylaktista implantointia erityisesti potilailla, joilla on ATTRm ja johtumishäiriöitä.35 Me emme suosi tätä ennaltaehkäisevää strategiaa emmekä ole havainneet niin suurta johtumishäiriöiden osuutta, että profylaktinen implantointi olisi perusteltua potilailla, joilla on ATTRm.
Implantaatiokardioverterin ja -defibrillaattorin (ICD:n) käyttöä ATTR:ssä ei ole vakiintunut. Pienessä sarjassa ICD-istutus ei parantanut merkittävästi eloonjäämisaikaa, vaikka sillä olikin tarkoituksenmukainen vaikutus useilla potilailla kahden ensimmäisen vuoden aikana.36
Sydämensiirto
Sydämensiirrolla on ollut vähäinen merkitys ATTRm:n hoidossa, koska ATTRm voi koskettaa eri elimiä ja ATTRwt:llä on tyypillisesti iäkkäitä potilaita. Koska ATTRwt-potilailla ei kuitenkaan ole sydämen ulkopuolista osallistumista, he ovat hyviä ehdokkaita toimenpiteeseen. Kirjallisuudessa on esimerkkejä onnistuneista elinsiirroista alle 70-vuotiailla potilailla, joilla on ATTRwt tai ATTRm ja pääasiallinen sydänlihasvaurio.4
Transstyretiinisydänamyloidoosin erityishoito
Tänään ei ole olemassa hyväksyttyä hoitoa ATTR-sydänamyloidoosin erityishoitoon, vaikka maksansiirtoa (TxH) yksinään tai yhdessä sydämensiirron kanssa on käytetty ATTRm:n hoidossa 1990-luvulta lähtien keinona eliminoida pääasiallinen TTR:n esiasteiden lähde.4
Maksansiirto
The Familial Amyloidotic Polyneuropathy World Transplant Registry37 raportoi, että yli 2000 ATTRm-potilaalle on tehty TxH 20 maassa.4 Potilaiden, joilla on Val30Met-mutaatio ja pääasiassa neurologinen kliininen kuva, eloonjäämisprosentti on yli 50 % 20 vuoden kuluttua.3 Nämä lupaavat tulokset perustuvat tiukkaan potilasvalintaan iän, mutaatiotyypin ja taudin vaiheen mukaan. Yleisimmin hyväksytty indikaatio TxH:lle on nuoren iän, Val30Met-mutaation ja taudin varhaisen vaiheen yhdistelmä.
Tämän tekniikan tärkeimpiä rajoituksia ovat kuitenkin luovuttajien puute, kroonisen immunosuppression tarve, korkea ikä taudin ilmaantuessa ja huonommat tulokset potilailla, joilla on muita mutaatioita kuin Val30Met-mutaatio.
Lisäksi mutaatioproteiinin tuotannon teoreettista suppressiota kumoaa istutuksen jälkeinen progressiivinen natiivin TTR:n laskeuma4,6 , jonka mekanismia ei täysin ymmärretä. Itse asiassa sydämen TTR-laskeuma TxH:n jälkeen vaikuttaa sairastuvuuteen ja kuolleisuuteen.
Tarve ymmärtää paremmin ATTR:n patogeneesiä ja TxH:n rajoituksia on kannustanut useiden lääkkeiden kehittämiseen.
Nämä uudet yhdisteet vaikuttavat TTR:n amyloidogeneesin kaskadin eri kohdissa (kuva 6). Hoitoon liittyy aina prekursoriproteiinin vähentäminen, vaikka yhtä tärkeää on myös laskeuman välttäminen ja olemassa olevien laskeumien poistaminen. Siksi uskomme, että tulevaisuudessa lähestymistapa tähän tautiin on yhdistelmähoito.
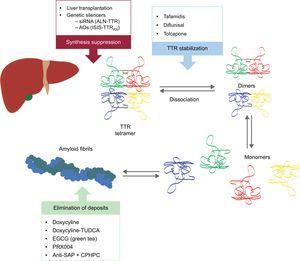
Transtyretiinisydänamyloidoosin erityishoidot ja tärkeimmät hoitokohteet. AntiSAP + CPHPC, antiseerumi amyloidi P-komponentti + (R)-1–6-okso-heksanoyyli]pyrrolidiini-2-karboksyylihappo; AO:t, antisense-oligonukleotidit; EGCG, epigallokatekiini-3-gallaatti; siRNA, pieni häiritsevä RNA; TTR, transtyretiini; TUDCA, tauroursodeoksikolihappo.
Transstyretiinisynteesin tukahduttaminen
Kahdella tutkimuslinjalla tutkitaan TTR:n maksan ilmentymisen estämistä: pienen häiritsevän RNA:n (siRNA) ja antisense-oligonukleotidien (AO) lääkkeiden käytöllä.
- –
SiRNA:t ovat kaksijuosteisia RNA-molekyylejä, jotka hiljentävät lähetti- RNA-sekvenssejä sitoutumalla niihin spesifisesti ja estävät proteiinin muodostumisen. Patisiranin (ALN-TTR02) on todettu vähentävän TTR:n tuotantoa 80 %.38 ATTRm-potilailla TTR:n väheneminen oli 87 %.39 Vaiheen 2 tutkimuksessa on saatu lupaavia tuloksia, jotka osoittavat vakaita kaikukardiografisia, toiminnallisia ja analyyttisiä parametreja 12 kuukauden ja 24 kuukauden kohdalla.40 Vaiheen 3 neurologisen tutkimuksen tulokset ATTRm-potilailla ja osa-analyysi potilaista, joilla on sydänvaurio, odotetaan saatavan vuonna 2017 (taulukko 2). Toinen lääke, revusiran (ALN-TTR01), annetaan ihon alle, ja se eroaa patisiranista siRNA:ta kapseloivien lipidinanopartikkelien osalta. Tästä lääkkeestä tehtiin vaiheen III kliininen tutkimus ATTRm-potilailla, joilla on sydänsairaus. Tutkimus keskeytettiin viime vuonna, koska kuolleisuus lisääntyi odottamattomasti hoitoryhmässä (taulukko 2).
Taulukko 2. Vertailu.Transtyretiini-sydänamyloidoosia koskevat tärkeimmät meneillään olevat kliiniset tutkimukset
VAikutusmekanismi Yhdiste Tutkimus Suunnittelu. Potilaat (N) ja ATTR:n alatyyppi Interventio Perimmäiset päätetapahtumat Tilanne/tulokset TTR:n synteesin suppressio Patisiran (ALN-TTR02) NCT01961921 Vaiheen II tutkimus, monikeskustutkimus 27
ATTRm (11 sydämen osallistuminen)Patisiran 0.30 mg/kg IV 3 wk välein 2 v ajan Pitkän aikavälin turvallisuus. Toissijaiset päätetapahtumat: Vaikutus neurologisiin häiriöihin ja sydänparametreihin Hyvin siedetty lääke, jolla on samanlainen turvallisuusprofiili neurologisessa ja sydänfenotyypissä
Troponiini I, NT-proBNP- ja kaikukardiografiset tiedot pysyivät vakaina 12 kk:n ja 24 kk:n kohdallaNCT01960348 (APOLLO) Faasi III, satunnaistettu, kaksoissokkoutettu, plasebokontrolloitu, monikeskuksinen 225
ATTRm, jolla on neurologinen osallistuminenPatisiran infuusio infuusiona IV vs. plasebo 2:1 Muutokset mNIS+7:ssä Arvioidaan marraskuussa 2017
Subanalyysi potilaista, joilla on ennustettu sydämen osallistuminenNCT02510261 APOLLO-laajennustutkimus Patisiran infuusio infuusiona IV vs. plasebo 2:1 52 wk:n ajan Turvallisuus ja pitkäaikaiset haittavaikutukset Jatkuva Revusiran (ALN-TTR01) NCT02319005 (ENDEAVOUR) Vaihe III, satunnaistettu, kaksoissokkoutettu, lumekontrolloitu 206
ATTRm, jolla on sydänvaivojaRevusiran 500mg 5 d, sitten viikoittain 2 v ajan vs. lumelääke Muutokset 6 m:n kävelytestissä ja plasman TTR-arvoissa Keskeytettiin lisääntyneen kuolleisuuden vuoksi revusiranihaarassa ISIS-TTRRX NCT01737398 Vaihe II/III, satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, monikeskuksinen 172
ATTRm, jolla on neuropatia; 50 % samanaikainen sydämen vajaatoimintaISIS-TTRRX 300 mg SC 12 h välein 1 wk ajan, sitten viikoittain 64 wk:n ajan vs. lumelääke Muutokset mNIS+7:ssä ja Norfolkin elämänlaatukyselylomakkeessa Arvioitu syyskuussa 2017
Tapauksia vakavasta trombosytopeniasta ja verenvuodosta raportoitu
Ekokardiografisten parametrien ja NT-proBNP odotetaan potilailla, joilla ei ole verenpainetautia ja joilla on LVH > 12 mmTTR-kardiomyopatian hoito TTR-spesifisellä antisense-oligonukleotidilla Vaihe II, avoin, satunnaistamaton 20
ATTRm, jolla on sydämen osallistuminen ja ATTRwtISIS-TTRRX 300 mg SC 12 h/vko välein Ekokardiografiset parametrit ja sydämen magneettikuvaus vs. historialliset kontrolliryhmät Ei rasituksen heikkenemistä ja LV-massan vähenemistä n. 5 %
6 potilasta valmistui 12 kk; 15 potilasta 6 kk; 1 potilas TxCNCT02627820 Faasi II, avoin, satunnaistamaton 50
ATTRwtISIS-TTRRX 300 mg SC 12 h välein 1 wk ajan, sitten 1 wk 18 wk:n ajan Kantavuuden muutokset mitattuna speckle tracking -menetelmällä Peruutettu aloittamatta potilasrekrytointia Vaiheen III tutkimus ISIS-TTRRX:llä tuberkuloosin TTR-amyloidikardiopatian hoidossa Vaihe III, satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, monikeskustutkimus 490
ATTRwt ja ATTRm, joilla on sydänvaurioISISIS-TTRRX 300 mg SC 12 h välein 1 wk:n ajan, sitten viikoittain 16 wk:n ajan lumelääkkeen kanssa, sitten viikoittain 24 kk:n ajan Kuolema, TxC tai sisäänpääsy sydän- ja verisuonitautien vuoksi Varalla TTR:n vakauttaminen Tafamidis NCT01994889 Vaihe III, satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, monikeskuksinen 441
ATTRwt ja ATTRm, joilla on sydänvaurioTafamidis 20 mg tai 80 mg suun kautta 24 h välein 30 kk:n ajan vs. lumelääke All-cause mortality and cardiovascular hospitalization Ends February 2018 NCT02791230 Extension Phase III NCT01994889 330
ATTRwt and ATTRm with heart involvementTafamidis 20 mg tai 80 mg oraalisesti 24 h välein 60 kk:n ajan All-cause mortality and incidence of adverse effects Expected December 2021 NCT00935012 Phase II, avoin, teho- ja turvallisuustutkimus 31
ATTRwt tai ATTRm p.Val122Ile with cardiac involvementTafamidis 20mg oraalisesti Turvallisuus ja teho Jatkuu joulukuuhun 2021 asti Diflunisal NCT00294671 Vaihe III, satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, monikeskuksinen 130
ATTRm, jolla on neurologinen fenotyyppi (50 %:lla sydänoireita)Diflunisal 250 mg suun kautta 12 h välein vs. lumelääke 24 kk:n ajan NIS+7 24 kk:n kohdalla NIS+7 diflunisal vs. lumelääke 16.3 (P Ei kammion paksuuden tai rasituksen vähenemistä potilailla, joilla oli sydänvaurio vs. lumelääke Kertymien väheneminen Doksisykliini + TUDCA/UDCA NCT01171859 Vaihe II, avoin, satunnaistamaton, prospektiivinen 40
ATTR (25 ATTRm, 13 ATTRwt ja 2 domino-maksansiirron saanutta)Doksisykliini 100 mg 12 h välein + TUDCA 250 mg 8 h välein 12 kuukauden ajan, sitten 6 kk ilman hoitoa Lisääntyminen 14 potilasta vetäytyi
Haitalliset ihoreaktiot, 16 potilasta
68 % 25:stä arvioitavissa olleesta potilaasta täytti ensisijaisen päätetapahtumakohdan
Kannan kokonaisparaneminen 12 kk:n kohdalla ja paheneminen 6 kk:n kuluttua ilman hoitoaNCT01855360 Vaihe II, avoin, satunnaistamaton, prospektiivinen vs. historialliset kontrollit 30
Sydämen ATTR-amyloidoosi (27 ATTRwt ja 3 ATTRm). Historialliset kontrollit, 14 ATTRwt-potilastaDoksisykliini 100 mg 12 h välein + TUDCA 250 mg 8 h välein 18 kk:n ajan Pituussuuntaisen rasituksen muutokset 6 kk:n välein 22 potilasta suoritti tutkimuksen loppuun ja olivat arvioitavissa
Suuntaisen rasituksen suurempi heikkeneminen kontrolleissa vs. hoitoryhmässä
Hoitoryhmässä lisääntynyt NT-proBNP; ei mitattu kontrolleissaNCT01677286 Vaihe II, avoin, ei satunnaistettu, prospektiivinen 25
Systeeminen amyloidoosi (6 ATTRwt ja 3 ATTRm)Doksisykliini 100 mg 12 h välein 12 kk:n ajan Lääkkeen turvallisuus
Tautiin sairastuneiden elinten reaktiotNT:n paheneminen-proBNP:n ja munuaisten toiminnan heikkeneminen
Ei parannusta muissa tutkituissa parametreissa
60 %:lla potilaista oli ihokomplikaatioita ja 30 % vetäytyi iho- tai ruoansulatuskanavan ongelmien vuoksiNCT01171859 Vaihe II, avoin, satunnaistamaton, prospektiivinen 45
35, joilla oli sydänvaivoja; 25 ATTRm; 5 ATTRm ja TxH; 13 ATTRwt; ja 2 Domino-maksansiirron saanuttaDoksisykliini 100 mg 12 h välein + TUDCA 250 mg 8 h välein 12 kk:n ajan
Seuraava seurantavaihe ilman hoitoa 6 kk:n ajanLääkitysvaste, joka määriteltiin Kardiologinen vaste arvioitiin 25:llä potilaalla
68 %:lla oli sydänvaste
Nousseet NT-proBNP ja rasituksen heikkeneminen seurannan aikana ilman hoitoa
Haittavaikutusten vuoksi tehtyjen keskeytysten suuri määrä
14 keskeytti hoitovaiheessa ja 5 keskeytti vaiheessa ilman hoitoaDoksisykliini + UDCA:n vaikutus ATTR:ään Vaihe II, avoin, satunnaistamaton, prospektiivinen 28
ATTR:ää, jossa oli mukana sydän (27 ATTRm ja 1 ATTRwt)Doksisykliini 200 mg/d 4 wk ajan, sitten keskeytetty 2 wk, sitten UDCA 750 mg/d 12 kk:n ajan
Seuraava seurantavaihe ilman hoitoa 6 kk:n ajanMuutokset NT-proBNP:ssä ja Kumamoto-pisteytyksessä Vain 14 % suoritti tutkimuksen loppuun ja 36 % suoritti 12 kk:n ajan
Ei muutoksia NT-proBNP:ssä 6 kk:ssa ja paheneminen 12 kk:ssa
Vakaa LVH
Kumamoto-pisteytyksen paheneminen 12 kk:ssaEGCG NCT01171859 Vaihe II, avoin, satunnaistamaton, prospektiivinen 25
ATTRwt600 mg, EGCG 12 mo:n ajan Muutokset ECHO:ssa ja sydämen magneettikuvauksessa (n = 14) Levykuopan massan pieneneminen 6 % sydämen magneettikuvauksessa (P = 0.03)
LVEF, sydänlihaksen paksuus ja MAPSE ECHO:n mukaan ennallaanAntiSAP + CPHPC NCT03044353 Vaihe II, avoin, satunnaistettu 40
Kohortti 1: sydämen ATTR-amyloidoosi
Kohortti 2: primaarinen amyloidoosi 6 kk:n kemoterapian jälkeenAnti-SAP + CPHPC kuukausittain 6 kk:n ajan Vähentynyt amyloiditaakka sydämen MRI:llä ja ECHO:lla Aloitus 2017 Anti-SAP + CPHPC, antiseerumin amyloidi P-komponentti + (R)-1–6-okso-heksanoyyli]pyrrolidiini-2-karboksyylihappo; ATTRm, mutantti transtyretiiniamyloidoosi; ATTRwt, villityyppinen transtyretiiniamyloidoosi; BNP, aivojen natriureettinen peptidi; ECHO, kaikukardiogrammi; EGCG, epigallokatekiini-3-gallaatti; IV, laskimonsisäinen; LV, vasen kammio; LVEF, vasemman kammion ejektiofraktio; LVH, vasemman kammion hypertrofia; MAPSE, mitraalirenkaan tason systolinen ekskursio; mNIS, modifioitu neuropatian heikentymispisteytys (Modified Neuropathy Impairment Score); MRI, magneettikuvaus (magnetic resonance imaging); NIS, neuropathy Impairment Score; NIS-LL, Neuropathy Impairment Score of the Lower Limbs; NT-proBNP, aminoterminaalinen pro-aivojen natriureettinen peptidi; SC, ihonalainen; TTR, transtyretiini; TUDCA, tauroursodeoksikolihappo; TxC, sydämensiirto; TxH, maksansiirto; UDCA, ursodeoksikolihappo.
- –
AO:t ovat lyhyitä oligonukleotidiketjuja, jotka sitoutuvat spesifisesti RNA:han estäen translaation ja kohdeproteiinisynteesin.4 ISIS-TTRRX on ihon alle annosteltava AO, jolla on osoitettu annosriippuvaista TTR-arvojen vähenemistä 75-90 % terveillä vapaaehtoisilla.4 Vaiheen III tutkimus ATTRm-potilailla, joilla on ATTRm ja neurologinen fenotyyppi, päättyi maaliskuussa 2017, ja sen tuloksia odotetaan vuoden 2017 loppuun mennessä. Yhdysvaltain elintarvike- ja lääkevirasto lykkäsi kuitenkin vaiheen III tutkimuksen aloittamista potilailla, joilla on ATTRwt ja ATTRm ja joilla on sydänsairaus, koska neurologisessa tutkimuksessa esiintyi vakavia trombosytopeniatapauksia (taulukko 2). Koska 50 prosentilla neurologiseen tutkimukseen osallistuneista oli sydänsairaus, tämän sydänlääketieteellisen osatutkimuksen tuloksista riippuu, jatketaanko vaiheen III tutkimusta. Toisaalta on olemassa alustavia tietoja avoimesta vaiheen II tutkimuksesta. Tässä tutkimuksessa 22 ATTRwt- ja ATTRm-potilasta, joilla oli sydänsairaus, sai viikoittaisen ISIS-TTRRX-injektion. Raportin mukaan lääkkeen turvallisuusprofiili on erittäin suotuisa, ja sydänsairauden etenemistä koskevat väliaikatiedot CMR:n, NT-proBNP:n ja 6 minuutin testien avulla ovat positiivisia.41
Transtyretiinin stabilointi
TTR-tetrameerin hajoaminen alayksiköiksi on ratkaiseva vaihe ATTR-fibrillien muodostumisessa. Diflunisali ja tafamidis ovat 2 TTR:n stabiloijaa, joilla on osoitettu teho ATTRm-polyneuropatian hoidossa.
- –
Tafamidis on suun kautta annosteltava pieni molekyyli, joka sitoutuu TTR:ään T4:n sitoutumiskohtiin stabiloimalla proteiinia ja estämällä sen dissosioitumisen. Euroopan lääkevirasto julkaisi tulokset satunnaistetusta kaksoissokkotutkimuksesta, jonka kohteena oli 125 potilasta, joilla oli ATTRm ja Val30Met-mutaatio neurologisen sairauden alkuvaiheessa42 , ja Euroopan lääkevirasto hyväksyi sen käytön vuonna 2011 harvinaislääkkeenä neurologisen taudin etenemisen viivästyttämiseksi. Viimeaikaiset tiedot osoittavat, että lääke tehoaa neurologisen vakauden saavuttamiseen vähintään 60 prosentilla osallistujista yli neljän vuoden seurannan jälkeen. Toistaiseksi sitä on käytetty rajoitetusti ATTR- ja kardiologisissa sairauksissa. Vaiheen II tutkimus 21 potilaalla, joilla oli ATTRm ja eri mutaatioita, osoitti, että NT-proBNP ja kaikukardiografiset parametrit pysyivät vakaina 12 kuukauden kuluttua.43 Viiden vuoden kohorttitutkimuksen tiedot vahvistivat, että lääke oli hyvin siedetty 20 mg:n annoksella, vaikkakin vain harvat potilaat, joilla oli ATTRwt, pysyivät vakaina 3,5 vuoden kuluttua.44 . ATTR-ACT-tutkimus on 30 kuukauden mittainen vaiheen III tutkimus, jossa arvioitiin 20 mg:n ja 80 mg:n tafamidisannosten tehoa, turvallisuutta ja siedettävyyttä verrattuna lumelääkkeeseen 440:llä potilaalla, joilla oli ATTRm, ATTRwt ja HF. Ensisijainen päätetapahtuma sisältää sairaalakuolleisuuden ja sairaalahoitoon pääsyn. Sen tuloksia odotetaan vuonna 2018.3,27
- –
Diflunisali on ei-steroidinen tulehduskipulääke, joka stabiloi TTR-molekyylejä in vitro. Sitä ei ole saatavilla Espanjassa, mutta sitä voidaan pyytää lääketieteellisesti ulkomailta myötätuntokäyttöä varten. Vaiheen III tutkimuksessa, joka tehtiin ATTRm:llä potilailla, joilla oli pääasiassa neurologinen sairaus ja joista yli puolella oli sydänsairaus, ei havaittu merkittäviä eroja kaikukardiografisissa parametreissa tutkimusjakson aikana (taulukko 2).45 Koska ATTRm:llä voi olla maha-suolikanavan haittavaikutuksia, munuaisten vajaatoimintaa, vedenpidätyskyvyttömyyttä ja kohonnutta verenpainetta, se ei sovellu potilaille, joilla on sydänsairaus. Diflunisaalia koskeva näyttö ATTR-potilailla on hyvin rajallinen. On olemassa yksi tutkimus, mutta sitä rajoitti se, että se oli satunnaistamaton yhden keskuksen tutkimus, jossa seuranta oli vähäistä ja potilaita oli vähän (n = 13). Tutkimuksessa ei ollut dekompensoituneen HF:n vuoksi tehtyjä sisäänottoja, mutta munuaistoiminta heikkeni merkittävästi.46
- –
Viime aikoina eräs espanjalainen ryhmä osoitti, että tolkaponi (Parkinsonin taudin hoidossa käytettävä suun kautta otettava katekoli-O-metyylitransferaasin estäjä) kykenee sitoutumaan in vitro ATTRwt- ja Val122Ile-tautia sairastavien ATTR-potilaiden TTR:ään suuremmalla affiniteetilla kuin muut stabilisaattorit.47
Amyloidikerrostumien eliminointi
Amyloidikerrostumat ovat hyvin stabiileja, ja näyttää siltä, että ihmisen elimistöllä on vain vähän kykyä poistaa niitä. Hoidot, jotka estävät uuden amyloidin tuotantoa, kuten AL:n kemoterapia, voivat kuitenkin vähitellen poistaa kerrostumia eri elinkohtaisilla nopeuksilla. Sydämen puhdistuma on erityisen alhainen, ja toistaiseksi näyttöä taantumisesta on niukasti. Useita molekyylejä tutkitaan parhaillaan amyloidin sydämen puhdistuman nopeuttamiseksi ATTR:ssä:
- –
Doksisykliini (yleisesti käytetty antibiootti) häiritsee amyloidifibrillien muodostumista. Yhdistetyn doksisykliinin ja maksasairauksien hoidossa käytettävän tauroursodeoksikolisappihapon (TUDCA) synergistisen vaikutuksen on osoitettu poistavan TTR-kertymiä eläinmalleissa. Vaiheen II tutkimuksessa, johon osallistui 20 potilasta, todettiin, ettei sydämen tai neurologinen eteneminen ollut lisääntynyt yhden vuoden doksisykliini/TUDCA-hoidon jälkeen ja että turvallisuus- ja siedettävyysprofiili oli hyväksyttävä.4 Muissa vaiheen II tutkimuksissa on pyritty vahvistamaan nämä havainnot käyttämällä yhdistettyä doksisykliiniä/TUDCAa, doksisykliiniä/urisodeoksisykolihappoa tai pelkkää doksisykliiniä.48-50 Yhden tutkimuksen alustavat tulokset viittaavat suojaavaan vaikutukseen, sillä rasitusvirtsankarkailun aiheuttama sydämen toiminnan heikkeneminen oli vähäisempää hoitoryhmässä. Toisessa näistä tutkimuksista saatiin samankaltaisia tuloksia 40 ATTR-potilaalla: muun muassa NT-proBNP, toiminnallinen luokka, LVEF ja sydänlihaksen paksuusparametrit pysyivät vakaina 12 kuukauden kuluttua (taulukko 2). Kaikissa näissä tutkimuksissa oli kuitenkin korkea keskeyttämisprosentti (35-44 %), joka johtui pääasiassa haittavaikutuksista, erityisesti auringon yliherkkyydestä ja ruoansulatuskanavan vaivoista (jopa 30 %).48-50
- –
EGCG (epigallokatekiini-3-gallaatti) on vihreän teen runsaslukuisinta katekiinia, ja sen on osoitettu in vitro ja hiirimallissa estävän amyloidin muodostumista ja poistavan olemassa olevia kerrostumia.4 CMRI-tutkimus osoitti, että 600 mg EGCG:n päivittäinen anto liittyi vasemman kammion massan stabiloitumiseen 25 potilaan ryhmässä (taulukko 2).51
- –
PRX004 on monoklonaalinen vasta-aine, joka vaikuttaa sitoutumalla monomeerispesifisiin epitooppeihin ja väärinfoldoituneeseen TTR:ään. Näin se saa aikaan kerrostumien poistumisen aktivoimalla fagosytoosin.52 Sen vaikutusmekanismin perusta on samanlainen kuin AL:ssa käytetyn vasta-aineen. Tämän vasta-aineen vaiheen II tutkimukset osoittavat lupaavia tuloksia. Tämän uuden vasta-aineen vaiheen I-II tutkimus on tarkoitus aloittaa vuonna 2017.
- –
Riippumatta amyloidin esiasteproteiinin tyypistä kaikki talletukset sisältävät seerumin amyloidikomponenttia P (SAP). Käyttämällä tätä molekyyliä kohdemolekyylinä anti-SAP-vasta-aineiden on osoitettu aiheuttavan makrofagivälitteisen ja komplementti-riippuvaisen reaktion, joka aiheutti viskeraalisten amyloidikerrostumien merkittävän poistumisen hiirimallissa. Bis-D-proliiniyhdiste CPHPC voi neutraloida plasman SAP:n, ja samanaikainen antaminen anti-SAP IgG:n kanssa mahdollistaa vasta-aineen pääsyn SAP:a sisältäviin kerrostumiin kudoksessa.53 Vuonna 2015 julkaistussa vaiheen I tutkimuksessa osoitettiin maksakertymien poistuminen 15 potilaalla, joilla oli systeeminen amyloidoosi ilman sydänsairautta ja joilla oli vain vähän haittavaikutuksia.53 Vaiheen II tutkimus ATTR-sydänamyloidoosia ja AL:a sairastavilla potilailla on tarkoitus aloittaa vuonna 2017 (taulukko 2).
YHTEENVETO
Transtyretiinisydänamyloidoosia diagnosoidaan yhä useammin. 99mTc-DPD-skintigrafia ja CMRI ovat esimerkkejä tekniikoista, joita voidaan käyttää ATTR-potilaiden yksinkertaiseen ja varhaiseen tunnistamiseen.
Monet ATTR-spesifiset lääkkeet ovat parhaillaan tutkimuksen loppuvaiheessa. Siksi uskomme, että ATTR-sydänamyloidoosia pidetään pian pikemminkin hoidettavana kokonaisuutena kuin kuolemaan johtavana sairautena.
RAHOITUS
Tämä työ toteutettiin Carlos III -terveysinstituutin ja Espanjan kardiologiyhdistyksen osittaisella tuella (tutkimusapuraha 2016 E. González-Lópezille). Carlos III -terveysinstituutin avustusta rahoittaa Euroopan aluekehitysrahasto ”Toinen tie Eurooppaan”.
KIINNOSTUSYHTEYDET
E. González-López on osallistunut puhujana Pfizerin järjestämiin tilaisuuksiin. P. Garcia-Pavia on saanut maksuja puhujana Pfizerin järjestämissä tilaisuuksissa ja konsulttina Alnylamille, Prothenalle ja Pfizerille. E. González-López, A. López-Sainz ja P. Garcia-Pavia ilmoittavat, että Pfizer on rahoittanut heidän laitoksensa tutkimushankkeita.
- –