Structure, Dynamics, and Function of Aquaporins
 2004 Winner of Visualization Challenge in Science and Engineering,
2004 Winner of Visualization Challenge in Science and Engineering, Organized by the National Science Foundation and Science Magazine. (Katso aiheeseen liittyvä Science-artikkeli.)
Veden läpäisyä kuvaava elokuvamme ja vuoden 2003 kemian Nobel-palkinto
The Art of Water Transport in Aquaporins
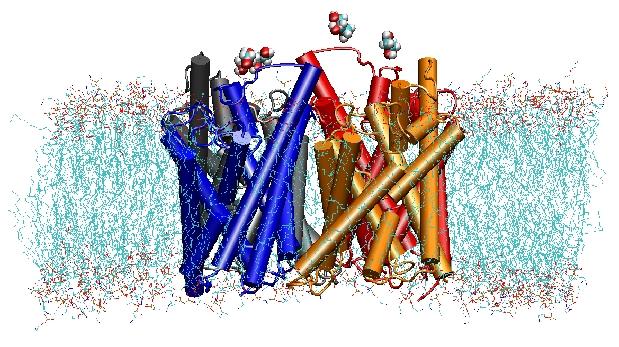
Aquaporiinit ovat kalvojen vesikanavia, joilla onkriittinen rooli solujen vesipitoisuuden hallinnassa. Nämä kanavat ovat laajalti levinneet kaikkiin elämän valtakuntiin, mukaan lukien bakteerit,kasvit ja nisäkkäät. Ihmiskehosta on löydetty yli kymmenen erilaista akvaporiinia, ja useat sairaudet, kuten synnynnäinen kaihi ja nefrogeeninen diabetes insipidus, liittyvät näiden kanavien heikentyneeseen toimintaan. Ne muodostavat solukalvolla tetrameerejä ja helpottavat veden ja joissakin tapauksissa muiden pienten liuottimien kuljettamista solukalvon läpi. Vesihuokoset ovat kuitenkin täysin läpäisemättömiä varautuneille lajeille, kuten protoneille, mikä on merkittävä ominaisuus, joka on kriittinen kalvon sähkökemiallisen potentiaalin säilyttämisen kannalta, mutta samalla paradoksaalinen, koska protonit voivat yleensä siirtyä helposti vesimolekyylien läpi. Simulaatioidemme tulokset ovat nyt antaneet uutta tietoa tämän kiehtovan ominaisuuden taustalla olevasta mekanismista. Proteiinin sähköstaattiset voimat pakottavat kanavan läpi kulkevat vesimolekyylit kääntymään kanavan keskellä (ks. animaatio), jolloin vaihtoehtoinen luovuttaja- ja vastaanottaja-asetelma, joka on välttämätön protonien siirtymiselle, rikkoutuu (lue koko tarina tieteellisestä artikkelistamme).

Functional Implication of a Peculiar Protein Architecture
Vuonna 2000 Stroudin laboratorio UCSF:ssä onnistui ratkaisemaan ensimmäisen korkearesoluutioisen rakenteen akvaporinista röntgenkristallografialla. Tutkittu rakenne oli E. coliglyserol uptake facilitator (GlpF), joka on akvaglyseroporiini,eli kanava on läpäisevä myös pienille lineaarisille sokerimolekyyleille, kuten glyserolille. Nanosekunnin MD-simulaatiot tetrameerisesta GlpF:stä POPE-lipidikaksoiskerroksen hydratoidussa laastarissa luonnehtivat substraatin täydellisen johtumisreitin kanavassa. Substraatin ja kanavan sisäosan välisten vetysidosvuorovaikutusten analyysi selitti myös ensimmäistä kertaa, miksi näiden kanavien arkkitehtuurissa on kaksi tyypillistä silmukkaa, jotka sisältävät energeettisesti epäedullisia sekundäärirakenteen elementtejä, jotka ovat säilyneitä koko vesihöyryperheessä (Jensenet al., Structure, 2001).
Sokerin läpäisyn energiatekniikka
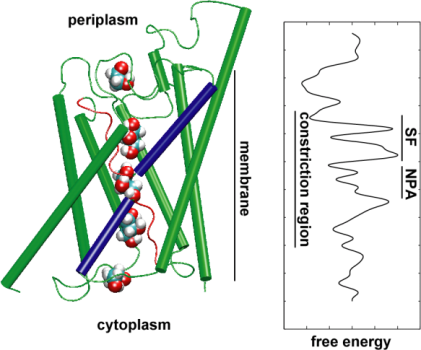
Sitten tutkimme kuljetustapahtuman energiatekniikkaa ymmärtääkseen, mitkä esteet substraatin on ylitettävä sen kulkiessa kanavan läpi. Vapaan energian profiilin kuvaamiseksi laskimme keskimääräisen voiman potentiaalin täydelliselle johtumistapahtumalle liikeradoista, joissa glyserolin liikettä kanavan läpi kiihdytettiin ulkoisen voiman avulla. Tämä tekniikka, joka tunnetaan nimellä steeredmolecular dynamics (SMD), mahdollistaa hitaiden tapahtumien havainnoinnin MD-simulaatioiden käytettävissä olevalla aikaskaalalla. Koska liikeradat eivät kuitenkaan ole tasapainossa, tuloksia analysoitaessa on otettava huomioon peruuttamattoman työn ongelma. Käyttämällä Jarzinskyn identiteettiä, joka on vapaan energian ja työn välinen yhtäläisyys epätasapainossa olevissa systeemeissä, pystyimme kuvaamaan täydellisesti kanavan läpi tapahtuvan glyserolin kuljetuksen energetiikan. Keskimääräisen voiman laskettu potentiaali kuvaa kanavan tärkeimpiä sitoutumispaikkoja ja esteitä läheisessä yhteisymmärryksessä epätasapainon MD-simulaatioiden ja kiderakenteen tulosten kanssa. Lisäksi sen muodossa on selvä epäsymmetria, mikä viittaa siihen, että proteiinin epäsymmetrinen rakenne voi olla toiminnallisesti tärkeä ravinnemolekyylien tehokkaalle ottamiselle ympäristöstä. (Jensen, etal., PNAS, 2002).
Mikä tekee akvaporiinista glyserolikanavan
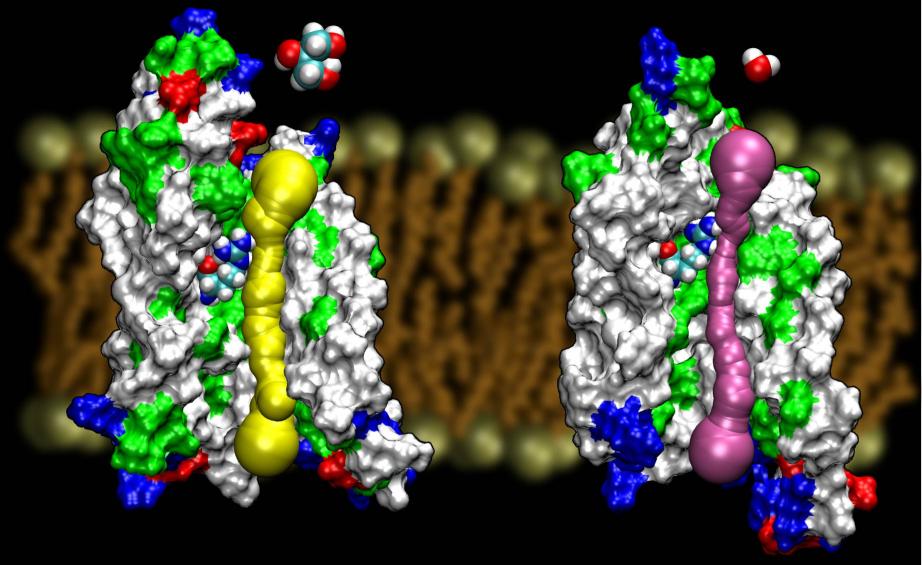
Akvaporiinit ovat hyvin onnekas kalvoproteiiniperhe,joka on tunnetusti vastustuskykyinen rakenteen määrittämiselle. Meillä onow korkearesoluutioiset rakenteet useista AQP:istä: GlpF, AQP1, AQP0 jaAqpZ. Pian on odotettavissa lisää rakenteita. Kahden E. colin AQP:n rakenne, joista toinen on puhdas vesikanava (AqpZ) ja toinen glyserolikanava (GlpF), tarjosi meille ainutlaatuisen tilaisuuden ymmärtää luonnon käyttämiä valikoivuusperiaatteita, kun se käyttää kahta geneettisesti ja rakenteellisesti hyvin homologista kanavaa erilaisten materiaalien kuljettamiseen kalvoissa.Glyserolin kulkeutumiselle näissä kahdessa kanavassa laskettujen esteiden vertailu osoitti, että AqpZ:n rakenne käyttää hyväkseen steriilisiä esteitä vaikeuttaakseen glyserolin läpipääsyä. Itse asiassa huokos on kaiken kaikkiaan kapeampi kuin GlpF (ks. alla oleva kuva). Näyttää siltä, että luonto on turvautunut hyvin perustavanlaatuiseen mekanismiin, nimittäin kanavan huokoskoon säätämiseen, jotta kahdella samaan perheeseen kuuluvalla proteiinilla olisi erilaiset johtumisominaisuudet. Lue koko juttu artikkelista Wang, etal., STRUCTURE, 2005.
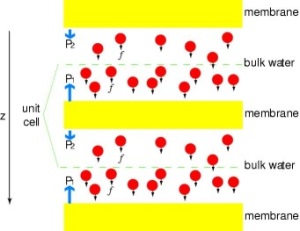
Putting Channels under Pressure
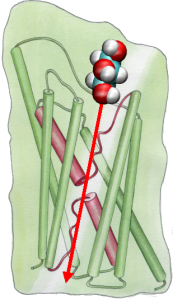
Vertaillaksemme suoraan MD-simulaatioiden tuloksia biokemiallisiin mittauksiin, jotka on tehty membraanisten vesikanavien johtokyvystä, joissa osmoottisia painegradientteja käytetään veden virtauksen indusoimiseksi membraanin poikki, kehitimme MD-simulaatioita varten uudenmenetelmän. Kun vesimolekyyleihin kohdistetaan pieniä voimia irtotavaran alueella (ks. kuva), luodaan hydrostaattinen painegradientti kalvon yli. Painegradientti aiheuttaa johtumisnopeuksia, joita voidaan tutkia MD-simulaatioilla, jotka yleensä rajoittuvat muutamaan nanosekuntiin. Menetelmää on sovellettu simuloitaessa veden läpäisyä GlpF:n läpi, ja tuloksena on saatu lineaarinen korrelaatio käytetyn paineen ja virtauksen välillä (Zhu et al.,Biophys. J., 2002).
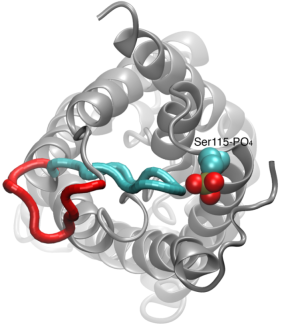
Vesikanavien sulkeminen
Veden permeaatio akvaporiinien läpi on passiivinen prosessi, joka seuraa osmoottisen paineen suuntaa kalvon yli. Vaikka monet akvaporiinit toimivat aina auki olevina kanavina, eräässä akvaporiinien alaryhmässä, erityisesti kasveissa, on kehittynyt kehittynyt hienostunut molekulaarinen mekanismi, jonka avulla kanava voidaan sulkea vasteena ympäristön ankarille olosuhteille, joissa veden vaihtuminen voi olla haitallista organismille. Esimerkkejä tällaisista olosuhteista ovat kuivuusstressi ja tulviminen, jotka laukaisevat tiettyjä solusignaaleja (defosforylaatio ja pH:n muutos), jotka johtavat kanavan sulkeutumiseen. Pinaatista peräisin olevan akvaporinin hiljattain ratkaistua rakennetta simuloitiin eri olosuhteissa, jotta voitiin tutkia näiden kalvokanavien sulkemisen molekyylimekanismia. Havaittiin, että pitkänomainen sytoplasmasilmukka sulkeutuu sulkeutumiskykyisissä akvaporiineissa fysikaalisesti suljetun kanavan vesihuokosen sisäänkäyntiin ja estää vesimolekyylien pääsyn huokosiin. Tämän silmukan siirtyminen vasteena fosforylaatioon, kuten simulaatioissa havaittiin, poistaa silmukan huokosen sytoplasmisesta sisäänkäynnistä. Lisäksi hydrofobinen aminohappo, joka on konformaatioltaan tiiviisti sidoksissa tähän silmukkaan, vetäytyy takaisin kanavasta silmukan siirtymisen seurauksena. Yhdessä nämä molekyylitapahtumat johtavat avoimeen kanavaan, joka on vesimolekyylien läpäisevä. Tutkimus julkaistiin Nature2006 -lehdessä.

Tetrameerisen huokosen sulkeminen ja ionijohtokyky
AQP:t tunnetaan yleisesti niiden korkeasta vedenläpäisevyydestä. Niiden osallisuutta muihin solutoimintoihin, kuten muiden pienten molekyylien kuin veden läpäisyyn sekä solu-solu-viestintään, on kuitenkin ehdotettu. Tetramerisaatio on AQP:iden yleinen rakennepiirre. Se, että neljä monomeeria muodostavat kukin toiminnallisesti riippumattoman vesihuokosen, mutta vaativat tetrameerisen organisaation toimiakseen, viittaa oligomerisaatiosta saatavaan synergistiseen hyötyyn ja pakottaa näin ollen analysoimaan tarkemmin AQP:iden keskushuokosen mahdollista roolia. Mielenkiintoinen ehdotus on keskushuokosen mahdollinen osallistuminen ionijohtumiseen cGMP:n aktivoituessa. Olemme tutkineet tätä AQP1:n ominaisuutta käyttämällä AQP1:n kalvoon upotettujen mallien MD-simulaatioita selvittääksemme, miten ja millaisissa muodonmuutos- ja hydrataatio-olosuhteissa keskeinen huokos saattaa johtaa ja miten johtavuutta säädellään. Yksi sytoplasmisista silmukoista, nimittäin arginiinirikas silmukka D, ehdotettiin tutkimuksissamme olevan avainasemassa cGMP-välitteisessä keskushuokosen aktivoinnissa. Silmukan D ehdotettu rooli todennettiin kokeellisesti silmukan D suunnitellulla mutantilla, joka osoitti ionijohtavuuden täydellistä häviämistä ( Yu et al.,Structure, 2006 ).
Kaasumolekyylit kulkevat soluun
Joka aamu monet ihmiset ajavat töihin autolla, toiset taas pyöräilevät, kulkevat bussilla tai metrolla.Vastaavasti myös ihmiskehossa olevat erilaiset biomolekyylit kulkevat määränpäähänsä monin eri tavoin. Esimerkiksi solukalvon ylittämiseksi pienet hydrofobiset kaasumolekyylit diffundoituvat lipidikerroksen läpi, kun taas vesimolekyylit kulkevat akvaporiinien (AQP) kautta.Mielenkiintoista on, että aivan kuten ihminen voi päästä töihin sekä bussilla että autolla, on äskettäin havaittu, että joillakin kaasumolekyyleillä voi olla useampi kuin yksi tapa kulkea kalvon läpi, ts, lipidien läpi tapahtuvan diffuusion lisäksi myös happi ja hiilidioksidi voivat kulkea AQP:ien läpi. näiden kaasumolekyylien kulkureitit ovat kuitenkin jääneet hämärän peittoon. olemme tutkineet NAMD:llä suoritetun molekyylidynamiikan avulla AQP1:n kaasunläpäisevyyttä kahdella toisiaan täydentävällä menetelmällä (eksplisiittinen kaasudiffuusiosimulointi ja implisiittinen ligandien näytteenotto). Simulointitulokset viittaavat siihen, että vaikka AQP1:n neljämonomeeriset huokoset toimivat vesikanavina, AQP1:n keskimmäinen huokos voi toimia kaasumolekyylien reittinä kalvon läpi (Wang et al., Journal of Structural Biology, 2007 ).
Molekyylinen estekurssi
Biologiset solut suojaavat sisuskalujaan solukalvojensa avulla, mutta ovat kuitenkin riippuvaisia ravintoaineiden tuonnista. Ne ovat kehittäneet tätä tuontia varten nopeita johtokanavia, jotka sisältävät luotettavia tarkistuspisteitä, jotka erottavat toisistaan halutut ja ei-toivotut yhdisteet. Tarkastuspiste asettaa todellisen esteen, jonka vain oikeat yhdisteet pääsevät nopeasti läpi. Kanavien rakenteen ymmärtäminen on vaikeaa, koska ravinteiden dynamiikasta ei ole yksityiskohtaista kokeellista tietoa. Tällä hetkellä yksityiskohtaisimmat tiedot saadaan tarkastelemalla kanavan dynamiikkaa laskennallisesti staattisista kiderakenteista lähtien. Tuoreessa tutkimuksessa tutkittiin, miten glyserolit, joidenkin bakteerien tarvitsemat pienet ravinnemolekyylit, kulkevat glyserolikanava GlpF:n kautta toteutettujen tarkastuspisteiden läpi. GlpF tarjoaa neljä rinnakkaista kanavaa, joita seurattiin laskennallisesti käyttäen NAMD:tä ja uutta algoritmia, joka tutkii kanavan energetiikkaa riittävän nopeasti, jotta se on menetelmällisesti toteutettavissa nykyisillä tietokoneilla. Tulokset osoittavat, miten glyserolin fysikaalisia ominaisuuksia, kykyä muodostaa niin sanottuja vetysidoksia, sähköisiä dipolimomentteja, diffuusioliikkuvuutta ja luontaista joustavuutta luodataan kanavaa pitkin (Henin et al., Biophysical Journal, painossa ).
Aquaporin-tutkimuksemme uutisissa
|
Aquaporin Team
|
Julkaisut
-//W3C//DTD XHTML 1.0 Transitional//EN” ”http://www.w3.org/TR/xhtml1/DTD/xhtml1-transitional.dtd”>Publications Database Diffusion of glycerol through Escherichia coli aquaglyceroporin GlpF.Jerome Henin, Emad Tajkhorshid, Klaus Schulten, and Christophe Chipot. Biophysical Journal, 94:832-839, 2008. Exploring gas permeability of cellular membranes and membrane channels with molecular dynamics (Solukalvojen ja kalvokanavien kaasunläpäisevyyden tutkiminen molekyylidynamiikalla).Yi Wang, Jordi Cohen, Walter F. Boron, Klaus Schulten ja Emad Tajkhorshid. Journal of Structural Biology, 157:534-544, 2007. Aquaporin-1:n mahdollisen tetrameerisen huokosen porttimekanismi ja ionijohtokyky.Jin Yu, Andrea J. Yool, Klaus Schulten ja Emad Tajkhorshid. Structure, 14:1411-1423, 2006. Rakenteellinen mekanismi kasvien akvaporinin portin avautumisessa.S. Törnroth-Horsefield, Y. Wang, K. Hedfalk, U. Johanson, M. Karlsson, E. Tajkhorshid, R. Neutze ja P. Kjellbom. Nature, 439:688-694, 2006. Mikä tekee akvaporinista glyserolikanavan: Yi Wang, Klaus Schulten ja Emad Tajkhorshid. Structure, 13:1107-1118, 2005. Yksikanavaisen vedenkuljetuksen kineettinen teoria ja simulointi.Emad Tajkhorshid, Fangqiang Zhu ja Klaus Schulten. In S. Yip, editor, Handbook of Materials Modeling, Vol. I: Methods and Models, pp. 1797-1822. Springer, Alankomaat, 2005. Towards understanding membrane channels.Emad Tajkhorshid, Jordi Cohen, Aleksij Aksimentiev, Marcos Sotomayor, and Klaus Schulten. In Boris Martinac and Andrzej Kubalski, editors, Bacterial ion channels and their eukaryotic homologues, pp. 153-190. ASM Press, Washington, DC, 2005. Collective diffusion model for water permeation through microscopic channels.Fangqiang Zhu, Emad Tajkhorshid, and Klaus Schulten. Physical Review Letters, 93:224501, 2004. (4 sivua). Computational studies of membrane channels.Benoit Roux ja Klaus Schulten. Structure, 12:1343-1351, 2004.