Pääasiallinen ero – Stereinen vs. vääntöjäykkyys
Stereinen ja vääntöjäykkyys on molekyylin sidoselektronien välinen repulsio. Molekyylin järjestäytyminen riippuu strainista, koska sidoselektroniparit järjestäytyvät siten, että strain minimoituu. Molekyylissä voi esiintyä kolmenlaisia jännityksiä. Ne ovat kulmajännitys, vääntöjännitys ja steerinen jännitys. Kulmajännitystä esiintyy, kun todellisten molekyylien sidoskulmat poikkeavat ideaalisten molekyylien sidoskulmista. Vääntöjännitys syntyy, kun molekyyli kiertyy sidoksen ympäri. Stereinen jännitys syntyy, kun kaksi tai useampi tilaa vievä ryhmä joutuu lähelle toisiaan. Tärkein ero steerisen ja vääntöjännityksen välillä on se, että steeristä jännitystä ei voida vähentää pyörittämällä molekyyliä sidoksen ympäri, kun taas vääntöjännitystä voidaan vähentää pyörittämällä molekyyliä sidoksen ympäri.
Keskeiset käsiteltävät aihealueet
1. Mikä on Steric Strain
– Määritelmä, selitys esimerkkeineen
2. Mikä on Torsional Strain
– Määritelmä, selitys esimerkkeineen
3. Mikä ero on Steric ja Torsional Strain
– Keskeisten erojen vertailu
Keskeiset termit: Angular Strain, Bond Electron Pair, Steric Strain, Torsional Strain

Mitä on Steric Strain
Steric Strain on kahden atomin tai atomiryhmän välinen repulsio, kun niiden välinen etäisyys pienenee. Tätä kutsutaan myös steeriseksi esteeksi. Stereinen rasitus on erittäin tärkeä molekyylin järjestäytymisen määrittelyssä, sillä jokainen molekyyli järjestetään siten, että steerinen rasitus on mahdollisimman pieni. Kun steerinen rasitus on minimoitu, kyseisen molekyylin potentiaalienergia pienenee. Koska aine on stabiilia, kun sen energiataso on alhaisempi, molekyylin alhaisempi energiataso tekee siitä stabiilin molekyylin.
Sterisen rasituksen käsite on hyvin tärkeä kemiallisen reaktion tuotteiden ennustamisessa. Tämä johtuu siitä, että atomiryhmät kiinnittyvät hiiliatomiin siten, että steerinen este on mahdollisimman pieni. Siksi kemiallisesta reaktiosta syntyy molekyylien seos, jossa on mukana stabiileja tuotteita ja epästabiileja tuotteita. Mutta tämän seoksen pääkomponentti on aina stabiili tuote, jonka steerinen este on minimoitu.

Kuva 1: Sterinen este orgaanisissa yhdisteissä
Kuten yllä olevasta kuvasta nähdään, molekyylin potentiaalienergia kasvaa sen mukaan, kuinka suuri steerinen este niillä on. Kun kahden metyyliryhmän välinen etäisyys pienenee, potentiaalienergia kasvaa.
Kuva 2: Sterinen kanta kasvaa, kun bulkkiryhmiä on läsnä
Yllä olevasta kuvasta nähdään, että sterinen kanta kasvaa, kun bulkkiryhmiä on läsnä. Sterisesti estyneemmillä molekyyleillä on korkeampi potentiaalienergia verrattuna vähemmän sterisesti estyneisiin molekyyleihin. Siksi vähemmän steriilisesti estyneet molekyylit ovat vakaampia.
Mitä on vääntöjännitys
Vääntöjännitys on repulsio, joka syntyy atomien tai atomiryhmien välille, kun molekyyliä pyöritetään sigmasidoksen ympäri. Tämä on repulsio, joka voidaan havaita, kun sidoksen elektronit kulkevat toistensa ohi. Tämäntyyppinen jännitys on tärkeää orgaanisten yhdisteiden stabiilien konformaatioiden määrittämisessä. Nämä konformaatiot voidaan esittää Newmanin projektioiden avulla. Molekyylin Newman-projektio on kyseisen molekyylin konformaatio, kun sitä tarkastellaan C-C-sidoksen läpi etu-taakse-suunnasta.
Vääntöjännitys syntyy, kun tilaa vievien ryhmien kaksipuoliset kulmat ovat pienet. Dihedraalikulma on kahden eri hiiliatomin kahden sidoksen välinen kulma Newman-projektiossa. Jos dihedraalikulma on suuri, vääntöjännitys on pieni.
Newman-projektioita esiintyy kahta tyyppiä, jotka ovat porrastettu konformaatio ja pimenevä konformaatio. Eclipsed-konformaatiossa vääntöjännitys on suurempi kuin staggered-konformaatiossa.
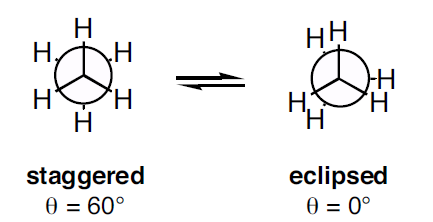
Kuva 3: Kaksi Newman-projektiotyyppiä
Kuten yllä olevasta kuvasta nähdään, staggered-konformaatiossa dihedraalikulma on 60o ja eclipsed-konformaatiossa dihedraalikulma on 0o. Mutta kun molekyyliä kierretään, konformaatio muuttuu. Vääntöjännitys porrastetussa konformaatiossa on pienempi kuin pimenneessä konformaatiossa. Kun molekyyliä kierretään, eclipsed-konformaatio voi muuttua staggered-konformaatioksi; näin vääntöjännitys pienenee.
Sterisen ja vääntöjännityksen ero
Määritelmä
Sterinen jännitys: Stereinen rasitus on kahden atomin tai atomiryhmän välinen repulsio, kun niiden välinen etäisyys pienenee.
Torsionaalinen rasitus: Vääntöjännitys on atomien tai atomiryhmien välille syntyvä repulsio, kun molekyyliä kierretään sigmasidoksen ympäri.
Molekyylin kierto
Sterinen jännitys: Stereistä rasitusta ei voida vähentää pyörittämällä molekyyliä sigmasidoksen ympärillä.
Torsionaalinen rasitus: Torsional strain can be lessed by rotating the molecule around a sigma bond.
Cause for the Strain
Steric Strain: Stereinen rasitus syntyy, kun molekyylin tilaa vievien ryhmien välinen etäisyys pienenee.
Torsionaalinen rasitus: Vääntöjännitys tapahtuu, kun sidoselektronit kulkevat toistensa ohi molekyylin pyöriessä.
Johtopäätös
Molekyylin jännitys on kyseisessä molekyylissä esiintyvien sidoselektronien tai yksinäisten elektroniparien välinen repulsio. Tämä repulsio aiheuttaa sen, että molekyylin potentiaalienergia kasvaa. Silloin se tekee molekyylistä epävakaan. Molekyylin steerinen rasitus määräytyy molekyylissä olevien bulkkiryhmien ja näiden bulkkiryhmien välisen etäisyyden perusteella. Newmanin projektio on yksinkertainen rakenne, joka osoittaa atomien tai atomiryhmien sijoittumisen orgaanisessa molekyylissä. Sitä voidaan käyttää molekyylin vääntöjännityksen määrittämiseen. Tärkein ero steerisen ja vääntöjännityksen välillä on se, että steeristä jännitystä ei voida pienentää kiertämällä molekyyliä sidoksen ympärillä, kun taas vääntöjännitystä voidaan pienentää kiertämällä molekyyliä sidoksen ympärillä.
1. ”Torsionaalinen rasitus”. OChemPal, Saatavissa täältä. Accessed 28 Aug. 2017.
2. ”Strain (Chemistry).” Wikipedia, Wikimedia Foundation, 25. heinäkuuta 2017, Saatavissa täältä. Accessed 28 Aug. 2017.
3. ”Dihedral Angle”. OChemPal, Saatavissa täältä. Accessed 28 Aug. 2017.
Image Courtesy:
1. ”Napthalene phenanthraene methyl-methyl strai” By DMacks – Own work (Public Domain) via Commons Wikimedia
2. ”Steric hindrance disp” By Mwolf37 – Own work (CC BY-SA 3.0) via Commons Wikimedia
3. ”Escalonada e eclipsada” By Pauloquimico – Own work (CC BY-SA 3.0) via Commons Wikimedia
![]()