Nämä ovat muistiinpanoja Harvard Extensionin solubiologian kurssin luennolta 4.
Erittymisreitillä tarkoitetaan endoplasmista retikulumia, Golgin laitteistoa ja niiden välillä kulkevia vesikkeleitä sekä solukalvoa ja lysosomeja. Se on nimetty ”sekretoriseksi”, koska se on reitti, jonka kautta solu erittää proteiineja solunulkoiseen ympäristöön. Mutta kuten tavallista, etymologia kertoo vain murto-osan tarinasta. Tämä reitti käsittelee myös proteiineja, jotka sitoutuvat kalvoihin (joko solukalvoon tai itse ER- tai Golgi-kalvoihin), sekä lysosomaalisia entsyymejä ja myös kaikkia proteiineja, jotka elävät elämänsä itse sekretorisessa reitissä. Se tekee myös joitakin muita asioita kuin käsittelee proteiineja.
Sytosoli ja ”lumen” (neste, joka täyttää erittymisreitin) ovat erilaisia kemiallisia ympäristöjä, eivätkä ne yleensä koskaan sekoitu keskenään. Sytosoli on reduktiivinen (kun olet sytosolissa, tapaat jatkuvasti molekyylejä, jotka haluavat tarjota sinulle elektroneja), ja ER, Golgi ja solunulkoinen ympäristö ovat oksidatiivisia (molekyylit tulevat jatkuvasti luoksesi pyytämään elektroneja). Katso redox, jos olet vielä hämmentynyt. Tämä johtaa erilaisiin proteiinien taittumisolosuhteisiin: esimerkiksi disulfidisidoksia muodostuu yleensä vain oksidatiivisissa olosuhteissa. Lisäksi eri proteiinit voivat elää vain eritysreitillä tai vain sytosolissa. Eritysreitti tarjoaa solulle väylän käsitellä asioita, joita ei ehkä ole hyvä pitää sytoplasmassa ja/tai jotka ovat hyödyllisimpiä, kun ne pidetään keskittyneinä erikoistuneeseen lokeroon haluttujen vuorovaikutuskumppaneidensa kanssa. Hepatosyytit (maksassa) sitovat lääkkeet ja toksiinit sileään ER:ään ja hajottavat ne siellä elimistöstä erittymistä varten. Erittymisreitti ei ole yhtenäinen, vaan kaikki sen osien väliset liikkeet tapahtuvat sen oman kemiallisen maailman pienissä kuplivissa mikrokosmoksissa, joita kutsutaan vesikkeleiksi.
Monet proteiinit, jotka kulkevat erittymisreitin läpi, eivät koskaan kosketa sytosolia – lukuun ottamatta kalvoproteiinien osia, jotka työntyvät ulos sytosolin puolelle. Monet niistä tarvitsevat chaperoneja taittumisen avuksi ja/tai koko joukon posttranslationaalisia modifikaatioita ollakseen valmiita natiiviin tehtäväänsä, ja sekretorinen reitti on erikoistunut tarjoamaan niille kaiken tämän.
Tämän päivän luennolla keskitytään siihen, miten proteiinit käännetään ER:ään ja miten ne kulkevat (vesikkeleissä) ER:n, Golgin ja muiden määränpäiden välillä. Tämä on kuvattu kauniisti Solun elämä -videolla:
Endoplasminen retikulum on erittymisreitin ensimmäinen vaihe. Sen kalvo on jatkuva ulomman ydinkalvon kanssa, vaikka ei ole selvää, miksi sillä on merkitystä, koska proteiinit eivät aloita elämäänsä ytimessä. Pikemminkin mRNA:t ajelehtivat sytoplasmassa, kunnes ribosomi, joka on kiinnostunut kääntämään ne, tarttuu niihin. Posttranslationaalisessa translokaatiossa uusi proteiini siirretään ER:ään sen jälkeen, kun se on käännetty. Kiinnostavammassa ilmiössä, jota kutsutaan ”cotranslationaaliseksi translokaatioksi”, ribosomi aloittaa translaation aivan kuten mikä tahansa muukin proteiini, mutta jossain ensimmäisten 16-30 aminohapon kohdalla se osuu signaalipeptidiin (eli signaalisekvenssiin). Tämän signaalin motiivi on usein 1 positiivisesti varautunut aminohappo, jota seuraa 6-12 hydrofobista aminohappoa. Tämän motiivin tunnistaa signaalintunnistuspartikkeli (SRP, ”ribonukleoproteiini” eli RNA/proteiinihybridi), joka sitoutuu siihen ja estää ribosomia jatkamasta translaatiota. Translaatio pysähtyy, kunnes ribosomi/SRP-kompleksi kohtaa SRP-reseptorin ER-kalvolla. Kun ne kohtaavat, SRP ja sen reseptori sitovat kumpikin yhden GTP-molekyylin ER-kalvolla, mikä ilmeisesti vahvistaa niiden vuorovaikutusta. Onneksi tämä kaikki tapahtuu Sec61-translokonin vieressä – proteiinikompleksin, joka muodostaa kanavan ER-kalvon läpi. Translokoni on itse asiassa kolmen eri proteiinin (geenit: SEC61A1 tai SEC61A2, SEC61B, SEC61G) muodostama kompleksi, joista Sec61a-alayksikössä on 10 kalvon ylittävää a-heliksiä, jotka muodostavat kanavan. Kun ribosomi on telakoitunut kalvoon, se jatkaa translaatiota ja työntää signaalipeptidin ja lopulta koko proteiinin kanavan läpi ER:n luumeniin. Kun translaatio pysähtyy, SRP ja SRP-reseptori hydrolisoivat molemmat GTP:nsä vapauttaakseen toisensa ja ribosomin lastin (tämän täytyy vaatia GTP:n energiaa, koska alkuperäinen sitoutuminen tapahtui alamäkeen), signaalipeptidaasi pilkkoo signaalipeptidin irti syntymässä olevasta proteiinista, ja proteiini on vapaa aloittamaan taittumisensa ER:ssä.
Joidenkin ER:ssä olevien proteiinien kohdalla on mukana pari muutakin toimijaa. Oligosakkariditransferaasi, joka lisää glykosyyliryhmiä nasentoituvan proteiinin asparageeneihin, on osa translokonikompleksia, ja se itse asiassa suorittaa glykosylaation, kun uutta proteiinia vielä käännetään. Vaikka kutsumme glykosylaatiota ”posttranslationaaliseksi modifikaatioksi”, se tehdään tässä tapauksessa translaation aikana. Oikean rakenteensa saavuttamiseksi joidenkin proteiinien on myös oltava kokonaan käännetty, ennen kuin niiden annetaan alkaa taittua – jos N-terminaalisen osan annettaisiin alkaa taittua heti, kun se pääsee lumeniin, se saisi vääränlaisen kokonaisrakenteen. Tämän estämiseksi chaperoni BiP sitoo joskus proteiinia pitääkseen sen jonkin aikaa taittumattomana. Kuvittele BiP toiseksi Pac-Maniksi, joka pureutuu proteiiniin pitääkseen sen lineaarisena, kuten Hsc70 mitokondrioiden kohdentumisprosessissa (ks. viime viikolla).
Tässä on video siitä:
Pari ensimmäistä minuuttia näyttää edellä kuvatun perusskenaarion. Sitten siirrytään monimutkaisempaan skenaarioon, jonka esittelen hetken kuluttua. Tiedoksi, videolla kuvataan kaksi ”kiistanalaista” asiaa, jotka eivät sisälly yllä olevaan kuvaukseen: (1) signaalipeptidin hajoaminen kalvossa ja (2) ”tulppaproteiini”, joka tukkii kanavan ennen/jälkeen translaation. Näistä kahdesta asiasta kaikki tutkijat eivät ole vielä samaa mieltä.
Kaikki proteiinit, joiden tiedämme kulkevan erittymisreitin kautta, paikallistettiin sinne ihmisten toimesta, jotka tekivät lokalisaatiokokeita nähdäkseen, missä päin solua proteiini sijaitsee. ER:ää koskeva outo seikka on se, että solun voi laittaa tehosekoittimeen, ja sen jälkeen ER alkaa vain liittyä uudelleen itseensä muodostaen pieniä ”mikrosomeja”, jotka eivät ole kiinni ytimessä vaan muodostavat yhtenäisiä ER-kuplia. Sen jälkeen voidaan alkaa leikkiä proteaaseilla – jotka hajottavat proteiineja – ja detergenteillä – jotka liuottavat ER-kalvoa. Olettaen, että kiinnostava proteiinisi on käännetty, voit tarkistaa, että jos se (1) selviää proteaasikäsittelystä, mutta (2) ei selviä proteaasi + detergentti -käsittelystä, se on eritysreitin proteiini. Logiikka on se, että tapauksessa (1) se oli suojattu ER:n sisällä, mutta tapauksessa (2) liuotit ER:n, joten proteaasi söi sen. Kaikki tämä edellyttää, että sinulla on vasta-aine tai jokin muu keino havaita, onko kiinnostava proteiini siellä näiden käsittelyjen jälkeen.
Tällaisia tekniikoita käytettiin myös sen selvittämiseen, että vain 70 aminohappoa uudesta proteiinista voidaan kääntää, ennen kuin on liian myöhäistä, että proteiini päätyy ER:ään. Muista, että signaalipeptidi on ensimmäisissä 16-30 aminohapossa, ja translokaatio ER:ään riippuu SRP:n läsnäolosta. Ribosomit kääntävät ennustettavalla nopeudella, joten ihmiset saivat ribosomit aloittamaan jonkin mRNA:n kääntämisen ja odottivat sitten määrättyjä aikoja ennen SRP:n lisäämistä nähdäkseen, kuinka paljon translaatiota voisi tapahtua ennen kuin SRP ei enää pystyisi tekemään työtään.
SRP-reseptori ja Sec61-proteiinit ovat ER:n kalvoproteiineja – ja on olemassa monia muitakin ER:n kalvoproteiineja, Golgin kalvoproteiineja ja lysosomin kalvoproteiineja. Itse asiassa jopa solukalvon kalvoproteiinit (ks. luokka 02) prosessoituvat eritysreitillä. Monissa näistä proteiineista on useita tai kymmeniä transmembraanidomeeneja (20-25 hydrofobista aminohappoa kukin), jotka on asetettava oikeassa järjestyksessä ja oikeassa orientaatiossa (esimerkiksi ionikanavien ja -kuljettajien halutaan todella suuntautuvan oikeaan suuntaan, solun sisään ja solun ulkopuolelle). Näin ollen on olemassa joukko hienoja biologisia mekanismeja, joilla nämä proteiinit saadaan asetettua kalvoon oikein. Tätä kuvaa yllä olevan videon jälkimmäinen puolisko.
Tässä on siis tautologia: joillakin proteiineilla on topogeeninen sekvenssi, joka määrää niiden orientaation kalvossa. Tämä sekvenssi koostuu kahdentyyppisistä signaalisekvensseistä:
- Stop-transfer-sekvenssi (jostain syystä lyhennettynä STA) on 22-25 hydrofobisen aminohapon sekvenssi jossain proteiinin keskellä, joka muodostaa alfakierteen. Kun se kohdataan, se työntyy kalvoon, minkä jälkeen proteiinin muun osan translaatio jatkuu sytosolissa. Tämä siis tavallaan ”kumoaa” translokaation ER:ään, jonka proteiinin alussa (N-terminaalissa) oleva signaalipeptidi aloitti.
- Signaaliankkurisekvenssi (lyhenne SA) on myös 22-25aa hydrofobinen alfakierre, mutta sen vasemmalla tai oikealla puolella on ~3 positiivisesti varautuneen aminohapon sarja. Kuten signaalipeptidi, tämäkin tunnistetaan SRP:n toimesta, joka tuo ribosomin ER:ään. Mutta toisin kuin signaalipeptidi, tämä alfa-kierteinen sekvenssi asettuu ER-kalvoon. Insertion suunta määräytyy kolmen positiivisesti varautuneen aminohapon perusteella. Positiivisten varausten on aina päätyttävä sytosolin puolelle, joten jos ne tulevat hydrofobisen sekvenssin jälkeen (eli C-terminaalisesti), proteiinin C-terminaalinen pää osoittaa sytosoliin, mutta jos ne tulevat ennen hydrofobista sekvenssiä (eli N-terminaalisesti), proteiinin N-terminaalinen pää osoittaa sytosoliin.
Näiden kahden signaalin ollessa rakennuspalikoina voi kuvitella proteiinin, jossa on sarja pysäytyssiirto- ja signaaliankkurisekvenssejä, joilla luodaan kokonainen sarja edestakaisia transmembraanidomeeneja, jotka on ommeltu kalvoon kuin ompelukoneella. Ihmiset ovat luokitelleet kalvoproteiinit viiteen luokkaan:
- Tyyppi I:ssä on vain signaalipeptidi ja sitten yksi stop-siirto keskellä. Siksi sen (hydrofiilinen) N-terminaali päätyy luumeniin, (hydrofobinen) keskiosa kalvoon ja (hydrofiilinen) C-terminaali sytosoliin.
- Tyyppi II ei aloita signaalipeptidillä. Se alkaa kuten mikä tahansa muu proteiini, mutta sen keskellä on signaaliankkurisekvenssi, jossa +++ aminohapot tulevat ensin ja hydrofobinen sarja sen jälkeen. Tämä saa proteiinin siirtymään kesken käännöksen, jolloin jo käännetty N-terminaalinen osa työntyy ulos sytosoliin (koska +++:n on pysyttävä sytosolissa) ja nyt kääntymässä oleva C-terminaalinen osa käännetään suoraan ER:ään. Näin se päätyy transmembraaniseksi siten, että sen C-terminaali on ER:ssä ja N-terminaali sytosolissa – päinvastoin kuin tyypissä I.
- Tyyppi III on kuin tyyppi II – ei signaalipeptidiä, vain signaaliankkuri keskellä, mutta tässä tapauksessa +++ tulee hydrofobisen sekvenssin jälkeen, mikä kääntää orientaation. Näin sen N-terminaali päätyy ER:ään ja C-terminaali sytosoliin. Tyypin II vastakohta ja lopulta sama kuin tyypin I, vaikka se on päässyt sinne eri tavalla – sillä ei ole signaalipeptidiä, joka pilkotaan irti ER:ssä.
- Tyypin IV eli ”multipass”-proteiineissa on vuorotteleva sarja signaalisekvenssejä ja pysäytyssiirtosekvenssejä. Näitä on selvästi enemmän kuin yksi ”tyyppi”, mutta ne eivät silti ole läheskään niin erilaisia kuin kombinatorinen mielikuvituksesi sallii. Ensimmäisen signaalisekvenssin orientaatio määrää, päätyykö N-terminaali sytosoliin vai ER:ään, ja pysäytyssiirtosekvenssien + signaaliankkurisekvenssien kokonaislukumäärä määrää, minne C-terminaali päätyy: parillinen lukumäärä = samalle puolelle kuin N-terminaali, pariton lukumäärä = vastakkaiselle puolelle kuin N-terminaali. STA- ja SA-sekvenssien on ehdottomasti vuorotteleva, lukuun ottamatta sitä poikkeusta, että voidaan aloittaa kahdella signaaliankkurisekvenssillä, jos ensimmäinen niistä suuntautuu N-terminaalin kanssa sytosoliin. Tämän luokittelujärjestelmän pilkaksi ihmiset ovat määritelleet joitakin epätäydellisesti määriteltyjä tyypin IV alatyyppejä, joissa tyyppi IVa on N-terminaalisesti sytosolissa (joten se alkaa kuten tyypin II proteiini) ja tyyppi IVb on N-terminaalisesti luumenissa (se alkaa kuten tyypin III proteiini, mutta sillä on sitten toinen SA-sekvenssi, joka vie sen takaisin ER:ään). GLUT1 luokasta 02 on tyyppi IVa.
- GPI-ankkuroituneet proteiinit, jotka ovat viides tyyppi, mutta joita ei kutsuta tyypiksi V, alkavat signaalipeptidillä ja päättyvät hydrofobiseen C-terminaaliin, joka pysyy upotettuna kalvoon. Tämä hydrofobinen pää pilkotaan irti ja korvataan GPI:llä, joka myös pysyy kiinni kalvossa. PrP on yksi näistä – siitä lisää myöhemmin.
Tähän mennessä olemme keskustelleet siitä, miten proteiinit voivat päätyä ER:n luumeniin tai ulottua ER:n kalvon yli. Useimmat proteiinit poistuvat ER:stä muutamassa minuutissa, ne kulkeutuvat vesikkeleissä, jotka ovat sitoutuneet Golgiin ja myöhemmin erittymään, lysosomeihin tai solukalvolle. Tätä eteenpäin suuntautuvaa kulkua kutsutaan anterogradiksi; taaksepäin kulkeminen Golgista ER:ään on retrogradista kuljetusta.
Kummatkin kuljetustyypit tapahtuvat kalvoon sidotuissa vesikkeleissä. Nämä irtoavat sen kalvon kalvosta, josta ne ovat tulossa, ja sulautuvat myöhemmin sen kalvoon, jonne ne ovat menossa – kauniisti kuvattuna yllä olevalla Life of the Cell -videolla kohdassa ~2:25. Keho, josta vesikkelit muodostuvat, on ”luovuttajalokero”, ja kohde, johon ne myöhemmin fuusioituvat, on ”akseptorilokero”.
Nupoutumisprosessi edellyttää, että kalvossa olevat G-proteiinit rekrytoivat Coat-proteiinit. Erityisesti anterogradiseen kuljetukseen G-proteiini Sar1 (geeni: SAR1A) rekrytoi COPII:n (”cop two”); retrogradiseen kuljetukseen ARF G-proteiini rekrytoi COPI:n (lausutaan ”cop one”). Nämä G-proteiinit aktivoituvat tähän tehtävään, kun GEF lataa niihin GTP:tä ja vaihtaa GDP:n pois.
Vaiheet anterogradessa kuljetuksessa ovat siis esimerkiksi seuraavat:
- Sec12-GEF (Sec tarkoittaa sekretorista) lataa Sar1:een GTP:tä. Kun Sar1 on sidottu GDP:hen, se vain kelluu ympäri luovuttajakammiota, mutta kun se on sidottu GTP:hen, se kokee konformaatiomuutoksen, joka saa sen muutoin poltetun N-terminaalisen hydrofobisen hännän työntymään ulos, jolloin se tarttuu kalvoon, jossa COPII-proteiinit alkavat sitten kerääntyä, koska ne todella pitävät tuosta hännästä.
- COPII-proteiinit alkavat polymerisoitua, ja konformaationsa vuoksi niillä on luontainen mieltymys kaareutumiseen, joten niiden kerääntyminen alkaa saada aikaan nuppuuntumista. Samaan aikaan kalvoon sidotut proteiinit, joita on kuljetettava – jotka tunnistetaan DXE-aminohapposekvenssillä (eli aspartaatti-jotain-glutamaatti), joka muodostaa sitoutumiskohdan niiden sytosolisessa osassa – rekrytoituvat vasta muodostuvaan vesikkeliin. Kalvoon sitoutuneet proteiinit toimivat reseptoreina, jotka rekrytoivat Golgiin sitoutuneita lumenin proteiineja roikkumaan koveraan tilaan, josta ne päätyvät vesikkeliin sen muodostuttua.
- Kun tarpeeksi COPII:ita on saapunut, vesikkeli irtoaa, jolloin Sar1 hydrolysoi GTP:nsä, mikä antaa sille energiaa imeä hydrofobisen pyrstönsä takaisin itseensä ja katkaista COPII:t irti. Vesikkeli on nyt irrotettu luovuttajakompartimentista.
- Nyt, huonosti selitetyistä (tai huonosti ymmärretyistä?) syistä, COPII:iden kuori vain hajoaa, paljastaen kuoren alla olevat reseptorit, jotka ohjaavat vesikkelin kohdentumista. Kun vesikkeli saapuu määränpäähänsä, vesikkelin kalvoon upotettu Rab-GTP vuorovaikuttaa akseptorilokeron kalvoon upotetun Rab-efektorin kanssa. Sivusilmäys vaihtuu, kiinnostus herää. Pian vesikkeli sulautuu kalvoon.
- Sekä vesikkelin että kohteen kalvolla olevat SNARE-proteiinit (V-SNARE ja T-SNARE) vuorovaikuttavat toisiinsa ja tuovat kalvot vielä lähemmäksi toisiaan. Tässä esimerkissä pidämme VAMPia (VAMP_-geenit) V-SNAREnä ja Syntaxiinia (STX__-geenit) ja SNAP25:tä (SNAP25-geeni) T-SNAREina. Syntaxin ja SNAP25 ovat molemmat kalvoproteiineja; Syntaxinilla on yksi alfa-kierre ja SNAP25:llä kaksi, kaikki sytosolisella puolella. Alfa-kierteet ohjaavat vuorovaikutusta VAMPin kanssa. Vastakkaisten puolien alfaheliksillä on erittäin voimakas affiniteetti toisiinsa, mikä tuo kalvot niin lähelle toisiaan, että ne sulautuvat toisiinsa. Kun tämä on tapahtunut, V-SNAREn ja T-SNAREn erottaminen toisistaan vaatii jälleen kahta proteiinia: NSF (geeni: NSF; lyhenne sanoista NEM sensitive factor) ja alfa-SNAP (geeni: NAPA), joka on liukoinen NSF-kiinnitysproteiini. NSF on ATPaasi, ja se polttaa ATP:tä ajaakseen kompleksin energeettisesti ylämäkeen suuntautuvaa purkamista.
Nyt retrogradiseen kuljetukseen. Miksi retrogradista kuljetusta ylipäätään on olemassa? Tässä ei-tyhjentävä luettelo joistakin syistä:
- Jotkut kalvoproteiinit aloittavat elämänsä ER:ssä, joutuvat muokkautumaan Golgissa, mutta joutuvat sitten takaisin ER:ään. Ne tekevät tämän KKXX-aminohapposekvenssin avulla.
- Joidenkin lumenaalisten proteiinien C-terminaalissa on myös KDEL-aminohapposekvenssi, jonka oletetaan pitävän ne ER:ssä, mutta se ei ole täydellistä – joskus ne päätyvät Golgiin, jolloin ne suuntautuvat takaisin ER:ään retrogradisen kuljetuksen kautta, joka on riippuvainen tuosta KDEL-sekvenssistä tunnistamisen kannalta. Mekanismi on aika siisti – proteiinit, jotka tunnistavat KDEL:n ja sitoutuvat siihen, tekevät sen vain alhaisessa pH:ssa, ja Golgin pH on alhaisempi kuin ER:n, joten ne sitovat KDEL:n Golgissa ja vapauttavat sen sitten, kun ne palaavat takaisin ER:n neutraalimpaan pH:han.
- Ainakin, ajatelkaapa nyt, että kaikki proteiinit, jotka osallistuvat anterogradiin kuljettamiseen – V-SNARES, Rab jne. – on päästävä takaisin ER:ään, jotta ne voivat tehdä kaiken uudestaan, kuten bussin on päästävä takaisin linja-autovarikolle päivän päätteeksi.
- Kuten kohta näemme, Golgissa tulee useita vaiheita, jotka riippuvat entsyymien lisäämisestä kauempaa alavirtaan.
Takaisinpäin suuntautuva kuljetusprosessi ei eroa kovin paljon anterogradista. Siinä käytetään Sar1:n sijasta ARF:ää ja COPII:n sijasta COPI:tä, mutta se toimii samalla tavalla: GTP:llä ladattu ARF antaa hydrofobisen häntänsä tarttua kalvoon, jolloin COPI:t kiinnittävät huomiota. COPI:lla on kaksi komponenttia, COPIalfa ja COPIbeta, jotka molemmat ovat vuorovaikutuksessa KKXXX-sekvenssin kanssa rekrytoidakseen kalvoon sidottuja proteiineja, jotka on tarkoitettu retrogradiseen kuljetukseen. Joillakin proteiineilla on myös RR-sekvenssi (missä tahansa proteiinissa), joka voi merkitä ne retrogradiseen kuljetukseen.
Golgin laitteisto ei ole yhtenäinen. Se on päällekkäin pinottu joukko erillisiä alaosastoja, joita kutsutaan pusseiksi tai sakaroiksi. Eri lokeroilla on erilaisia ominaisuuksia ja proteiinit käyvät niissä tietyssä järjestyksessä. Järjestyksessä ER:stä solukalvoon Golgin lokeroita kutsutaan cis-, mediaali-, trans- ja trans-Golgi-verkostoksi. Jokaisessa lokerossa on erilaisia entsyymejä, jotka muokkaavat proteiineja, ja modifikaatioiden on tapahduttava tietyssä järjestyksessä, minkä vuoksi tarvitaan pinottuja lokeroita.
Mutta proteiinien kypsyessä Golgissa ei ole niin, että ne irtoavat vesikkeleissä yhdestä lokerosta ja siirtyvät seuraavaan. Pikemminkin se lokero, jossa ne jo ovat, siirtyy ulospäin ja ”kypsyy”, kun siihen lisätään uusia entsyymejä (kauempaa Golgin ketjusta) retrogradisen kuljetuksen kautta. Eikö olekin outoa? Vähän kuin jos sen sijaan, että muuttaisit peruskoulusta yläasteelta lukioon, pysyisit samassa koulurakennuksessa koko lapsuutesi ja nuoruutesi ajan, ja sinne vain tuotaisiin uusia oppikirjoja ja opettajia joka vuosi, jotta se vastaisi sitä luokka-astetta, jonka sinä ja luokkatoverisi olisitte nyt saavuttaneet. Golgit näyttävät tältä, kun ne liikkuvat ja kehittyvät:
Golgien sisällä ei siis ole (juurikaan tai ei lainkaan) anterogradista kuljetusta, mutta runsaasti retrogradista kuljetusta, joka tuo jokaisen uuden entsyymikierroksen sisään. Kun proteiinit ovat vihdoin suorittaneet Golgi-verkoston koko K-12-opintosuunnitelman, ne käyvät läpi kuljetuksen siirtyäkseen lopulliseen määränpäähänsä. Ne lähtevät vesikkelissä, joka menee yhteen kolmesta paikasta:
- Eksosytoosi – fuusio solukalvon kanssa. Näin luumenin proteiinit erittyvät solunulkoisesti ja kalvoproteiineista tulee solukalvoproteiineja.
- Sekretoriset vesikkelit – nämä vain pysyvät vesikkeleinä solussa, kunnes niitä tarvitaan – missä ”tarvitaan” tarkoittaa, että ne käyvät lopulta läpi eksosytoosin. Neuroneissa neurotransmitterit varastoituvat tänne, kunnes toimintapotentiaali vaatii niiden erittymistä synapsiin. Mahalaukussa mahalaukun entsyymejä tuottavat solut säilyttävät näitä entsyymejä sekretorisissa vesikkeleissä, kunnes ruuan nauttiminen käynnistää niiden vapautumisen mahalaukkuun.
- Lysosomit – minne väärin taitetut proteiinit menevät hajotettaviksi.
Kuljetus trans-Golgin verkostosta näihin määränpäihin poikkeaa muusta edellä käsitellystä kuljetuksesta, ja siihen osallistuu usein klatriini (CLT__-geenit). Irtautuvilla vesikkeleillä on kaksikerroksinen kuori, jossa adapteriproteiinikompleksit (AP) muodostavat sisemmän kerroksen ja klatriini ulomman kerroksen. Adapteriproteiineilla on kohdesignaali, jossa on YXXh-motiivi (h = Φ = mikä tahansa hydrofobinen aminohappo). Klatriini muodostaa niin sanotun ”klatriini-triskelion”-muodostuman, joka näkyy kuvassa:

(Kuva kiitos Wikimedia Commons -käyttäjä Phoebus87)
Klatriini vastaa myös endosytoosista eli solunulkoisen tavaran (ja solukalvoproteiinien) vesikkelien nuppuuntumisesta solun sisään. Tätä kutsutaan klatriinivälitteiseksi endosytoosiksi. Solukalvossa olevat reseptorit endosytoituvat hyvin usein: koko hormonireseptoripopulaatio vaihtuu noin tunnin välein, erityisesti silloin, kun hormoneja vastaanotetaan. Reseptorin ottaminen vesikkeliin on yksi tapa, jolla solu katkaisee saapuvan signaalin, kunnes se voidaan käsitellä.
Plasmakalvon muistiinpanoissa käsitellään lyhyesti kystistä fibroosia: CFTR on ABC-transportteri, joka vastaa Cl-:n pumppaamisesta ulos solusta (se päästää myös Na+:n sisään). Toimintakyvyttömät mutantit eivät pumppaa Cl-:tä, mikä poistaa osmoosin liikkeellepanevan voiman, sakeuttaa limaa ja aiheuttaa hengitysvaikeuksia. Toimintahäiriöisiä CFTR-mutaatioita on ainakin 127 erilaista (ainakin näin monta Natera testaa), jotka (jos molemmat alleelit ovat vammautuneet) aiheuttavat kystistä fibroosia. Yleisin mutaatio on ΔF508, joka on ~3 % kaikista eurooppalaisista CFTR-alleeleista ja noin 70 % mutaatioista. Tuon yhden fenyylialaniinin menetys muuttaa CFTR:n konformaatiota niin, että di-happoinen poistumiskoodi (aminohapot D565 ja D567), joka kohdistaa CFTR:n eksosytoottisiin vesikkeleihin, ei enää paljastu kunnolla eikä proteiini koskaan pääse solukalvolle.
Keskusteluosio
Osiossa luemme Hu 2009, joka osoitti, että atlastiiniproteiinit osallistuvat tubulaarisen ER:n verkoston luomiseen. Todisteet tulivat lähes kokonaan proteiini-proteiini-interaktioista. Olin yllättynyt, että tämä paperi oli iso juttu, koska on ollut miljoona paperia, jotka osoittavat proteiini-proteiini-interaktioita huntingtinille, eikä kukaan oikeastaan usko niitä kaikkia, eikä se ole välttämättä vienyt meitä yhtään lähemmäs tietämystä siitä, mitä huntingtin tekee tai mikä menee vikaan Huntingtonin taudissa. Mutta ilmeisesti Hu pystyi melko selvästi osoittamaan, että atlastiinien vuorovaikutukset retikulonien kanssa viittaavat rooliin ER:n muodostumisessa. Asiaa auttaa se, että Hu pystyi osoittamaan ”geneettisen vuorovaikutuksen” fyysisen vuorovaikutuksen (sitoutumisen) lisäksi. ”Geneettinen vuorovaikutus” (jouduin etsimään sen) tarkoittaa sitä, että ”Joskus kahden geenin mutaatiot tuottavat fenotyypin, joka on yllättävä kunkin mutaation yksittäisten vaikutusten valossa. Tämä ilmiö, joka määrittelee geneettisen vuorovaikutuksen, voi paljastaa geenien ja polkujen välisiä toiminnallisia suhteita.”” .
PrP
Tämä on vuosikymmenen vanha, joten jotkut asiat saattavat olla vanhentuneita, mutta minusta Harrisin 2003 (ft) katsaus PrP:n solubiologiaan oli äärimmäisen selkeä ja hyödyllinen. Kim & Hegde 2002 oli myös hyödyllinen. PrP on erittävän reitin proteiini. Sen ensimmäiset 22 aminohappoa (MANLGCWMLVLFVATWSDLGLC) ovat signaalipeptidi, joka aiheuttaa ko-translationaalisen translokaation ER:ään. Normaalisti PrP saa GPI-sidoksen vain C-terminaaliinsa ja ankkuroituu kalvon eksoplasmiselle puolelle. Mutta aminohapot 111-134 (HMAGAAAAGAVVVGGLGGYMLGSAM) ovat eräänlainen heikko signaaliankkurointisekvenssi (tyyppi II, jossa +++ aminohapot tulevat ennen signaaliankkurointia), josta tulee joskus, mutta ei aina, transmembraaninen domeeni, joka kääntää C-päätteen luumeniin. Vielä hämmentävämpää on, että tämä sekvenssi voi joskus päätyä vain transmembraanidomeeniksi ilman inversiota, jolloin N-pääte on luumenissa. PrP:llä on siis kolme membraanitopologiaa: tavallinen vanha GPI-ankkuroitunut ja kaksi transmembraanisuuntausta, kuten Harris 2003 Kuva 3:
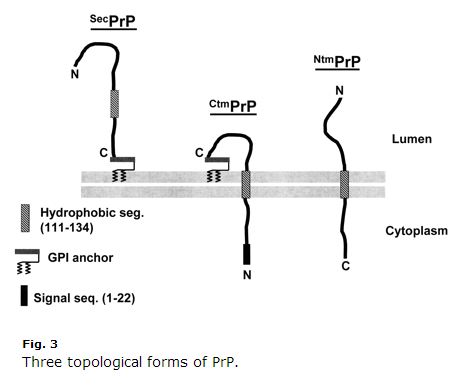
Huomaa, miten outo CtmPrP on. Se on transmembraaninen mutta myös GPI-ankkuroitunut, eikä N-terminaalista signaalipeptidiä ole koskaan pilkottu pois. Normaalisti transmembraanisia muotoja on < 10 % koko PrP:stä. Joissakin laboratorio-olosuhteissa prosenttiosuus on suurempi, ja kaksi GSS:ää aiheuttavaa mutaatiota (A117V ja P105L) lisäävät myös CtmPrP:n osuutta 20-30 prosenttiin kaikesta PrP:stä. Näistä kolmesta muodosta on runsaasti näyttöä siitä, että CtmPrP on myrkyllinen ja että sillä saattaa olla merkitystä prionien muodostumisessa, vaikka useimmat geneettiset prionisairauden mutaatiot (mukaan lukien FFI D178N) eivät näytä vaikuttavan PrP:n membraanitopologiaan tai CtmPrP:n osuuteen.
Sen jälkeen kun PrP on kulkenut Golgin läpi, se kohdistuu solukalvolle. Harrisin mukaan se ei kuitenkaan vain istu siellä – se kulkee usein klatriinivälitteisen endosytoosin kautta ja kiertää solun läpi ~60 minuutin välein, ja osa molekyyleistä pilkkoutuu jokaisella kierroksella. Kupari stimuloi tätä PrP:n endosytoosia. Useimmat geneettiset prionisairauksien mutaatiot muuttavat PrP:n lokalisaatiota – yleensä mutaation yhteydessä PrP:tä on vähemmän solun pinnalla ja sitä kertyy enemmän ER:ään.