14.1 Johdatus neuropeptideihin ja typpioksidiin
Klassiset välittäjäaineet (esim. glutamaatti ja ACh) toimivat siten, että ne siirtävät informaatiota suunnatusti presynaptisten vapautumiskohtien ja postsynaptisten reseptoriryhmien välillä. Prosessi on yleensä alueellisesti hyvin organisoitu, ja siinä on jonkin verran, mutta hyvin rajoitetusti, lähettimen ”leviämistä” naapurisynapsien välillä. Tilanne on aivan erilainen neuropeptidien ja typpioksidin (NO) välittämässä transmissiossa. Nämä molekyylit jättävät huomiotta informaatiovirran suuntautuneisuuden ja sen sijaan vaikuttavat vapautumiskohdastaan käsin alueeseen. Tämä ominaisuus vastaa löyhästi peptidihormonien vapautumista verenkiertoon, ja ne voivat kulkeutua kaukaisiin paikkoihin tuottamaan vaikutuksensa. Esimerkiksi NO:ta voidaan tuottaa postsynaptisessa neuronissa ja se voi diffundoitua takaisin presynaptiseen neuroniin tai muihin naapurineuroneihin, jotka vaikuttavat lähettimen myöhempään vapautumiseen. Tätä ominaisuutta kutsutaan retrogradiseksi transmissioksi, koska signaali kulkee vastakkaiseen suuntaan (post-pre) verrattuna neurotransmission klassiseen suuntaisuuteen.
14.2 Neuropeptidit
Monet neuropeptidit kuvattiin alun perin hormoneiksi (esim. somatostatiini ja kolekystokiniini), vaikka niitä luonnehdittuaan niitä sittemmin löydettiin myös keskushermoston neuroneista. Neuropeptidit tuottavat tyypillisesti neuronivasteet, jotka alkavat hitaasti ja kestävät pitkään (kuva 14.1), ja jokainen luonnehdittu neuropeptidireseptori kuuluu GPCR-luokkaan (G-proteiiniin kytketty reseptori). Vertailun vuoksi kuvassa 14.1 esitetään tyypillisiä vasteita, jotka syntyvät ionotrooppiseen reseptoriin ja neuropeptidiin vaikuttavan klassisen välittäjäaineen (glutamaatti) vaikutuksesta. Glutamaattia vapauttavan neuronin 1 (vihreällä) aiheuttama toimintapotentiaali tuottaa nopean (5 sekuntia) EPSP:n, joka on tyypillinen glutamaattivälitteiselle synaptiselle siirrolle. Sitä vastoin neuropeptidiä vapauttavan neuronin 2 (violetti) toimintapotentiaali tuottaa hitaasti alkavan (5 sekuntia huippuun) ja pitkäkestoisen (10 sekuntia) EPSP:n. Nämä hitaat EPSP:t ovat tyypillisiä neuropeptidien vaikutuksille, koska kaikki neuropeptidireseptorit ovat G-proteiinikytkentäisiä.
Kuva 14.1
Lisäksi monet neuropeptidit eivät saa aikaan selvää elektrofysiologista muutosta postsynaptisessa neuronissa. Esimerkiksi aktiopotentiaali neuronissa 3 (kuva 14.1; vaaleanpunainen) ei tuota vastetta postsynaptisessa neuronissa, vaikka voidaan muilla keinoin varmistaa, että neuropeptidejä vapautui. Postsynaptisessa neuronissa on kuitenkin tapahtunut muutoksia, kuten ”C”-merkinnällä varustetuissa paneeleissa esitetyssä esimerkissä käy ilmi. Jos ensin mitataan glutamaattivaste (C1) stimuloimalla neuronia 1, nähdään tyypillinen vaste. Neuronin 3 stimulointi ei tuota vastetta (C2) kuten aiemmin. Jos neuronia 1 kuitenkin stimuloidaan uudelleen neuronin 3 stimulaation jälkeen, postsynaptisessa neuronissa mitattu EPSP voimistuu (C3) (alkuperäinen EPSP on yhtenäinen viiva ja neuronin 3 stimulaation jälkeinen EPSP on katkoviiva). Näin ollen neuronista 3 vapautunut neuropeptidi muutti postsynaptisen neuronin vastetta toiselle välittäjäaineelle. Näitä neuropeptidejä sanotaan neuromodulaattoreiksi, koska niiden vaikutukset voimistavat tai heikentävät toisen lähettimen vaikutuksia. Muita esimerkkejä tällaisesta heterosynaptisesta plastisuudesta kuvataan luvun 7 osassa 2.
14.3 Peptidien luokittelu perheiden mukaan
Neuropeptidit voidaan ryhmitellä perheisiin niiden aminohapposekvenssien samankaltaisuuden perusteella (taulukot I ja II).
Taulukko I
Neuropeptidiperheet
Takykiniinit: substanssi P, bombesiini, substanssi
Insuliinit: insuliini, insuliinin kaltaiset kasvutekijät
Somatostamiinit: somatostatiini, haiman polypeptidi
Gastriinit: gastriini, kolekystokiniini
Opioidit: opiokortiinit, enkefaliineja, dynorfiini
Esimerkiksi opiaatit on ryhmitelty yhdeksi perheeksi niiden N-terminaalista löytyvän identtisen aminohapposekvenssin Tyr-Gly-Gly-Phe–(taulukko II) vuoksi.
| Taulukko II Opiaattiperheen sekvenssi-identtisyys kursiivilla |
|
| Nimi | Aminohapposekvenssi |
| Leu-enkefaliini | Tyr-Gly-Gly-Phe-Leu-OH |
| Met-enkefaliini | Tyr-Gly-Gly-Phe-Met-OH |
| Beta-endorphin | Tyr-Gly-Gly-Phe-Met-Thr-Ser-Glu-Lys- Ser-Gln-Thr-Pro-Leu-Val-Thr-Leu- Phe-Lys-Asn-Ala-Ile-Val-Lys-Asn-Ala- His-Lys-Gly-Gln-His-OH |
| Dynorfiini | Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile-Arg- Pro-Lys-Leu-Lys-Trp-Asp-Asn-Gln-OH |
14.4 Biosynteesi ja säätely
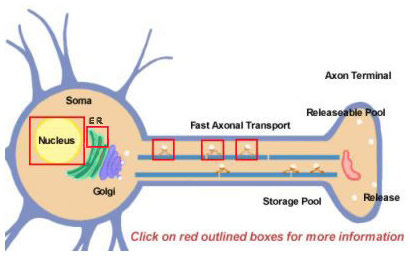
Kuva 14.2
Neuropeptidit ovat peräisin suuremmista esiasteista proteolyyttisen prosessoinnin avulla. Ne kaikki syntetisoituvat aluksi somen sisällä (kuva 14.2). Prekursorit muodostuvat aluksi translaation kautta polyribosomeihin, jotka ovat kiinnittyneet endoplasmiseen retikulumiin lähellä solurunkoa. Sieltä ne kulkevat Golgin laitteiston läpi, jossa tapahtuu lisämodifikaatioita, kuten glykosylaatio. Tämän jälkeen ne pakataan erittäviin rakeisiin, jotka kuljetetaan päätelaitteisiin nopean aksonikuljetuksen avulla. Nopea on kuitenkin suhteellinen termi, ja se johtuu siitä, että joidenkin neuropeptidien on kuljettava suhteellisen pitkiä matkoja. Vapautuvien neuropeptidien varaston täydentäminen saattaa vaatia useita tunteja. Kuljetuksen aikana hermopäätteeseen vesikkeliin pakatut proteaasit alkavat pilkkoa esiasteena olevaa neuropeptidiä lopulliseen kypsään muotoonsa. Tämä prosessointi on välttämätöntä neuropeptidien aktivoimiseksi, koska esiasteet ovat biologisesti inaktiivisia. Vesikkelien sisällä tapahtuu ainakin kolmenlaista prosessointia (kuva 14.2; lisätietoja saat napsauttamalla laatikoita). Ensin endopeptidaasi pilkkoo prekursoria tuottaen kaksi uutta tuotetta (ensimmäinen laatikko aksonissa). Monille esiasteille tämä pilkkominen tapahtuu emäksisten jäämien (kuten Lys ja Arg) jälkeen, ja sen suorittavat trypsiinin kaltaiset proteaasit. Seuraavaksi, vaikkakaan ei kaikissa neuropeptideissä, karboksypeptidaasi pilkkoo perusjäännökset uuden peptidin C-terminaalista (toinen laatikko aksonissa). Lopuksi kolmas entsyymi muuttaa monien neuropeptidien C-terminaalissa olevan Gly-jäännöksen COOH-(karboksi)-ryhmän NH2-(amidi)-ryhmäksi, jolloin syntyy neuropeptidin kypsä, aktiivinen muoto.
14.5 Neuropeptidien monimuotoisuuden tuottamiseen käytetään useita mekanismeja
Suurin osa proteiineista tuotetaan mRNA-molekyyleistä, jotka pilkkoutuvat esiaste-RNA:sta lopulliseen muotoonsa ytimessä. Erilainen splikointi on yksi tapa, jolla neuroni monipuolistaa erityyppisten neuropeptidien tuotantoa. Yksi tunnettu esimerkki on aine P:n mRNA, joka normaalisti sisältää myös ainetta K koodaavaa mRNA:ta. mRNA:n aine K:n osa voidaan eriytetysti splikoida pois niin, että tuloksena syntyvä mRNA pystyy tuottamaan vain ainetta P (klikkaa ruutua ytimen yläpuolella kuvassa 14.2)
Kuvassa 14.3
Neuropeptidit tuotetaan pidemmästä esiasteproteiinista proteolyyttisen prosessoinnin avulla. Erinomainen esimerkki on opioidiperheen peptidit (esim. proopiomelanokortikotropiinin, POMC:n ja enkefaliinin prosessointi; ks. kuva 14.3). Kuten todettiin, proteolyyttinen prosessointi tapahtuu kuljetusvesikkelien sisällä ja tapahtuu useimmiten pilkkomalla esiaste N-terminaalisesti emäksisistä jäämistä (arginiini ja lysiini), vaikka muitakin pilkkoutumiskohtia on tunnistettu. Joissakin tapauksissa, kuten Enkefaliinin prekursoriproteiinissa, samaa lopullista bioaktiivista peptidiä on useita kopioita. Kuvan 14.3 yläosassa esitetty yksi prekursorimolekyyli sisältää kuusi kopiota Met-enkefaliinia (ME) ja yhden kopion Leu-enkefaliinia (LE).
Moninaisuutta voidaan siis tuottaa muuttamalla pilkkoutumiskohtien sekvenssiä erilaisella splikoinnilla, tuottamalla ja/tai pakkaamalla kuljetusvesikkeliin erilaisia proteaaseja (jotka tunnistavat eri pilkkoutumisjaksoja) tai piilottamalla proteolyyttinen kohta posttranslationaalisilla modifikaatioilla. Esimerkki jälkimmäisestä on, että tietty pilkkoutumiskohta saatetaan piilottaa lisäämällä siihen hiilihydraattisivuketju, joka estää steriilisti proteaasin pääsyn kyseiseen kohtaan. Toinen yleinen havainto on, että yksi esiaste-molekyyli sisältää useita eri neuropeptidejä (ks. kuva 14.3), ja siksi tapahtuvan prosessoinnin tyypit määräävät lopulta sen, mikä neuropeptidi vapautuu neuronista. POMC:n prekursoriproteiini voidaan pilkkoa ACTH:ksi (oranssi) ja β-lipoproteiiniksi (vaaleansininen), jotka kumpikin voidaan edelleen pilkkoa tuottamaan lisää bioaktiivisia neuropeptidejä (kuva 14.3). Esimerkiksi β-lipoproteiini (vaaleansininen) voidaan edelleen pilkkoa sekä γ-lipoproteiiniksi (vihreät raidat) että β-endorfiiniksi (tummansininen). Jälleen kerran, riippuen tapahtuvasta prosessoinnista, samaa esiasteproteiinia voidaan muokata tuottamaan neuropeptidejä, joilla on dramaattisesti erilaiset biologiset vasteet.
14.6 Vapautuminen
Kuva 14.4
Peptidit vapautuvat kalsiumriippuvaisen eksosytoosin avulla, ja niillä on joitakin merkittäviä eroja klassisten välittäjäaineiden vapautumiseen verrattuna. Tyypillisesti neuropeptidejä vapauttavat vesikkelit ovat paljon suurempia kuin pienimolekyylisiä välittäjäaineita (esim. glutamaattia) sisältävät vesikkelit, eivätkä ne vaadi vapautumiseen presynaptista erikoistumista (ks. elektronimikroskooppikuva kuvassa 14.4). Toisin kuin pienet vesikkelit, jotka sisältävät glutamaattia, suuret vesikkelit eivät näytä telakoituneen kalvoon. Tämä havainto on yhdenmukainen sen ajatuksen kanssa, että pienimolekyyliset välittäjäaineet tuottavat lyhyitä, paikallisia vaikutuksia (synaptisissa yhteyksissä), kun taas neuropeptidit tuottavat hitaita, pitkäkestoisia vaikutuksia, jotka usein kattavat merkittävän alueen vapautumiskohdan ympärillä. On myös muistettava, että koska neuropeptidit syntetisoidaan solun soma-alueella eikä paikallisesti synapsissa, jos niiden varastot loppuvat pitkäaikaisen vapautumisen seurauksena, vapautuvien varastojen täydentäminen voi kestää useita tunteja. Esimerkiksi motoneuronilla, jonka solurunko on selkäytimessä ja synapsi jalkaterässä, on metrin pituinen aksoni. Nopeaa aksonikuljetusta käytettäessä uuden syntetisoidun neuropeptidin saapuminen synapsiin somaosasta kestäisi mahdollisesti yli vuorokauden. Pitäisi myös olla selvää, että endogeeniset kipua tappavat neuropeptidit, kuten beeta-endorfiini, voisivat ”kulua loppuun” jatkuvan stimulaation aikana, mikä johtaisi tilanteisiin, joissa kipua ei voida enää hallita endogeenisillä mekanismeilla.
Tyypillinen kypsä hermosolu vapauttaa usein yhtä pienimolekyylistä välittäjäainetta ja yhtä tai useampaa neuropeptidiä (kuten kuvassa 14.4 esitetyssä esimerkissä). Jos vapautuu useampi kuin yksi neuropeptidi, ne ovat useimmiten peräisin samasta yhdestä esiaste-molekyylistä. Esimerkki on sekä ACh:n että kalsitoniinigeeniin liittyvän peptidin samanaikainen vapautuminen selkärangan motoneuroneista. CGRP aktivoi adenylaattisyklaasia, nostaa cAMP-tasoja ja tehostaa ACh:n nikotiinisen ACh-reseptorin ACh-aktivaation tuottamaa supistumisvoimaa. Tässä tapauksessa neuropeptidi on moduloiva, kuten kuvassa 14.1 on kuvattu. Tässä tapauksessa vaikutus kuitenkin potensoi lihassupistusta sen sijaan, että se lisäisi EPSP:n voimakkuutta. Molemmissa esimerkeissä potensoitu vaste johtuu järjestelmän lisääntyneestä herkkyydestä vakiomäärälle vapautuvaa välittäjäainetta.
14.6 Vaikutuksen päättyminen
Neuropeptidit poistuvat hitaasti solunulkoisesta tilasta; ominaisuus, joka myös edistää niiden suhteellisen pitkäkestoisia vaikutuksia. Inaktivoituminen tapahtuu sekä diffuusion että solunulkoisten proteaasien aiheuttaman hajoamisen kautta. Ei ole löydetty todisteita siitä, että peptidien takaisinotto olisi keino lopettaa niiden vaikutus.
14.7 Reseptorit ovat kaikki G-proteiiniin kytkeytyneitä
Kaikki tunnetut neuropeptidireseptorit saavat aikaan vaikutuksensa muuttamalla solunsisäisten sekundaaristen lähettien tasoja. Nämä reseptorit ovat seitsemän transmembraanivälitteistä proteiinia, jotka ovat G-proteiinien (GPCR:t) kautta yhteydessä toisiinsa ja muuttavat muiden solun entsyymien aktivaatiota. Tämä ominaisuus on yhdenmukainen sen kanssa, että neuropeptidit aiheuttavat hitaamman vasteen, ja se soveltuu hyvin moduloivaan rooliin. Yksi tärkeä ero pienten ja neuropeptidimolekyylisten välittäjäaineiden välillä on se, että neuropeptidireseptoreilla on suuri affiniteetti sitoutumiseen (nanomolaarinen) verrattuna mikro- tai millimolaarisiin affiniteetteihin, joita mitataan pienten molekyylien välittäjäaineille (kuten glutamaatille). Koska neuropeptidejä ei vapauteta suuntautuneesti synapsin rajattuun tilavuuteen, niiden pitoisuudet eivät nouse kovin korkeiksi, ja reseptoreilla on oltava suuri affiniteetti, jotta ne voivat reagoida näihin pieniin pitoisuuksiin. Tämä korkea affiniteetti hidastaa neuropeptidin dissosioitumista reseptoristaan ja vaikuttaa osaltaan näiden molekyylien pysyviin vaikutuksiin.
14.8 Typpioksidi (NO)
Typpioksidi on saanut laajaa huomiota uuden kaasumaisten viestimolekyylien luokan perustajajäsenenä. NO on aktiivinen molekyyli, jota sublingvaalinen nitroglyseriini tuottaa lisäämään vasodilataatiota angina pectoriksen lievityksessä. NO:n muita tärkeitä biologisia vaikutuksia on nyt tunnustettu. Esimerkiksi hermostossa NO:lla on merkitystä aivoverenkierron säätelyssä, neurotransmission moduloinnissa ja erilaisiin patologisiin tiloihin liittyvässä toksisuudessa.
14.9 NO:n ominaisuudet
Yhteenveto NO:n ominaisuuksista
- kaasu, joka diffundoituu vapaasti kalvojen läpi
- Lyhytikäinen, jonka puoliintumisaika on…puoliintumisaika mitattuna sekunneissa
- Erittäin reaktiivinen vapaa radikaali
- Myrkyllinen suurina pitoisuuksina
NO on lyhytikäinen kaasu, jota ei pidä sekoittaa suhteellisen pysyvään anestesiakaasuun dityppioksidiin (naurukaasu). NO on itse asiassa vapaa radikaali ja siksi erittäin reaktiivinen yhdiste. Osa sen myrkyllisistä vaikutuksista johtuu todennäköisesti siitä, että NO reagoi superoksidin kanssa tuottaen tuhoisaa peroksinitraattiradikaalia. NO:ta pidetään epätavanomaisena välittäjäaineena, koska sitä ei vapautu eksosytoosin kautta eikä sen vaikutus tapahdu tavanomaisten reseptorimolekyylien kautta.
Kuten aiemmin mainittiin, tyypillisessä kuvauksessa hermoviestinnästä pidetään siirtoa yksisuuntaisena. Presynaptinen välittäjäaine vapautuu, joka saa aikaan muutoksia postsynaptisessa neuronissa. Useat postsynaptisissa neuroneissa tuotetut yhdisteet (kuten neuropeptidit ja NO) diffundoituvat paikalliseen ympäristöön ja vaikuttavat ympäröiviin soluihin. Koska NO on vapaasti diffundoituva kaasu, se voi kulkeutua nopeasti mihin tahansa suuntaan tuotantopaikastaan. Jos NO esimerkiksi tuotetaan postsynaptisessa solussa glutamaattireseptorin stimulaation vuoksi, se voi vapautua paikalliseen ympäristöön ja lähettää signaalin takaisin presynaptiseen neuroniin (kuva 14.5). Tämäntyyppistä toimintaa kutsutaan retrogradiseksi signaloinniksi, koska signaali kulkee taaksepäin postsynaptisesta hermosolusta presynaptiseen hermosoluun.
Kuva 14.5
Kuva 14.6
Kuvissa 14.5, 14.6 ja 14.7 on esitetty tiivistetysti NO:n synteesin pääkohdat. Tässä esimerkissä presynaptisesta terminaalista vapautuu glutamaattia, joka sitoutuu postsynaptisen kalvon NMDA-reseptoreihin aiheuttaen niiden avautumisen ja sallien Ca2+-tulon. Ca2+ aktivoi kalmoduliinin, joka sitoutuu typpioksidisyntaasientsyymiin (NOS) ja aktivoi sen. Käyttämällä arginiinia substraattina NOS tuottaa NO:ta ja toista reaktiotuotetta, sitrulliinia. NO on sitten vapaa diffundoitumaan ympäristöön ja olemaan vuorovaikutuksessa glutamaattia alun perin vapauttaneen presynaptisen terminaalin tai minkä tahansa muun solun kanssa paikallisessa ympäristössä. Tunnista, että mikä tahansa prosessi, joka nostaa solunsisäistä Ca2+ -pitoisuutta, mahdollisesti aktivoi NOS:n. NMDA-reseptorien glutamaattiaktivaatio on vain yksi hyvin dokumentoitu esimerkki.
Kuva 14.7
14.10 Typpioksidisyntaasin (NOS) synteesi ja vapautuminen
NO:ta tuottaa entsyymi typpioksidisyntaasi (NOS). Tätä entsyymiä esiintyy neuronien osapopulaatiossa (1-2 % aivokuoren neuroneista) ja sitä esiintyy useimmissa endoteelisoluissa. Ainakin yksi NOS:n muoto näissä soluissa on riippuvainen kalsiumista ja kalmoduliinista aktivoituakseen, kuten kuvissa 14.5, 14.6 ja 14.7 on esitetty. Se sisältää myös sytokromi P-450:n kaltaisia kofaktoreita. Nämä kofaktorit ovat NADPH (nikotiiniamidiadeniinidinukleotidifosfaatti, FAD (flaviiniadeniinimononukleotidi) ja FMN (flaviinimononukleotidi). Nämä kofaktorit ovat välttämättömiä elektronien siirrossa, joka tuottaa epävakaan ja lyhytikäisen tuotteen NO. Tässä reaktiossa substraatti on yleinen aminohappo arginiini, ja tuotteet ovat sitrulliini ja NO (kuva 14.5). NO:n lyhyen eliniän vuoksi sitä on poikkeuksellisen vaikea mitata suoraan. Kokeellisissa valmisteissa on kuitenkin havaittavissa erinomainen korrelaatio NMDA:n käytön, joka lisää intraneuronaalista Ca2+ -pitoisuutta ja aktivoi NOS:n, ja NOS:n entsymaattisen toiminnan lisätuotteen, sitrulliinin, tuotannon välillä (ks. kuva 14.8). Sitrulliinin tuotanto on luotettava NO-tuotannon indikaattori. Sitrulliinin (ja NO:n) tuotanto on myös mahdollista estää syöttämällä soluille NOS:n ei-metaboloituvaa substraattia, metyyliarginiinia (kuva 14.9), ja tällaisia yhdisteitä on käytetty vähentämään NO:n tuotantoa ja lopettamaan sen biologiset vaikutukset.
|
Kuvio 14. NO:n tuotanto.8 |
Kuva 14.9 |
14.11 NO:n ”reseptorit”
Kuva 14.10
Yksi NO:n tärkeimmistä kohteista näyttäisi olevan guanylylisyklaasientsyymi. Tämä havainto tehtiin epäsuorasti seuraamalla NOS-tuotteen sitrulliinin kertymistä samalla kun seurattiin guanylysyklaasientsyymin tuotteen cGMP:n tuotantoa (kuvat 14.8 ja 14.9). Tässä kokeessa hermosoluvalmisteeseen lisättiin NMDA:ta NOS:n aktivoimiseksi. NOS käyttää arginiinia substraattina NO:n tuottamiseen, ja kuten mainittiin, jos järjestelmään lisätään metyyliarginiinin kaltainen ei-hydrolysoituva analogi, sitrulliinin ja cGMP:n kertymisen havaittiin päättyvän samalla annosriippuvaisella tavalla. Nämä vahvat korrelaatiot johtivat siihen, että havaittiin, että guanylyylisyklaasi on NO:n tärkein kohde.
Guanyylisyklaasi on epätavallinen entsyymi, koska sen rakenteeseen kuuluu hemirengas, johon liittyy rautamolekyyli. NO aktivoi tämän entsyymin sitoutumalla hemin sisältämään rautaan, mikä käynnistää syklisen GMP:n tuotannon GTP:stä (kuva 14.10) entsyymin konformaatiomuutosten kautta. cGMP aktivoi sitten cGMP-riippuvaisen proteiinikinaasin ja muita jäljempänä kuvattuja entsyymejä. cGMP:stä riippuvaisen proteiinikinaasin aktivaation aiheuttamien vaikutusten kirjo on vasta nyt tulossa ymmärretyksi.
14.12 NO:n biologiset vaikutukset
NO tuottaa monenlaisia biologisia vaikutuksia. Valitettavasti olemme erityisen tietämättömiä NO:n roolista hermoston soluprosessien moduloinnissa. NO:n rooli verisuoniston säätelyssä on hyvin dokumentoitu, ja sillä näyttää olevan yhtä tärkeä rooli myös hermostossa.
14.13 Verisuonia laajentava aine
Kuva 14.11
Klikkaa tästä nähdäksesi suurennetun näkymän tästä kuvasta.
Normaalitilanteessa NO vaikuttaa osaltaan verenkierron säätelyyn aivoverisuonistossa. Nopea takaisinkytkentämekanismi on välttämättä olemassa, jotta aivojen aktiivisemmille alueille voidaan toimittaa tarvittavat ravintoaineet. Tämä mekanismi on välttämätön, koska aivojen energiavarastot ovat heikot. NO:ta tuotetaan NOS:ää sisältävissä neuroneissa, jotka ovat jatkuvassa toiminnassa. Nämä olosuhteet suosivat NMDA-reseptorien aktivoitumista, minkä tiedetään aiheuttavan NO:n tuotantoa. NO diffundoituu näistä paikallisista korkean neuronaalisen aktiivisuuden alueista ympäröivään mikroverisuonistoon (kuva 14.11) aiheuttaen vasodilataatiota ja lisääntynyttä verenkiertoa.
Vaikka tarkkaa mekanismia, jolla NO saa aikaan vasodilataation, ei ole vielä määritelty, tiedetään, että cGMP-riippuvaisen proteiinikinaasin aktivoituminen sileälihassoluissa saa aikaan verisuonten rentoutumisen. Koska yksi NO:n pääkohteista on guanylyylisyklaasi (joka tuottaa cGMP:tä ja aktivoi cGMP-riippuvaisen proteiinikinaasin), oletetaan, että yksi tärkeä reitti NO:n vasodilatoiville vaikutuksille on cGMP-riippuvaisen proteiinikinaasin kautta. Tämän kinaasin aktivoituminen johtaa epäsuorasti Ca2+-tasojen alenemiseen sileän lihaksen soluissa ja sen jälkeen myosiinin supistumiskoneiston defosforylaatioon, mikä aiheuttaa relaksaatiota (kuva 14.12). Sileissä lihassoluissa NO näyttää myös suoraan hyperpolarisoivan soluja mahdollisesti aktivoimalla K+-kanavia, mikä johtaa Ca2+-kanavien toissijaiseen sulkeutumiseen, mikä myös saa aikaan lihasten relaksaation. Yhteenvetona voidaan todeta, että yksi NO:n tärkeimmistä tehtävistä näyttää olevan hermosolujen aktiivisuustason yhdistäminen aivoverenkierron paikallisiin muutoksiin, jotta metabolisesti aktiivisen kudoksen riittävä perfuusio säilyy.
Kuva 14.12
14.14 Neuromodulaattori
NO:n ajatellaan toimivan myös paikallisesti diffusoituvana lähettinä. Sitä syntyy mistä tahansa vaikutuksesta, joka nostaa Ca2+ -pitoisuutta NOS:ää sisältävissä soluissa, kuten glutamaatin stimuloidessa NMDA-reseptoreita. Myöhemmin tapahtuvan guanyylisyklaasin aktivoinnin ja cGMP:n tuotannon kautta NO:n tuotanto vaikuttaa moniin toissijaisiin prosesseihin. Näitä ovat ionikanavien suora modulaatio, cGMP-riippuvaisen proteiinikinaasin stimulaatio ja sekä cAMP-fosfodiesteraasin ylös- että alasregulaatio. Jälkivaikutukset ovat sitten lukuisia, ja niihin kuuluvat Ca2+ -kanavien ylös- ja alasäätely, lisääntynyt herätettävyys (lisää neuronin laukaisunopeutta), lisääntynyt tai vähentynyt välittäjäaineiden vapautuminen ja muutokset neuronin morfologiassa.
14.15 Myrkyllisyys
Ylimääräinen NO on myrkyllistä soluille. NO:n toksisuuteen liittyy kuitenkin paradoksi. Solut, jotka tuottavat runsaasti NO:ta, ovat vastustuskykyisiä sen toksisille vaikutuksille. Esimerkiksi makrofagit ja neutrofiilit käyttävät NO:n toksisuutta mekanismina tappaakseen kasvainsoluja ja bakteereja. Kumpikaan NO:ta tuottava solutyyppi ei kuitenkaan ole altis sen vahingollisille vaikutuksille. Tämä havainto pätee myös keskushermoston neuroneihin. Ylimääräinen glutamaatti aiheuttaa aivoissa neurotoksisuutta, ja sen uskotaan olevan ensisijainen syy hermosolujen kuolemaan Huntingtonin tai Alzheimerin taudin kaltaisissa sairauksissa tai akuutin aivohalvauksen tai trauman jälkeen. NO:n ylituotannolla uskotaan olevan jonkinlainen rooli tässä hermosolujen häviämisessä, koska se on myrkyllinen, kun sitä tuotetaan liikaa. Mielenkiintoista on, että solut, jotka värjäytyvät positiivisesti NOS-entsyymille, säästyvät näiden tautien aiheuttamilla rappeutuvilla aivoalueilla. Näiden solujen vastustuskyky näyttää olevan samanlainen kuin edellä kuvattujen immuunisolujen vastustuskyky.
A. Syntetisoituvat terminaalissa.
B. Kulkeutuvat nopean aksonikuljetuksen avulla
C. Kuljetetaan diffuusion avulla
D. Kuljetetaan hitaalla aksonikuljetuksella
E. Otetaan solunulkoisesta tilasta
Neuropeptidejä on synaptisissa päätteissä, koska ne ovat:
A. Syntetisoituvat terminaalissa. Tämä vastaus on VÄÄRIN.
Peptidien ja proteiinien synteesiin tarvittavaa synteesikoneistoa ei löydy aksonipäätteestä.B. Kuljetetaan nopean aksonikuljetuksen avulla
C. Kuljetetaan diffuusion avulla
D. Kuljetetaan hitaan aksonikuljetuksen avulla
E. Otetaan solunulkoisesta tilasta
Neuropeptidejä on synaptisissa päätteissä, koska ne ovat:
A. Syntetisoituvat terminaalissa.
B. Kuljetetaan nopean aksonikuljetuksen avulla Tämä vastaus on OIKEA!
Neuropeptidit syntetisoidaan solurungossa ja prosessoidaan vesikkeleihin, jotka kuljetetaan aksonipäätteisiin mikrotubuluksia pitkin nopean aksonikuljetuksen avulla.C. Kuljetetaan diffuusion avulla
D. Kuljetetaan hitaan aksonikuljetuksen avulla
E. Otetaan solunulkoisesta tilasta
Neuropeptidejä on synaptisissa päätteissä, koska ne ovat:
A. Syntetisoituvat terminaalissa.
B. Kulkeutuvat nopean aksonikuljetuksen avulla
C. Kuljetetaan diffuusion avulla Tämä vastaus on VÄÄRÄ.
Diffuusio on myös erinomainen mekanismi molekyylien siirtämiseen lyhyillä etäisyyksillä (muutama mikrometri), mutta se on tehoton siirtämään molekyylejä etäisyyksillä, jotka tyypillisesti erottavat neuronin soma ja aksoniterminaalit.D. Hidas aksonikuljetus kuljettaa
E. Otetaan solunulkoisesta tilasta
Neuropeptidejä on synaptisissa päätteissä, koska ne ovat:
A. Syntetisoituvat terminaalissa.
B. Kulkeutuvat nopean aksonikuljetuksen avulla
C. Kuljetetaan diffuusion avulla
D. Kuljetetaan hitaalla aksonaalisella kuljetuksella Tämä vastaus on VÄÄRÄ.
Tämä vastaus on VÄÄRÄ.
Myös on tärkeää, että neuropeptidien tarjonta päätepisteisiin täydennetään mahdollisimman nopeasti. Tässä tapauksessa nopeampi on parempi.E. Otetaan solunulkoisesta tilasta
Neuropeptidejä on synaptisissa päätteissä, koska ne ovat:
A. Syntetisoituvat terminaalissa.
B. Kulkeutuvat nopean aksonikuljetuksen avulla
C. Kuljetetaan diffuusion avulla
D. Kuljetetaan hitaalla aksonikuljetuksella
E. Otetaan solunulkoisesta tilasta Tämä vastaus on VÄÄRÄ.
Ei tunneta ottomekanismia, joka poistaisi neuropeptidejä solunulkoisesta tilasta. Niiden vaikutusmekanismi päättyy diffuusioon ja solunulkoisten proteaasien entsymaattiseen hajoamiseen.A. Pitkä elinikä
B. On kalvoja läpäisevä.
C. Ei ole reaktiivinen
D. Tunnetaan myös nimellä naurukaasu.
E. Ei ole myrkyllistä soluille.
Typpioksidi:
A. Sillä on pitkä elinikä Tämä vastaus on VÄÄRÄ.
NO:lla on sekunneissa mitattu puoliintumisaika ja se on erittäin epävakaa.B. On kalvon läpäisevä.
C. Ei ole reaktiivinen
D. Tunnetaan myös nimellä naurukaasu.
E. Ei ole myrkyllistä soluille.
Typpioksidi:
A. On pitkä käyttöikä
B. On kalvoja läpäisevä. Tämä vastaus on OIKEA!
NO on vapaasti kalvoja läpäisevä ja vaikuttaa kaikkiin soluihin jonkin säteellä sen tuotantopaikasta.C. Ei ole reaktiivinen
D. Tunnetaan myös nimellä naurukaasu.
E. Ei ole myrkyllistä soluille.
Typpioksidi:
A. On pitkä käyttöikä
B. On kalvoja läpäisevä.
C. On reagoimaton Tämä vastaus on VÄÄRÄ.
NO on erittäin reaktiivinen vapaa radikaali. Se reagoi proteiinien, lipidien ja nukleiinihapon kanssa, ja sillä on erityisen suuri affiniteetti pelkistyneisiin metalleihin (kuten Fe2+ guanylyylisyklaasin hemiryhmään).D. Tunnetaan myös nimellä naurukaasu.
E. Ei ole myrkyllistä soluille.
Typpioksidi:
A. On pitkä käyttöikä
B. On kalvoja läpäisevä.
C. On ei-reaktiivinen
D. Tunnetaan myös nimellä naurukaasu. Tämä vastaus on VÄÄRIN.
Naurukaasu on typpioksiduuli, ei typpioksidi. Se ei ole reaktiivinen eikä myrkyllinen, mutta vaikuttaa kalvojen ominaisuuksiin.E. Ei ole myrkyllistä soluille.
Typpioksidi:
A. On pitkä käyttöikä
B. On kalvoja läpäisevä.
C. On ei-reaktiivinen
D. Tunnetaan myös nimellä naurukaasu.
E. Ei ole myrkyllistä soluille. Tämä vastaus on VÄÄRÄ.
NO on erittäin myrkyllistä soluille, kun sitä tuotetaan liikaa. Itse asiassa NO:n ylituotannon uskotaan aiheuttavan tiettyjä neurodegeneratiivisia sairauksia. NO:ta tuottavat myös makrofagit myrkyllisenä tuotteena tappaakseen tunkeutuvia bakteereja.