Kuten olemme nähneet, ruokavaliomme sisältää monia hiilihydraatteja, ja saatat miettiä, voisitko mitenkään analysoida näytteen, jotta voisit sanoa, onko se sakkaroosia vai jotakin synteettistä makeutusainetta, kuten sorbitolia tai maissisiirappia, vai jopa C-vitamiinin kaltaista yhdistettä, joka syntetisoituu sokereista ja joka sisältää sokereiden tapaan vain C:tä, H:ta ja O:ta. Tällainen tapa on olemassa, ja se on yksi perustavanlaatuisimmista analyysimuodoista, jota kutsutaan alkuaineanalyysiksi. Se on yksi ensimmäisistä menetelmistä, joita tutkijat käyttävät uuden yhdisteen tunnistamiseen.
Tähän asti olemme saaneet kaikki stökiometriset suhteet tasapainotettujen kemiallisten yhtälöiden kertoimista. Kemialliset kaavat ilmaisevat kuitenkin myös suhteellisia ainemääriä, ja stökiometriset suhteet voidaan johtaa myös niistä. Esimerkiksi kaava CO2 kertoo, että riippumatta siitä, kuinka suuri näyte hiilidioksidia on, jokaista moolia hiiliatomeja kohti on aina 2 moolia happiatomeja. Toisin sanoen CO2:n kaavasta saadaan stoikiometrinen suhde
\
Voisimme myös määrittää, että CO2:lle
\
\
\
(Näiden stoikiometristen suhteiden käänteisluvut pätevät myös CO2:lle.)
Yhtälöiden sijasta kaavoista johdetut stökiometriset suhdeluvut ovat mukana tavallisimmassa menettelyssä, jolla määritetään vain C:tä, H:ta ja O:ta sisältävien yhdisteiden empiiriset kaavat. Punnittu määrä analysoitavaa ainetta asetetaan polttojunaan ja kuumennetaan kuivassa O2-virrassa. Kaikki yhdisteen sisältämä H muuttuu H2O(g)ksi, joka vangitaan selektiivisesti aiemmin punnittuun absorptioputkeen. Kaikki C muuttuu CO2:ksi (g), joka absorboidaan selektiivisesti toiseen putkeen. Kummankin putken massan kasvu kertoo vastaavasti, kuinka paljon H2O:ta ja CO2:ta syntyi näytteen palamisessa
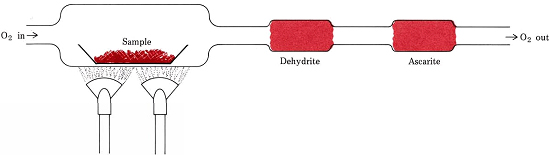
Kuva \(\PageIndex{1}\) Palamisjuna. Näytteessä olevan O2:n ja H:n ja C:n yhdistymisestä syntyneet H2O ja CO2 imeytyvät selektiivisesti dehydriittiä ja askaritiittia (NaOH asbestin päällä) sisältäviin putkiin.
Esimerkki \(\PageIndex{1}\): Askorbiinihapon empiirinen kaava
6,49 mg:n näyte askorbiinihappoa (C-vitamiinia) poltettiin polttojunassa. Syntyi 9,74 mg CO2 ja 2,64 mg H2O. Määritä askorbiinihapon empiirinen kaava.
Ratkaisu Meidän on tiedettävä näytteen sisältämän C:n, H:n ja O:n määrä. Näiden suhde antaa kaavan alaviitteet. Kaksi ensimmäistä saadaan CO2:n ja H2O:n massoista käyttäen moolimassoja ja stökiometrisiä suhteita
\
\
Tässä
Tällöin
\
Yhdiste on voinut sisältää myös happea. Sen selvittämiseksi lasketaan C:n ja H:n massat ja vähennetään näytteen kokonaismassasta
\
Tällöin saadaan
\
ja
\
\
Elementtien määrien suhdeluvut askorbiinihapossa ovat näin ollen
\
\ \
Koska nC:n:nH:nO on 3 mol C:4 mol H:3 mol O, empiirinen kaava on C3H4O3.
Tässä on piirros askorbiinihappomolekyylistä. Voit todeta atomien laskemisen avulla, että molekyylikaava on C6H8O6 – täsmälleen kaksinkertainen empiiriseen kaavaan verrattuna. On myös selvää, että molekyylistä on tiedettävä muutakin kuin vain se, kuinka monta erilaista atomia molekyylissä on. Askorbiinihapossa, kuten muissakin molekyyleissä, tapa, jolla atomit liittyvät toisiinsa, ja niiden sijoittelu kolmiulotteisessa tilassa ovat varsin tärkeitä. Rakennekaavaksi kutsutaan kuvaa, josta käy ilmi, mitkä atomit ovat yhteydessä toisiinsa. Empiiriset kaavat voidaan saada prosenttikoostumuksesta tai polttojännitekokeista, ja jos molekyylipaino tunnetaan, molekyylikaavat voidaan määrittää samoista tiedoista. Rakennekaavojen löytämiseksi tarvitaan monimutkaisempia kokeita. Esimerkissä 2 saimme O:n massan vähentämällä näytteen kokonaismassasta C:n ja H:n massat. Näin oletettiin, että vain C, H ja O olivat läsnä. Joskus tällainen oletus voi olla virheellinen. Kun penisilliini eristettiin ja analysoitiin ensimmäisen kerran, jäi huomaamatta, että se sisälsi rikkiä. Tämä virhe huomattiin vasta jonkin ajan kuluttua, koska rikin atomipaino on lähes täsmälleen kaksinkertainen hapen atomipainoon verrattuna. Yhden rikkiatomin tilalle kaavaan korvattiin kaksi happiatomia.
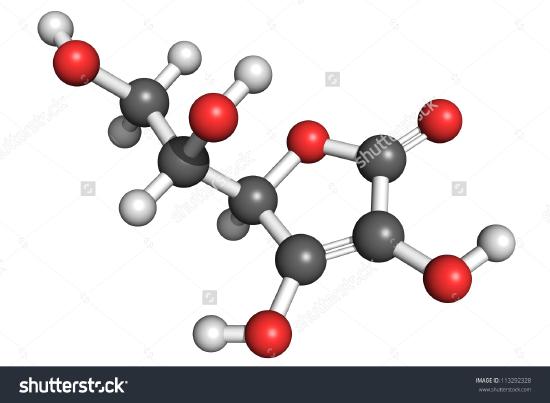
Kuva \(\PageIndex{2}\) L-askorbiinihapon 3D-kuvaus 1
From ChemPRIME: 3.4: Yhdisteiden analysointi