Esittely
Ihmisten historian ehkä ensimmäinen viittaus raudan ja alkoholin imeytymiseen on peräisin 1200 eaa. 1200 eaa. Thessaliasta peräisin oleva legenda kertoo, kuinka Iphycuksen Apolodorusta, joka seisoi pellolla katsomassa isänsä kastraatiota lampaiden kanssa, uhkasi samanlainen rangaistus; aikuiseksi tultuaan Apolodorus oli impotentti. Velho nimeltä Melampus paransi Apolodoruksen korppikotkan innoittamana juottamalla hänet viinilasilliseen sen veitsen ruostetta, jolla hänen isänsä kastroi karitsat ja jolla häntä oli uhkailtu.
Sairaalassamme nähdään lukuisia alkoholistipotilaita ja sairaalahoitoa vaativia potilaita, kun otetaan huomioon kaikki siihen liittyvät sairaudelliset piirteet.
Tarkoituksemme tässä tiedonannossa on muistuttaa eräästä alkoholismissa esiintyvästä hematologisesta patologiasta, joka voi usein taantua pelkän pidättäytymisen myötä: sideroblastisesta anemiasta ja hemosideroosista.
Bjorkman kuvasi vuonna 1956 neljä potilasta, joilla oli krooninen tulenkestävä anemia ja sideroblastirenkaat, joiden luuytimen solut olivat värjäytyneet preussinsinisellä.
Ensimmäiset todisteet siitä, että nämä sideroblastirenkaat liittyivät alkoholiin, esittivät Mac Gibbon ja Mollin vuonna 1965, minkä jälkeen alkoholismista on tullut tämän patologian yleisin syy.
Vuonna 1969 Hines (korvaten i:n 1:llä) kuvasi kroonisessa alkoholismissa abstinenssin aiheuttaman reversiibelin sideroblastianemian.
Alkoholin vaikutukset
Alkoholin moninaiset patologiset vaikutukset (korvaa 2) hematopoieettiseen kudokseen voidaan jakaa seuraavasti:
Jotka johtuvat alkoholin suorasta vaikutuksesta
Jotka johtuvat ravitsemuspuutosten toissijaisista vaikutuksista
Jotka johtuvat maksasairaudesta
Anemia on yleinen syy alkoholisteilla.(korvaa 3) Näistä yleisimmät ovat megaloblastinen anemia ja sideroblastinen anemia.
Viimeinen liittyisi ravitsemuksellisiin tekijöihin ja B6-vitamiinin aineenvaihdunnan häiriöihin.
Pyridoksiinin kyvyn muuttua B6-vitamiinin aktiiviseksi muodoksi, pyridoksaalifosfaatiksi, on osoitettu vähenevän erytrosyyttien pyridoksaalifosfokinaasiaktiivisuuden estymisen seurauksena.
On myös ehdotettu, että etanoli voi toimia kalvojen emäksisen fosfataasin stimuloijana kiihdyttämällä solujen pyridoksialifosfaatin hajoamista (korvaa 4). Tätä pyridoksiinin aineenvaihdunnan muutosta tukee pyridoksiinin aineenvaihduntatuotteena olevan pyridoksin 4-pyridoksiinihapon erittymisen väheneminen virtsaan ja seerumin pyridoksaalifosfaatin väheneminen.
Pyridoksaalifosfaatti toimii myös adjuvanttitekijänä delta-aminolevuliinihapon synteesissä, joka on yksi rautaa sisältävän hemoglobiinifraktio-osan eli hemon esiasteista.
Muut tutkimukset ovat osoittaneet, että etanoli vaikuttaa paitsi suoraan myös sen metaboliitin asetaldehydin kautta. Asetaldehydin on myös katsottu lisäävän pyridoksaalifosfaatin hajoamista, mikä johtaa seerumin pyridoksaalifosfaatin vähenemiseen ja heikentää pyridoksaalifosfaatin muodostumista ihmisen punasoluissa in vitro nopeuttamalla fosforyloitujen B6-vitamiiniyhdisteiden hajoamista.
Kun käytetään rautavärjäysmenetelmiä (preussinsininen ja helmiäisvärjäys), muuta kuin hemirautaa sisältävät metallirakeet, oletettavasti hemosideriinin tai ferritiinin muodossa, pyrkivät muodostamaan renkaan erytroblastien ytimen ympärille. Näitä kutsutaan sideroblastirenkaiksi tai rengassideroblasteiksi.
Elektronimikroskooppi on osoittanut, että näissä sideroblasteissa rautakerrostumat ovat mitokondrioiden tai sytoplasmakappaleiden tasolla.
Näihin morfologisiin poikkeavuuksiin liittyvät kaikki tehottoman erytropoieesin piirteet: erytroidien hyperplasia, luuytimen erytroidien esiasteiden lisääntynyt raudanotto, raudan epänormaali sitoutuminen verenkierrossa olevaan hemoglobiiniin ja raudan takaisinvirtaus verenkiertoon aiheuttaen hyperferremiaa, normoblastien tuhoutumista suonensisäisesti, anemiaa ja retikulosytopeniaa.
Sideroblastirenkaan esiintyvyys punasolujen luuytimessä on yleisempää kroonisesti sairailla potilailla ja aliravitsemusta sairastavilla alkoholisteilla.
Kliiniset ja kokeelliset todisteet viittaavat siihen, että ravitsemuksellinen tekijä on tärkeä alkoholipotilaiden sideroblastisen anemian patogeneesissä.
Kokeellinen krooninen alkoholin anto vapaaehtoisille ihmisille on aiheuttanut sideroblastisia muutoksia luuytimessä.
Kun alkoholia annettiin yhdessä vähäisen ruokavalion pyridoksiinin ja folaatin kanssa,
sideroblastien renkaat kehittyivät useimpien tutkittujen henkilöiden kohdalla useiden viikkojen kuluttua.
Vuonna 1970 Hines ja Cowan mainitsevat pyridoksiinin fosforylaation muuttumisen pyridoksalfosfaatiksi, mikä vahvistaa pyridoksiiniaineenvaihdunnan häiriön kolmella tutkimuslinjalla:
Pyridoksalfosfaatin ja sideroblastirenkaiden vähenemistä havaittiin 2:lla 3:sta koehenkilöstä, joita pidettiin alhaisen folaattipitoisuuden ruokavaliolla, johon liittyi alkoholilisä. Tämän jälkeen he osoittivat hematologisen vasteen pyridoksialifosfaatin antamisen jälkeen, mutta eivät foolihapon tai pyridoksiiniterapian jälkeen.
Pyridoksiinin antamisen jälkeen kroonisesti sairastuneilla alkoholisteilla esiintyy pyridoksialifosfaatin muodostumisessa puutetta kontrolliryhmiin verrattuna.
He kuvaavat, että erään erytrosyyttientsyymin suorittama pyridoksiinin muuntaminen pyridoksaalifosfaatiksi vähenee in vitro alkoholisteilla. Tämän perusteella voidaan olettaa, että alkoholi tukahduttaa suoraan erytrosyyttien pyridoksiini-fosforylaasia. Vaihtoehtoinen selitys pyridoksaalifosfaatin vähenemiselle on kuitenkin se, että asetaldehydi, alkoholin tärkein metaboliitti, stimuloi kalvojen fosfataasiaktiivisuutta ja vähentää myös punasoluista plasmaan siirtyvän pyridoksaalifosfaatin määrää.
Mekanismista riippumatta lopputulos on kuitenkin sama, sillä kaikki johtavat erytroblastien (sideroblastien) sisältämän Fe:n määrän lisääntymiseen
Sideroblastoosiin liittyy raudan heikko sitoutuminen punasoluihin, mikä johtaa hypokromiaan, tehottomaan erytropoieesiin ja lisääntyneeseen sideremiaan.
Hemosideroosi alkoholisteilla(korvaa 5:llä) Alkoholistien raudan liikakuormitukseen on yhdistetty useita eri syitä yksin tai yhdessä, mukaan lukien joidenkin alkoholijuomien (erityisesti viinien) aiheuttama raudan merkittävä lisääntyminen, lisääntynyt etanolin aiheuttama mahalaukun suolahapon eritys, hemolyysi, ruoansulatuskanavan verenhukka, foolihapon puutos, lisääntynyt suoliston imeytyminen maksavaurion vuoksi ja haimavaurio, mikä lisää entisestään sideremiaa ja johtaa hemosideroosiin.
Useissa tutkimuksissa on todettu, että alkoholipotilaiden seerumin ferritiinipitoisuudet ovat kohonneet, mikä heijastaa lisääntyneitä rautavarastoja.
Rautakelaattoreiden, kuten desferroksamiinin, antamisen ja siderurian mittaamisen jälkeen rautavarastot voidaan arvioida puolikvantitatiivisesti. Alkoholisteilla raudan erittyminen näiden kelaattorien jälkeen on myös lisääntynyt kontrolliryhmiin verrattuna.
Muut tutkimukset osoittavat kuitenkin sairaalahoidossa olevilla alkoholistipotilailla, että sekä seerumin rauta- ja/tai ferritiinipitoisuudet ovat normaalin rajoissa tai harvemmin koholla. Jos potilaalla on ruokatorven suolistoverenvuoto ruokatorven suonikohjujen vuoksi, hänen rautavarastonsa voivat olla tyhjentyneet, vaikka ne olisivat ennen verenvuotoa olleet normaalia suuremmat.
Loppujen lopuksi on huomattava, että useimmissa seerumin rautapitoisuuden mittaamiseksi tehdyissä tutkimuksissa se todettiin aina kohonneeksi alkoholisteilla, ja rautaesiintymien ja kulutetun alkoholin määrän välillä oli korrelaatio, mikä viittaa siihen, että tämä elementti on sideroosin aiheuttaja.
Raudan imeytyminen
Vuorokaudessa nautitusta raudasta noin 5-15 mg:sta imeytyy vain 10 %.
Raudan imeytymiseen vaikuttavat tekijät voivat puuttua kolmella tasolla: intraluminaalisesti, limakalvolla ja yleisesti.
Raudan imeytymisen intraluminaalisella tasolla tiedetään riippuvan eri ruoka-aineiden vuorovaikutuksesta siten, että jotkin, kuten aminohapot, helpottavat imeytymistä ja toiset saattavat vähentää sitä. Ruoansulatuskanavan eritteiden puuttuminen voi olla imeytymistä muokkaava tekijä.
Yritettiin selittää hemosideroosia, ja aluksi ajateltiin, että alkoholistipotilaiden ruokavalio sisältäisi runsaasti tätä elementtiä. Tämä havainto perustui niin sanottuun bantushemosideroosiin tai bantushemosideroosiin. Eteläafrikkalaisten näille heimoille tekemissä tutkimuksissa havaittiin, että heidän valmistamansa kefir-niminen juoma, eräänlainen olut, valmistettiin rauta-astioissa, ja sen rautapitoisuus oli 30-100 mg litrassa. Juoman alkoholipitoisuus oli hyvin alhainen, ja he käyttivät sitä suuria määriä, jopa 1000 mg rautaa päivittäin. Kefiirin valmistusta ei enää harjoiteta, minkä seurauksena hemosideroosi on hävinnyt tästä heimosta.
Alkoholijuomien sisältämän raudan määrä vaihtelee suuresti, ja se voi olla jopa 350 mg litrassa (Romania), vaikka yleisesti ottaen voidaankin katsoa, että viinissä (valko-, viininpunainen tai punaviini) on runsaasti tätä metallia.
Mutta on myös monia alkoholisteja, joiden pääjuoma ei ole viini vaan viski, olut tai muut juomat, jotka sisältävät vain vähäisiä määriä rautaa.
Toisaalta bantus-tutkimuksesta huolimatta liiallinen raudan saanti ravinnosta ei ole riittävä syy hemosideroosin kehittymiseen. Etiopiassa ruokavalion perustana on teff, joka on runsaasti rautaa sisältävä siemen, jota saadaan päivittäin 300-500 mg. Tästä saannista huolimatta esiintymät eivät lisäänny, eikä raudanpuuteanemian esiintyvyys poikkea väestöstä.
On siis selvää, että ravinnon sisältämällä raudan määrällä ei ole mitään merkitystä.
Se näyttäisi toistaiseksi siltä, että alkoholilla ei ole merkitystä intraluminaalisella tasolla raudan imeytymiseen.
Yleisellä tasolla tiedetään, että rautavarastojen tila vaikuttaa niiden imeytymiseen; jos rautavarastot ovat pienentyneet, imeytyminen lisääntyy ja päinvastoin. Erytropoieesi osallistuu myös tällä tasolla ja lisää sen imeytymistä, kun se lisääntyy. Alkoholi ei näytä kiihdyttävän plasman raudan kiertoa, mikä voisi selittää sen imeytymisen lisääntymisen.
Limakalvotasolla raudan imeytymiseen voivat vaikuttaa limakalvon sisältämän raudan määrä sekä proteiinisynteesin taso. On osoitettu, että alkoholin nauttimisen jälkeinen foolihapon puute voi olla vastuussa lisääntyneestä raudan imeytymisestä ja sitä seuraavasta sideroosista, joka pahentaa alkoholin haitallisia vaikutuksia parenkyymiin ja erityisesti maksaan.
Eläinkokeissa on osoitettu, että krooniseen alkoholin nauttimiseen voi liittyä raudan imeytymisen lisääntyminen suolistossa, jonka mekanismia ei tunneta.
Viime vuosikymmenen aikana on osoitettu ainakin kolme mekanismia, jotka osallistuvat raudan siirtymiseen pohjukaissuolen limakalvon läpi:
Transporterivälitteinen(säännelty)
Passiivinen mekanismi, jota välittävät esteröimättömät rasvahapot
(Sääntelemätön) parasellulaarinen kulkeutuminen
In vivo- ja in vitro -tutkimukset ovat osoittaneet lisääntynyttä suolen läpäisevyyttä kroonisilla alkoholisteilla, mikä tarjoaa mahdollisen mekanismin raudan imeytymiselle suolistoon.
Toiset tutkimukset viittaavat siihen, että alkoholipotilaiden suolen limakalvon luontainen kyky ottaa rautaa saattaa olla lisääntynyt.
Havaittiin, että niillä, joilla seerumin rautapitoisuus oli suurentunut, rauta-arvot laskivat ensimmäisen sairaalahoitoviikon aikana retikulosyyttien kehittymisen myötä. Lisäksi havaittiin, että sideroblastiset muutokset olivat palautuvia, mikä on samaa mieltä muiden kirjoittajien kanssa. Tyypilliset renkaat hävisivät luuytimestä ensimmäisen sairaalahoitoviikon aikana, vaikka osa niistä säilyi vielä kahdentoista päivän ajan.
Kroonista alkoholismia sairastavilla potilailla on hiljattain (korvaa 6) todettu kohonneita seerumin asialotransferriinipitoisuuksia; tämä osoittaa lisääntynyttä kykyä vapauttaa rautaa kudoksiin, erityisesti hepatosyytteihin, verrattuna normaaleihin transferriinivariantteihin.
On huomautettu, että sideroblastisten muutosten ja folaatin puutteen välillä voi olla myös vahva yhteys. On esitetty, että tämä puute voi olla välttämätön edellytys sideroblastisten muutosten ilmenemiselle alkoholisteilla, vaikka muut kirjoittajat ovatkin eri mieltä, sillä huomattavasta anemiasta huolimatta heillä ei ollut megaloblastisia muutoksia luuytimessä eikä makrosytoosia tai neutrofiilistä hypersegmentaatiota perifeerisessä veressä, ja seerumin ja erytrosyyttien folaattipitoisuudet olivat normaalit.
On tärkeää huomata, että alkoholistipotilailla tuberkuloosista, pahanlaatuisista sairauksista tai munuaisten vajaatoiminnasta johtuvaan kroonisten sairauksien anemiaan liittyy usein sideroblastinen anemia, joka on hyvin yleinen tässä väestössä.
Yhteenvetona voidaan todeta, että alkoholin käyttö yhdessä riittämättömän ruokavalion kanssa johtaa todennäköisesti sideroblastisen anemian ja hemosideroosin kehittymiseen, joiden patogeneesiä ei ole vielä selvitetty, ja todennäköisiin tekijöihin kuuluvat:
Alkoholin myrkyllinen vaikutus yhteen tai useampaan hemisynteesin vaiheeseen.
Yhteys huonoon ravitsemustilaan, joka johtaa pyridoksaalifosfaatin ehtymiseen ja asetaldehydin, maksasairauden tai molempien aiheuttamaan kiihtyneeseen kataboliaan
Vahvistunut folaatinpuutos, ja jossa ravinnosta luopumisella ja sen korvaamisella on suuri merkitys.
Kliininen tapaus:
55-vuotias miespotilas otettiin vastaan kolmen kuukauden ajan alaraajojen (1/6 suprapatellaarinen, 2/6 infrapatellaarinen) ja ristiluun pehmeän koostumuksen turvotuksella, vatsan turvotuksella, limakalvojen ihon kalpeudella, astenialla ja etenevällä adynamialla.
Historia:
Krooninen alkoholismi (2-3 litraa viiniä ja/tai olutta päivässä) ja tupakointi (40 savuketta päivässä), molemmat viimeiset 30 vuotta.
Tutkimustulokset osastolla tehdyistä tutkimuksista:
Rintakehän röntgenkuvaus: oikean costodiaphragmaattisen sivuontelon tyhjennys. Sydän- ja rintaindeksi hieman kohonnut.
Paracentesis: eksudatiivisia piirteitä.
Transfuusio: HTO:n vuoksi. 2 yksikön deplasmatisoitujen punasolujen verensiirto indikoitu.
Presumptiivinen diagnoosi:
Etiologinen: Krooninen etylismi. Tupakointi.
Patofysiologinen: Ascitic-ödeemaattinen oireyhtymä. Ascitic-ödeemaattinen oireyhtymä. Ascitic-edematous sme. Anemia. Pleuraeffuusio. Maksan vajaatoiminta.
Anatomopatologinen: Hepatomegalia. Kardiomegalia.
Sairaalahoidon aikana tehtyjen tutkimusten tulokset:
FEDA: Krooninen gastriitti.
Kaksoiskontrastiperäruiske paksusuolessa: Suoliston läpikulku säilynyt.
Echokardiogrammi: Kohtalainen perikardiaalinen effuusio.
Echopleuraalinen: Oikea pleuraeffuusio.
Echoabdominaalinen: Maksa yhteensopiva rasvamaksan kanssa.
Serologia: negatiivinen VDRL:n, Chagasin, B- ja C-hepatiitin suhteen.
PAMO ja BMO: Luuydin, jossa on vaikea punaisen sarjan dyspoiesis.
Perls: havaitaan lisääntyneitä solunsisäisiä ja solunulkoisia rautarakeja.
PBH: saatu materiaali oli huonosti edustavaa diagnostisten johtopäätösten tekemiseksi.
Laboratorio
Hematokriitti (%): vaihteli välillä 11.8-19
Punasolut (x10E12/l): vaihtelu 1,1-1,94
Valkosolut (x10E9/l): vaihtelu 7,7-9.2
Hemoglobiini (g/dl): vaihteli välillä 4,4-6.8
Trombosyytit (x10E9/l): vaihteli 102:sta 346:een
Ferremia (mg/dl): vaihteli 248:sta 75:een
Ferritiini (ng/dl): 594
TIBC (raudan kokonaissitomiskapasiteetti) (mg/dl): 360
Transferriinin kyllästysprosentti: vaihteli välillä 95-24
Total Bilirubiini (mg/dl): vaihteli välillä 1.6 – 0,51
Suora bilirubiini (mg/dl): vaihteli välillä 1,92 – 0,18
Suora bilirubiini (mg/dl): vaihteli välillä 2,99 – 0,33
Lääkehoito:
Hyposodium- ja proteiinipitoinen ruokavalio. Vesirajoitus.
PHP 21 tippaa minuutissa vuorotellen. Albumiinia yksi injektiopullo rinnakkain 8 tunnin välein ja sen jälkeen yksi ampulli furosemidiä. Spironolaktoni yksi tabletti 12 tunnin välein. Fytomenadioni (Konakion) yksi ampulli 12 tunnin välein.
Laktuloosi (Lactulon) yksi ruokalusikallinen 6 tunnin välein. B-vitamiinikompleksi yksi tabletti 12 tunnin välein.
Potilaan hyvän vasteen vuoksi jatketaan suun kautta annettavaa lääkehoitoa diureeteilla ja B-kompleksilla. Laktuloosin ja fytomenadionin käyttö lopetettiin.
Potilaalla oli suotuisa kliininen kehitys askiittisen ödeemaattisen tilansa suhteen, minkä vuoksi hänet kotiutettiin, hänelle annettiin B-vitamiinilääkitystä ja häntä neuvottiin olemaan juomatta alkoholia.
Sairaalamme lääketieteellisen klinikan poliklinikoiden ja Álvarezin sairaalan hematologian yksikön jatkuva lääketieteellinen valvonta..
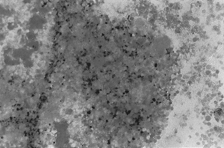
PAMO X 100
– Perlsin värjäys. Selvästi erottuu medullaarinen kyhmy, jossa on voimakas solunulkoinen rautakerrostuma.
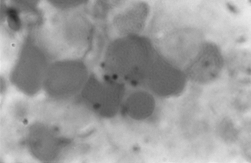
PAMO X 1000
– Perls-värjäys. Trombosyyttien sisäisiä rautakerrostumia on havaittu.
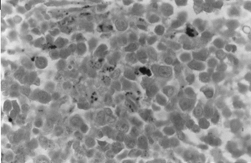
BMOX100
– Perls-värjäys. Kun havaitaan tiheitä intra- ja extra-erythroblastisia rautakertymiä.
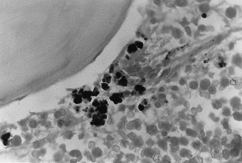
BMO X 1000
– Peris-värjäys. Kun havaitaan tiheitä intra- ja extraitroblastisia rautakertymiä.
Potilaalla oli hyvä internoinnin jälkeinen kehitys. Kuudenkymmenen päivän kuluttua häneltä otettiin verikoe, jonka tulokset olivat seuraavat: HTO 43 %, GR 5,1 X 10E12/L, GB 8,7 X10E9/L, HB 13,9 g/di, Plaq.354 X10E9/L, ja hän noudatti ainoastaan hoitoa.
Sadan kahdenkymmenen päivän kuluttua häntä seurattiin uudelleen samoilla verikokeen tuloksilla.
Sadan kahdenkymmenen päivän kuluttua häntä seurattiin uudelleen samoilla verikokeen tuloksilla.