Happojen voimakkuutta hallitseva yleisin periaate voidaan todeta seuraavasti: vahvoilla hapoilla on suhteellisen stabiileja konjugaattiemäksiä. Yleisesti ottaen mitä vakaampi konjugaattiemäs on, sitä vahvempi happo on. Tärkeää on muistaa, että stabiilius ja reaktiivisuus ovat käänteisiä. Mitä vakaampi aine on, sitä vähemmän se on reaktiivinen, ja päinvastoin. Näin ollen toinen tapa ilmaista yllä oleva sääntö on sanoa, että vahvoilla hapoilla on heikot konjugaattiemäkset. HCl ja H3O+ ovat vahvoja happoja. Vastaavasti vastaavat konjugaattiemäkset, Cl- ja H2O, ovat heikkoja (hyvin stabiileja). Kloridi-ioni on stabiili, koska negatiivinen varaus sijaitsee hyvin elektronegatiivisessa atomissa. Vesimolekyyli on yksi vakaimmista tunnetuista aineista.
Miten tiedämme, mikä protoni on happamampi molekyylissä (kuten etikkahapossa), joka sisältää useampaa kuin yhtä protonityyppiä? Muista, että mitä suurempi on protonin positiivisen luonteen aste, sitä happamampi se on. PKa-taulukon tarkastelu paljastaa joitakin happamien protonien suuntauksia. Seuraavia ohjeita voidaan käyttää happamuuden ennustamiseen.
1. Suoraan hyvin elektronegatiivisiin atomeihin, kuten happeen, rikkiin ja halogeeneihin, kiinnittyneet vetygeenit ovat huomattavan happamia.
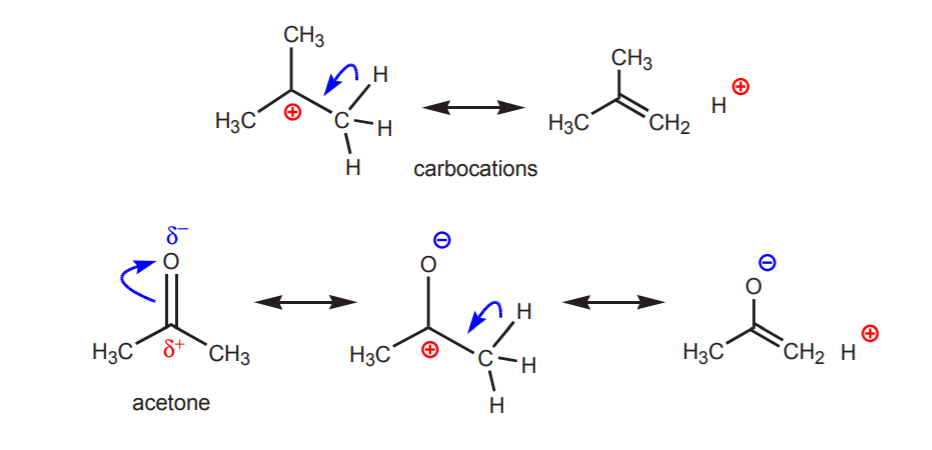
2. Positiivisesti varautuneeseen typpeen, happiin tai rikkiin kiinnittyneet vetygeenit ovat happamia. Näiden atomien suuri elektronegatiivisuus tekee niistä epämiellyttävän positiivisen varauksen kanssa. Ne pyrkivät hajottamaan varauksen viereisten atomien kesken vetämällä niiltä elektronitiheyttä. Tämä voidaan osoittaa piirtämällä resonanssirakenteet kuvan mukaisesti.
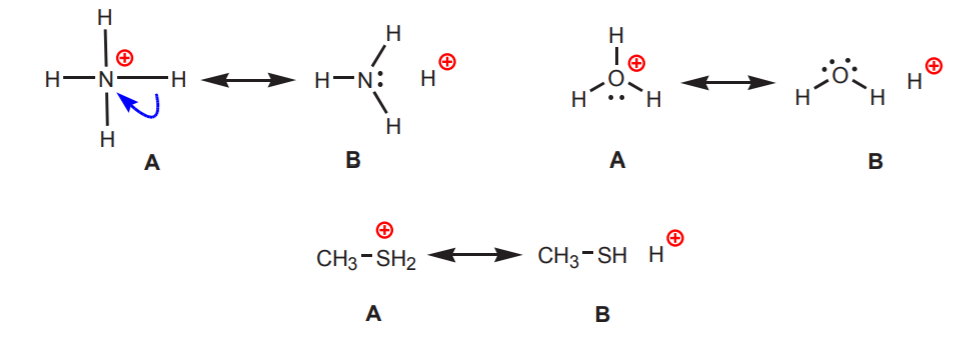
Kaikin rakenne B paljastaa vedyn positiivisen luonteen ja siten sen happaman luonteen.
3. Kuten alkaanien ja alkeenien pKa-arvot osoittavat, hiileen kiinnittyneet vedyt ovat hyvin vähähappoisia. Tällaisia aineita ei yleensä pidetä lainkaan happoina. Jotkin hiilivedyt voivat kuitenkin olla heikosti happamia, jos niiden konjugaattiemäkset ovat stabiileja ioneja. Näin voi tapahtua seuraavissa tapauksissa:
a) Tarkasteltavan protonin lähellä on yksi tai useampi elektronegatiivinen atomi. Näiden elektronegatiivisten atomien induktiivinen vaikutus jättää läheisyydessä olevat vetyatomit vaille elektronitiheyttä ja siten osittain positiivisen luonteen.
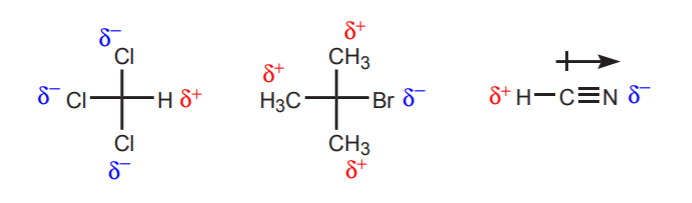
b) Vetyatomi, joka on sitoutunut hiileen, joka puolestaan on sitoutunut toiseen hiileen, joka kantaa osittaista tai täyttä positiivista varausta, on hapan.
Näytettyjen protonien happamuus tulee esiin eliminaatioreaktioissa (luku 6) ja enolien kemiassa (luku 22), kun emäksen läsnäolo johtaa protoninsiirtoa sisältävän vaiheen kautta alkeenien tai enolaatti-ionien muodostumiseen.
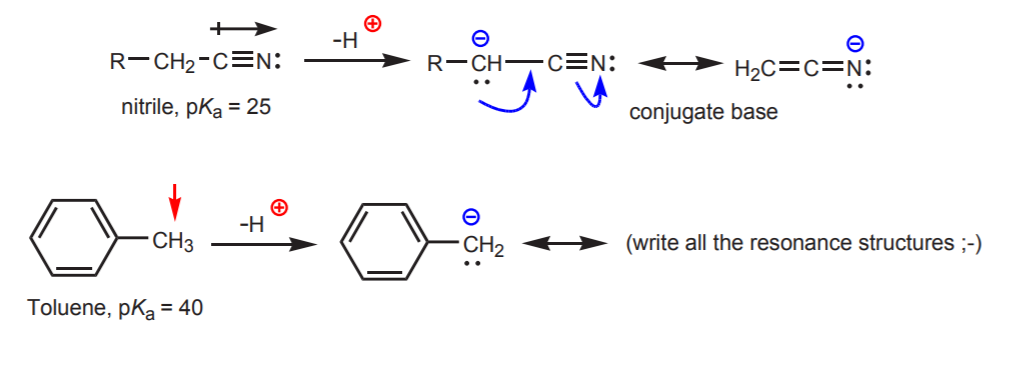
c) Konjugaattiemäs on resonanssistabiloitunut. Tämä vaikutus on tärkein silloin, kun happamuutta lisää jokin muu tekijä, kuten dipolin tai elektronegatiivisen atomin läsnäolo (kuten nitriilifunktionaalisessa ryhmässä, -CN). Muutoin resonanssistabilointi ei yksinään riitä lisäämään dramaattisesti hiileen kiinnittyneen vedyn happamuutta (kuten tolueenissa, jossa pKa on vain 40).
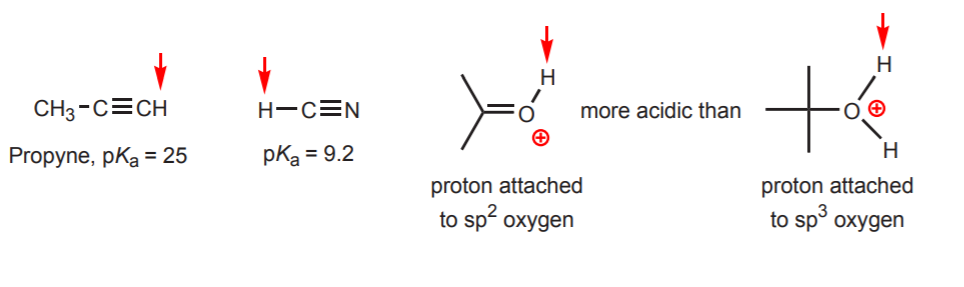
d) Vety on kiinnittynyt sp-hybridisoituneeseen hiileen. Hybridisaation vaikutuksia happamuuteen käsitellään luvussa 9. Hybridisaation suuntauksia voidaan laajentaa hiilen lisäksi myös happiin ja typpeen, kuten oikealla olevassa esimerkissä.