Das chemische Element Wasserstoff gehört zu den Nichtmetallen. Bei sehr hohem Druck kann er metallisch werden. Es wurde 1766 von Henry Cavendish entdeckt.

Datenbereich
| Klassifizierung | Wasserstoff ist ein Nichtmetall. Er kann bei sehr hohem Druck metallisch werden. |
| Farbe | farblos |
| Atomgewicht | 1.0079 |
| Zustand | Gas |
| Schmelzpunkt | -259,14 oC, 14,01 K |
| Siedepunkt | -252,87 oC, 20.28 K |
| Elektronen: | 1 |
| Protonen: | 1 |
| Neutronen im reichlichsten Isotop: | 0 |
| Elektronenschalen | 1 |
| Elektronenkonfiguration | 1s1 |
| Dichte @ 20oC | 0.0000899 g/cm3 |
Mehr anzeigen, darunter: Wärme, Energie, Oxidation,
Reaktionen, Verbindungen, Radien, Leitfähigkeiten
| Atomisches Volumen | 14.4 cm3/mol |
| Struktur | hcp: hexagonal dicht gepackt (als Festkörper bei tiefen Temperaturen) |
| Härte | – |
| Spezifische Wärmekapazität | 14.304 J g-1 K-1 |
| Schmelzwärme | 0,117 kJ mol-1 von H2 |
| Zerstäubungswärme | 218 kJ mol-1 |
| Verdampfungswärme | 0.904 kJ mol-1 von H2 |
| erste Ionisierungsenergie | 1312 kJ mol-1 |
| zweite Ionisierungsenergie | kJ mol-1 |
| dritte Ionisierungsenergie | 11815.0 kJ mol-1 |
| Elektronenaffinität | 72.7711 kJ mol-1 |
| Minimale Oxidationszahl | -1 |
| Min. gemeinsame Oxidationszahl | -1 |
| Maximale Oxidationszahl | 1 |
| Max. gemeinsame Oxidationszahl | 1 |
| Elektronegativität (Pauling-Skala) | 2,18 |
| Polarisierbarkeit Volumen | 0.7 Å3 |
| Reaktion mit Luft | heftig, ⇒ H2O |
| Reaktion mit 15 M HNO3 | keine |
| Reaktion mit 6 M HCl | keine |
| Reaktion mit 6 M NaOH | keine |
| Oxid(e) | H2O |
| Hydrid(e) | H2 |
| Chlorid(e) | HCl |
| Atomradius | 25 pm |
| Ionradius (1+ Ion) | – |
| Ionischer Radius (2+ Ion) | – |
| Ionischer Radius (3+ Ion) | – |
| Ionischer Radius (1- Ion) | – |
| Ionenradius (2- Ion) | – |
| Ionenradius (3- Ion) | – |
| Wärmeleitfähigkeit | 0.1805 W m-1 K-1 |
| Elektrische Leitfähigkeit | – |
| Gefrier-/Schmelzpunkt: | -259,14 oC, 14,01 K |

Nasa-Bild: Riesige Mengen von Wasserstoff in fernen Galaxien.

Theophrastus Paracelsus – Der erste Mensch, der Wasserstoff erzeugt: „Luft entsteht und bricht hervor wie ein Wind.“
Entdeckung des Wasserstoffs
Ein beliebtes Chemieexperiment in der Schule ist es, ein Metall wie Magnesium in eine Säure zu geben. Das Metall reagiert mit der Säure, bildet ein Salz und setzt Wasserstoff aus der Säure frei. Das Wasserstoffgas steigt aus der Flüssigkeit auf, und die Schüler sammeln es in kleinen Mengen für weitere Experimente, wie z. B. den „Knalltest“.
Der erste aufgezeichnete Fall von Wasserstoff, der durch menschliches Handeln hergestellt wurde, fand in der ersten Hälfte des 15. Jahrhunderts statt, und zwar mit einer ähnlichen Methode, wie sie heute in Schulen angewandt wird: Der Arzt Theophrastus Paracelsus löste Eisen in Schwefelsäure auf und beobachtete die Freisetzung eines Gases. Er soll über das Experiment gesagt haben: „Luft entsteht und bricht aus wie ein Wind“. Er entdeckte jedoch keine der Eigenschaften von Wasserstoff.(1)
Turquet De Mayerne wiederholte 1650 das Experiment von Paracelsus und stellte fest, dass das Gas brennbar war.(2) Weder Paracelsus noch De Mayerne schlugen vor, dass Wasserstoff ein neues Element sein könnte. Tatsächlich glaubte Paracelsus, dass es nur drei Elemente gab – die tria prima – Salz, Schwefel und Quecksilber – und dass alle anderen Stoffe aus verschiedenen Kombinationen dieser drei bestanden. (3) (Die Chemie hatte noch einen langen Weg vor sich!)
Im Jahr 1670 fügte der englische Wissenschaftler Robert Boyle der Schwefelsäure Eisen hinzu. Er wies nach, dass das entstehende (Wasserstoff-)Gas nur brannte, wenn Luft vorhanden war, und dass ein Teil der Luft (wir würden ihn heute als Sauerstoff bezeichnen) bei der Verbrennung verbraucht wurde.(4)
Wasserstoff wurde erstmals 1766 von dem englischen Wissenschaftler Henry Cavendish als eigenständiges Element erkannt, als er ihn durch Reaktion von Salzsäure mit Zink herstellte. Er beschrieb Wasserstoff als „entflammbare Luft aus Metallen“ und stellte fest, dass es sich um dasselbe Material handelte (durch seine Reaktionen und seine Dichte), unabhängig davon, welches Metall und welche Säure er zu seiner Herstellung verwendete.(1) Cavendish beobachtete auch, dass bei der Verbrennung der Substanz Wasser entstand.
Der französische Wissenschaftler Antoine Lavoisier gab dem Element später den Namen Wasserstoff (1783). Der Name kommt vom griechischen „hydro“, was Wasser bedeutet, und „genes“, was „bilden“ bedeutet – Wasserstoff ist eines der beiden wasserbildenden Elemente.
Im Jahr 1806, als sich Wasserstoff als Element etabliert hatte, leitete der englische Chemiker Humphry Davy einen starken elektrischen Strom durch gereinigtes Wasser.
Er stellte fest, dass sich Wasserstoff und Sauerstoff bildeten. Das Experiment zeigte, dass Elektrizität Stoffe in ihre Bestandteile zerlegen kann. Davy erkannte, dass Stoffe durch ein elektrisches Phänomen miteinander verbunden sind; er hatte die wahre Natur der chemischen Bindung entdeckt.(5)
Besuchen Sie Chemicool’s Cool Hydrogen Facts Page.

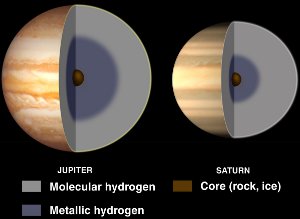
Inneres von Jupiter und Saturn, mit flüssigem metallischem Wasserstoff. Mit freundlicher Genehmigung von NASA/JPL-Caltech.

Nasa: Der externe Treibstofftank des Space Shuttle (orange) ist mit flüssigem Wasserstoff und Sauerstoff gefüllt.

Wasserstoffautos stoßen Wasser und keine Schadstoffe aus.

Labor-Elektrolyse von Wasser. Elektrische Energie wird zur Spaltung von Wasser verwendet. In einem Reagenzglas sammelt sich Wasserstoff, im anderen Sauerstoff.
Aussehen und Eigenschaften
Schädliche Wirkungen:
Wasserstoff ist leicht entzündlich und hat eine fast unsichtbare Flamme, die zu versehentlichen Verbrennungen führen kann.
Eigenschaften:
Wasserstoff ist das einfachste und leichteste Element von allen. Es ist auch das bei weitem häufigste Element im Universum. Über 90 Prozent der Atome im Universum sind Wasserstoff.
In seiner einfachsten Form besteht das Wasserstoffatom aus einem Proton, einem Elektron und keinen Neutronen. Wasserstoff ist das einzige Element, das ohne Neutronen existieren kann.
Wasserstoff ist ein farbloses, geruchloses Gas, das bei Standardtemperatur und -druck als zweiatomige Moleküle, H2, existiert.
Es brennt und bildet explosive Gemische in der Luft und reagiert heftig mit Oxidationsmitteln.
Auf der Erde befindet sich der größte Teil des Wasserstoffs im Wasser, H2O. Es gibt nur wenig freien Wasserstoff auf der Erde, weil Wasserstoff so leicht ist, dass er nicht von der Schwerkraft des Planeten gehalten wird. Jeder Wasserstoff, der sich bildet, entweicht schließlich aus der Atmosphäre in den Weltraum.
Obwohl Wasserstoff normalerweise ein Nichtmetall ist, wird er zu einem flüssigen Metall, wenn enormer Druck auf ihn ausgeübt wird.
Ein solcher Druck herrscht auf Gasriesenplaneten wie Jupiter und Saturn. Man nimmt an, dass das starke Magnetfeld des Jupiters (14-mal so stark wie das der Erde) durch einen Dynamo-Effekt verursacht wird, der durch elektrisch leitenden metallischen Wasserstoff entsteht, der bei der Rotation des Planeten zirkuliert.
Verwendung von Wasserstoff
Große Mengen Wasserstoff werden im Haber-Prozess (Herstellung von Ammoniak), bei der Hydrierung von Fetten und Ölen, bei der Methanolherstellung, beim Hydrocracken und bei der Hydrodesulfurierung verwendet. Wasserstoff wird auch bei der Metallraffination verwendet.
Flüssiger Wasserstoff wird als Raketentreibstoff verwendet, z. B. für den Start und den Aufstieg des Space Shuttle in die Umlaufbahn. Flüssiger Wasserstoff und Sauerstoff befinden sich in dem großen externen Treibstofftank des Shuttles. (Siehe Bild links.)
Die beiden schwereren Isotope des Wasserstoffs (Deuterium und Tritium) werden bei der Kernfusion verwendet.
Die Wasserstoffwirtschaft wurde als Ersatz für unsere derzeitige kohlenwasserstoffbasierte Wirtschaft (Öl, Gas und Kohle) vorgeschlagen.
Die Grundlage der Wasserstoffwirtschaft besteht darin, dass bei der Verbrennung von Wasserstoff mit Sauerstoff Energie erzeugt wird und das einzige Nebenprodukt der Reaktion Wasser ist.
Zurzeit wird der Wasserstoff für wasserstoffbetriebene Autos jedoch aus Kohlenwasserstoffen hergestellt. Erst wenn z.B. Sonnen- oder Windenergie kommerziell genutzt werden kann, um Wasser in Wasserstoff und Sauerstoff zu spalten, wird eine echte Wasserstoffwirtschaft möglich sein.
Häufigkeit und Isotope
Häufigkeit Erdkruste: 1400 Gewichtsteile pro Million (0,14 %), 2,9 % nach Molen
Häufigkeit Sonnensystem: 75 % nach Gewicht, 93 % nach Molen
Kosten, rein: 12 $ pro 100 g
Kosten, lose: $ pro 100 g
Quelle: Wasserstoff wird kommerziell durch Reaktion von überhitztem Dampf mit Methan oder Kohlenstoff hergestellt. Im Labor kann Wasserstoff durch die Einwirkung von Säuren auf Metalle wie Zink oder Magnesium oder durch die Elektrolyse von Wasser hergestellt werden (siehe links).
Isotope: Wasserstoff hat drei Isotope, 1H (Protium), 2H (Deuterium) und 3H (Tritium). Die beiden schwereren Isotope (Deuterium und Tritium) werden für die Kernfusion verwendet. Protium ist das am häufigsten vorkommende Isotop, Tritium das am wenigsten häufig vorkommende. Tritium ist instabil und hat eine Halbwertszeit von etwa 12 Jahren und 4 Monaten. Natürlich vorkommender Wasserstoff ist ein Gemisch aus den beiden Isotopen 1H und 2H mit einer natürlichen Häufigkeit von 99,99 % bzw. 0,01 %.

- Peter Hoffmann, Tomorrow’s Energy: Hydrogen, Fuel Cells, and the Prospects for a Cleaner Planet, (2001) p22. MIT Press, Cambridge, MA.
- P. Litherland Teed, The Chemistry and Manufacture of Hydrogen, (2008) S. 2. Dabney Press.
- John S. Davidson, Annotations to Boyle’s „The Sceptical Chymist“.
- Andreas Züttel, Andreas Borgschulte, Louis Schlapbach, Hydrogen as a future energy carrier., (2008) p8. Wiley-VCH, Weinheim.
- Kendall Haven, 100 Greatest Science Discoveries of All Time., (2007) p62. Libraries Unlimited.
Diese Seite zitieren
Für die Online-Verknüpfung kopieren Sie bitte eine der folgenden Möglichkeiten:
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen</a>
oder
<a href="https://www.chemicool.com/elements/hydrogen.html">Hydrogen Element Facts</a>
Um diese Seite in einem akademischen Dokument zu zitieren, verwenden Sie bitte die folgende MLA-konforme Zitierweise:
"Hydrogen." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hydrogen.html>.