Structure, Dynamics, and Function of Aquaporins
 2004 Winner of Visualization Challenge in Science and Engineering,
2004 Winner of Visualization Challenge in Science and Engineering, Organized by the National Science Foundation and Science Magazine. (Siehe den zugehörigen Science-Artikel.)
Unser Wasserpermeationsfilm und der Nobelpreis für Chemie 2003
Die Kunst des Wassertransports in Aquaporinen
Aquaporine sind Membranwasserkanäle, die bei der Kontrolle des Wassergehalts von Zellen eine entscheidende Rolle spielen. Diese Kanäle sind in allen Reichen des Lebens weit verbreitet, einschließlich Bakterien, Pflanzen und Säugetieren. Im menschlichen Körper wurden mehr als zehn verschiedene Aquaporine gefunden, und mehrere Krankheiten, wie angeborener Katarakt und nephrogener Diabetes insipidus, hängen mit der gestörten Funktion dieser Kanäle zusammen. Sie bilden Tetramere in der Zellmembran und erleichtern den Transport von Wasser und in manchen Fällen auch von anderen kleinen gelösten Stoffen durch die Membran. Die Wasserporen sind jedoch für geladene Stoffe wie Protonen völlig undurchlässig, eine bemerkenswerte Eigenschaft, die für die Erhaltung des elektrochemischen Potenzials der Membran von entscheidender Bedeutung ist, aber gleichzeitig paradox ist, da Protonen normalerweise leicht durch Wassermoleküle transportiert werden können. Die Ergebnisse unserer Simulationen haben nun neue Einblicke in den Mechanismus gewährt, der dieser faszinierenden Eigenschaft zugrunde liegt. Wassermoleküle, die den Kanal passieren, werden durch die elektrostatischen Kräfte des Proteins gezwungen, sich in der Mitte des Kanals umzudrehen (siehe Animation), wodurch die alternative Donor-Akzeptor-Anordnung unterbrochen wird, die für die Protonenverschiebung notwendig ist (lesen Sie die vollständige Geschichte in unserem Sciencepaper).

Funktionelle Bedeutung einer eigentümlichen Proteinarchitektur
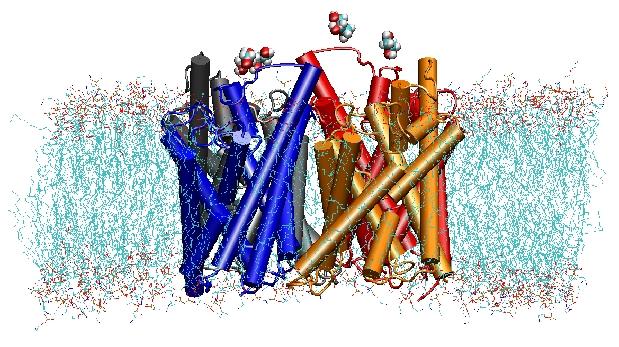
Im Jahr 2000 gelang es Strouds Labor an der UCSF, die erste hochauflösende Struktur eines Aquaporins durch Röntgenkristallographie zu lösen. Bei der untersuchten Struktur handelte es sich um die des E. coliglycerol uptake facilitator (GlpF), der ein Aquaglyceroporin ist, d.h. der Kanal ist auch für kleine lineare Zuckermoleküle wie Glycerin durchlässig. MD-Simulationen im Nanosekundenbereich von tetramerem GlpF in einem hydratisierten Patch einer POPE-Lipiddoppelschicht charakterisierten den vollständigen Weg der Substratleitung im Kanal. Die Analyse der Wasserstoffbrückenbindungs-Wechselwirkungen des Substrats mit dem Inneren des Kanals erklärte auch zum ersten Mal, warum diese Kanäle zwei charakteristische Schleifen in ihre Architektur einbauen, einschließlich energetisch ungünstiger Sekundärstrukturelemente, die in der gesamten Aquaporinfamilie konserviert sind (Jensenet al., Structure, 2001).
Energetik der Zuckerpermeation
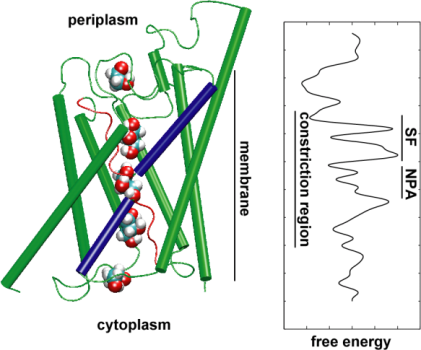
Anschließend untersuchten wir die Energetik des Transportereignisses, um zu verstehen, welche Barrieren ein Substrat während seiner Passage durch den Kanal überwinden muss. Um das Profil der freien Energie zu beschreiben, berechneten wir das Potenzial der mittleren Kraft für die vollständige Leitung aus den Trajektorien, in denen die Bewegung von Glycerin durch den Kanal durch Anwendung externer Kräfte beschleunigt wurde. Diese Technik, die als gesteuerte Molekulardynamik (SMD) bekannt ist, ermöglicht es, langsame Ereignisse innerhalb der für MD-Simulationen zugänglichen Zeitskala zu beobachten. Aufgrund des Nicht-Gleichgewichtscharakters der Trajektorien steht man bei der Analyse der Ergebnisse jedoch vor dem Problem der irreversiblen Arbeit, die berücksichtigt werden muss. Mit Hilfe der Jarzinsky-Identität, der Gleichheit zwischen freier Energie und Arbeit in Nicht-Gleichgewichtssystemen, konnten wir die Energetik des Glycerintransports durch den Kanal vollständig beschreiben. Das berechnete Potenzial der mittleren Kraft erfasst die wichtigsten Bindungsstellen und Barrieren im Kanal in enger Übereinstimmung mit den Ergebnissen der MD-Gleichgewichtssimulationen und der Kristallstruktur. Darüber hinaus weist es eine ausgeprägte Asymmetrie in seiner Form auf, was darauf hindeutet, dass die asymmetrische Struktur des Proteins für eine effiziente Aufnahme von Nährstoffmolekülen aus der Umgebung funktionell wichtig sein könnte. (Jensen, etal., PNAS, 2002).
Was macht ein Aquaporin zu einem Glycerin-Kanal
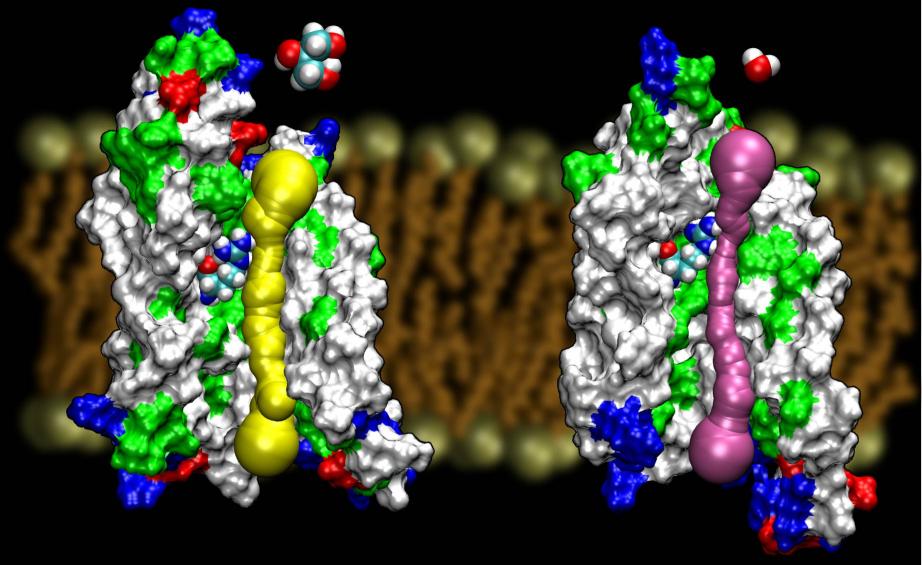
Aquaporine sind eine sehr glückliche Familie von Membranproteinen, die notorisch resistent gegen Strukturbestimmung sind. Wir haben hochaufgelöste Strukturen von mehreren AQPs: GlpF, AQP1, AQP0, undAqpZ. Es wird erwartet, dass bald weitere Strukturen auftauchen werden. Die Verfügbarkeit der Struktur von zwei AQPs aus E. coli, von denen der eine ein reiner Wasserkanal (AqpZ) und der andere ein Glycerinkanal (GlpF) ist, bot uns die einzigartige Gelegenheit, die Selektivitätsprinzipien zu verstehen, die die Natur bei der Verwendung von zwei genetisch und strukturell hochhomologen Kanälen für den Membranverkehr verschiedener Stoffe anwendet.Der Vergleich der für die Leitung von Glycerin in diesen beiden Kanälen berechneten Barrieren zeigte, dass AqpZ sterische Barrieren nutzt, um den Durchgang von Glycerin zu erschweren. In der Tat ist die Pore insgesamt enger als die von GlpF (siehe Abbildung unten). Es scheint, dass die Natur auf einen sehr grundlegenden Mechanismus zurückgegriffen hat, nämlich die Abstimmung der Porengröße des Kanals, um zwei Proteine aus derselben Familie unterschiedliche Leitungseigenschaften zeigen zu lassen. Lesen Sie die ganze Geschichte in Wang, etal. in STRUCTURE, 2005.
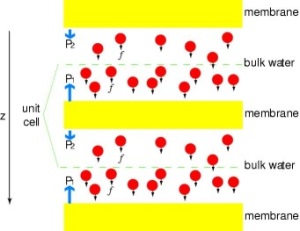
Putting Channels under Pressure
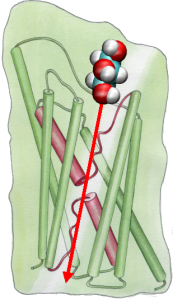
Um die Ergebnisse von MD-Simulationen direkt mit biochemischen Messungen der Leitfähigkeit von Membranwasserkanälen zu vergleichen, bei denen osmotische Druckgradienten verwendet werden, um den Fluss von Wasser durch die Membran zu induzieren, haben wir eine neue Methodik für MD-Simulationen entwickelt. Durch die Anwendung kleiner Kräfte auf Wassermoleküle in der Bulk-Region (siehe Abbildung) wird ein hydrostatischer Druckgradient über die Membran erzeugt. Der Druckgradient induziert Leitgeschwindigkeiten, die mit MD-Simulationen untersucht werden können, die in der Regel auf einige Nanosekunden begrenzt sind. Die Methode wurde bei der Simulation der Wasserpermeation durch die GlpF angewendet und ergab eine lineare Korrelation zwischen dem angelegten Druck und dem Fluss (Zhu et al., Biophys. J., 2002).
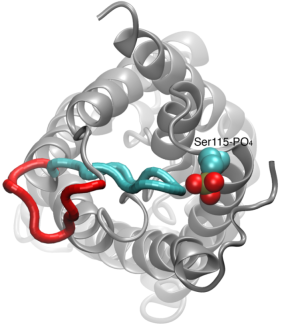
Gating von Wasserkanälen
Die Wasserpermeation durch Aquaporine ist ein passiver Prozess, der der Richtung des osmotischen Drucks durch die Membran folgt. Obwohl viele Aquaporine als immer offene Kanäle funktionieren, hat eine Untergruppe von Aquaporinen, insbesondere in Pflanzen, einen ausgeklügelten molekularen Mechanismus entwickelt, durch den der Kanal als Reaktion auf raue Umweltbedingungen, unter denen der Wasseraustausch für den Organismus schädlich sein kann, geschlossen werden kann. Beispiele für solche Bedingungen sind Trockenstress und Überschwemmungen, die bestimmte zelluläre Signale (Dephosphorylierung und Änderung des pH-Werts) auslösen, die zum Schließen des Kanals führen. Eine kürzlich gelöste Struktur eines Aquaporins aus Spinat wurde unter verschiedenen Bedingungen simuliert, um den molekularen Mechanismus des Gating in diesen Membrankanälen zu untersuchen. Es wurde festgestellt, dass eine verlängerte zytoplasmatische Schleife in gating-kompetenten Aquaporinen den Eingang der Wasserpore im geschlossenen Kanal physikalisch verschließt und den Zugang von Wassermolekülen zur Pore blockiert. Die Verschiebung dieser Schleife als Reaktion auf die Phosphorylierung, wie sie in den Simulationen beobachtet wurde, entfernt die Schleife vom zytoplasmatischen Eingang der Pore. Außerdem wird eine hydrophobe Aminosäure, die konformationell eng an diese Schleife gekoppelt ist, durch die Bewegung der Schleife aus dem Kanal herausgezogen. Zusammen führen diese molekularen Vorgänge zu einem offenen Kanal, der für Wassermoleküle durchlässig ist. Die Studie erschien in Nature2006.

Gating und Ionenleitfähigkeit der tetrameren Pore
AQPs sind allgemein für ihre hohe Durchlässigkeit für Wasser bekannt. Es wird jedoch vermutet, dass sie auch an anderen zellulären Funktionen beteiligt sind, einschließlich der Permeation kleiner Moleküle, die kein Wasser sind, sowie der Zell-Zell-Kommunikation. Die Tetramerisierung ist ein gemeinsames Strukturmerkmal der AQPs. Die Tatsache, dass die vier Monomere jeweils eine funktionell unabhängige Wasserpore bilden, aber eine tetramerische Organisation für die Funktion benötigen, deutet auf einen synergistischen Nutzen der Oligomerisierung hin und zwingt daher zu einer weiteren Analyse der möglichen Rolle der zentralen Pore in AQPs. Ein interessanter Vorschlag ist die mögliche Beteiligung der zentralen Pore an der Ionenleitung bei cGMP-Aktivierung. Mit Hilfe von MD-Simulationen von membrangebundenen Modellen von AQP1 haben wir diese Eigenschaft von AQP1 untersucht, um festzustellen, wie und unter welchen Konformations- und Hydratationsbedingungen die zentrale Pore leiten könnte und wie die Leitfähigkeit reguliert wird. Unsere Simulationen ergaben, dass eine der zytoplasmatischen Schleifen, nämlich die argininreiche Schleife D, eine Schlüsselrolle bei der cGMP-vermittelten Aktivierung der zentralen Pore spielt. Die vermutete Rolle von Schleife D wurde experimentell durch eine konstruierte Mutante von Schleife D verifiziert, die einen vollständigen Verlust der Ionenleitfähigkeit zeigte (Yu et al., Structure, 2006).
Gasmoleküle gelangen in die Zelle
Jeden Morgen fahren viele Menschen mit dem Auto zur Arbeit, während andere das Fahrrad, den Bus oder die U-Bahn nehmen. Um die Zellmembran zu durchqueren, diffundieren zum Beispiel kleine hydrophobe Gasmoleküle durch die Lipidschicht, während Wassermoleküle durch Aquaporine (AQPs) gelangen.Interessanterweise hat man vor kurzem herausgefunden, dass einige Gasmoleküle mehr als einen Weg haben, um die Membran zu durchqueren, d.h, Neben der Diffusion durch die Lipide können auch Sauerstoff und Kohlendioxid die AQP passieren. Die Wege, die diese Gasmoleküle nehmen, sind jedoch nach wie vor schwer fassbar. Mit Hilfe der Molekulardynamik, die mit NAMD durchgeführt wurde, haben wir die Gasdurchlässigkeit von AQP1 mit zwei komplementären Methoden (explizite Gasdiffusionssimulation und implizites Liganden-Sampling) untersucht. Die Simulationsergebnisse deuten darauf hin, dass die viermonomeren Poren von AQP1 als Wasserkanäle fungieren, während die zentrale Pore von AQP1 möglicherweise als Weg für Gasmoleküle dient, um die Membran zu durchqueren (Wang et al., Journal of Structural Biology, 2007 ).
Molekularer Hindernisparcours
Biologische Zellen schützen ihr Inneres durch ihre Zellmembranen, sind jedoch auf den Import von Nährstoffen angewiesen. Für diesen Import haben sie schnelle Leitungskanäle entwickelt, die zuverlässige Kontrollpunkte zur Unterscheidung von erwünschten und unerwünschten Verbindungen enthalten. Ein Kontrollpunkt stellt einen regelrechten Hindernisparcours dar, den nur die richtigen Verbindungen schnell passieren können. Das Verständnis der Kanalkonstruktion ist schwierig, da es an detaillierten experimentellen Daten zur Nährstoffdynamik mangelt. Die detailliertesten Informationen erhält man derzeit durch eine rechnerische Betrachtung der Kanaldynamik, ausgehend von statischen kristallographischen Strukturen. In einer kürzlich durchgeführten Studie wurde untersucht, wie Glycerine, kleine Nährstoffmoleküle, die von einigen Bakterien benötigt werden, die Kontrollpunkte passieren, die durch den Glycerin-Kanal GlpF realisiert werden. GlpF verfügt über vier parallele Kanäle, die mit Hilfe von NAMD und einem neuartigen Algorithmus, der die Energetik der Kanäle schnell genug erforscht, um auf heutigen Computern methodisch machbar zu sein, rechnerisch überwacht wurden. Die Ergebnisse zeigen, wie die physikalischen Eigenschaften von Glycerin, ihre Fähigkeit, sogenannte Wasserstoffbrückenbindungen zu bilden, ihre elektrischen Dipolmomente, ihre diffusive Mobilität und ihre intrinsische Flexibilität entlang des Kanals untersucht werden (Henin et al., Biophysical Journal, in press ).
Unsere Aquaporin-Forschung in den Nachrichten
|
Aquaporin Team
|
Veröffentlichungen
-//W3C//DTD XHTML 1.0 Transitional//EN“ „http://www.w3.org/TR/xhtml1/DTD/xhtml1-transitional.dtd“>Publications Datenbank Diffusion von Glycerin durch Escherichia coli Aquaglyceroporin GlpF.Jerome Henin, Emad Tajkhorshid, Klaus Schulten, and Christophe Chipot. Biophysikalische Zeitschrift, 94:832-839, 2008. Erforschung der Gasdurchlässigkeit von Zellmembranen und Membrankanälen mit Molekulardynamik.Yi Wang, Jordi Cohen, Walter F. Boron, Klaus Schulten, und Emad Tajkhorshid. Zeitschrift für Strukturbiologie, 157:534-544, 2007. Mechanismus des Gating und Ionenleitfähigkeit einer möglichen tetrameren Pore in Aquaporin-1.Jin Yu, Andrea J. Yool, Klaus Schulten und Emad Tajkhorshid. Struktur, 14:1411-1423, 2006. Structural mechanism of plant aquaporin gating.S. Törnroth-Horsefield, Y. Wang, K. Hedfalk, U. Johanson, M. Karlsson, E. Tajkhorshid, R. Neutze, and P. Kjellbom. Natur, 439:688-694, 2006. Was macht ein Aquaporin zu einem Glycerin-Kanal: Eine vergleichende Studie von AqpZ und GlpF.Yi Wang, Klaus Schulten, und Emad Tajkhorshid. Struktur, 13:1107-1118, 2005. Kinetische Theorie und Simulation des Wassertransports in einem Kanal.Emad Tajkhorshid, Fangqiang Zhu, and Klaus Schulten. In S. Yip, editor, Handbook of Materials Modeling, Vol. I: Methods and Models, pp. 1797-1822. Springer, Niederlande, 2005. Towards understanding membrane channels.Emad Tajkhorshid, Jordi Cohen, Aleksij Aksimentiev, Marcos Sotomayor, and Klaus Schulten. In Boris Martinac and Andrzej Kubalski, editors, Bacterial ion channels and their eukaryotic homologues, pp. 153-190. ASM Press, Washington, DC, 2005. Collective diffusion model for water permeation through microscopic channels.Fangqiang Zhu, Emad Tajkhorshid, and Klaus Schulten. Physical Review Letters, 93:224501, 2004. (4 Seiten). Computergestützte Studien von Membrankanälen.Benoit Roux und Klaus Schulten. Struktur, 12:1343-1351, 2004.