14.1 Einführung in Neuropeptide und Stickstoffmonoxid
Klassische Neurotransmitter (z. B. Glutamat und ACh) wirken durch die gerichtete Übertragung von Informationen zwischen präsynaptischen Freisetzungsstellen und postsynaptischen Rezeptorclustern. Der Prozess ist im Allgemeinen räumlich gut organisiert, wobei es zu einem gewissen, aber sehr begrenzten „Spill-over“ von Transmittern zwischen benachbarten Synapsen kommt. Ganz anders verhält es sich bei der durch Neuropeptide und Stickstoffmonoxid (NO) vermittelten Übertragung. Diese Moleküle ignorieren die Richtungsabhängigkeit des Informationsflusses und beeinflussen stattdessen ein ganzes Gebiet ab ihrem Freisetzungspunkt. Diese Eigenschaft ist in etwa vergleichbar mit der Freisetzung von Peptidhormonen in den Blutkreislauf, die an weit entfernte Orte transportiert werden können, um dort ihre Wirkung zu entfalten. So kann beispielsweise NO in einem postsynaptischen Neuron produziert werden und zum präsynaptischen Neuron oder zu anderen benachbarten Neuronen zurückdiffundieren, was die anschließende Freisetzung von Transmittern beeinflusst. Diese Eigenschaft wird als retrograde Übertragung bezeichnet, da sich das Signal im Vergleich zur klassischen Richtung der Neurotransmission in die entgegengesetzte Richtung (post- zu pre-) bewegt.
14.2 Neuropeptide
Viele Neuropeptide wurden ursprünglich als Hormone beschrieben (z. B. Somatostatin und Cholecystokinin), obwohl sie nach ihrer Charakterisierung auch in Neuronen im ZNS gefunden wurden. Neuropeptide erzeugen typischerweise neuronale Reaktionen mit langsamem Einsetzen und langer Dauer (Abbildung 14.1), und alle charakterisierten Neuropeptidrezeptoren gehören zur Klasse der GPCR (G-Protein-gekoppelte Rezeptoren). Zum Vergleich zeigt Abbildung 14.1 typische Reaktionen, die durch die Wirkung eines klassischen Neurotransmitters (Glutamat), der an einem ionotropen Rezeptor wirkt, und eines Neuropeptids hervorgerufen werden. Ein Aktionspotenzial, das in Neuron 1 (in grün), einem Glutamat freisetzenden Neuron, ausgelöst wird, erzeugt die für die Glutamat-vermittelte synaptische Übertragung typische schnelle (5 ms) EPSP. Im Gegensatz dazu erzeugt ein Aktionspotenzial, das in Neuron 2 (violett) ausgelöst wird, das Neuropeptide freisetzt, eine langsam einsetzende (5 Sekunden bis zum Spitzenwert) und lang anhaltende (10 Sekunden) EPSP. Diese langsamen EPSPs sind typisch für Neuropeptid-Aktionen, da alle Neuropeptid-Rezeptoren G-Protein-gekoppelt sind.
Abbildung 14.1
Außerdem erzeugen viele Neuropeptide keine offensichtliche elektrophysiologische Veränderung im postsynaptischen Neuron. Zum Beispiel erzeugt ein Aktionspotenzial in Neuron 3 (Abbildung 14.1; rosa) keine Reaktion im postsynaptischen Neuron, obwohl man mit anderen Mitteln bestätigen kann, dass Neuropeptide freigesetzt wurden. Im postsynaptischen Neuron sind jedoch Veränderungen eingetreten, wie das Beispiel in den Tafeln mit der Bezeichnung „C“ zeigt. Misst man zunächst die Glutamatreaktion (C1) durch Stimulation von Neuron 1, so zeigt sich eine typische Reaktion. Die Stimulierung von Neuron 3 führt wie zuvor zu keiner Reaktion (C2). Wird jedoch Neuron 1 nach der Stimulation von Neuron 3 erneut stimuliert, so ist das im postsynaptischen Neuron gemessene EPSP verstärkt (C3) (das ursprüngliche EPSP ist die durchgezogene Linie und das EPSP nach der Stimulation von Neuron 3 ist die gestrichelte Linie). Das vom Neuron 3 freigesetzte Neuropeptid hat also die Reaktion des postsynaptischen Neurons auf einen anderen Neurotransmitter verändert. Diese Neuropeptide werden als Neuromodulatoren bezeichnet, da ihre Wirkung darin besteht, die Wirkung eines zweiten Transmitters zu verstärken oder zu dämpfen. Weitere Beispiele für eine solche heterosynaptische Plastizität werden in Kapitel 7, Teil 2 beschrieben.
14.3 Klassifizierung der Peptide nach Familien
Neuropeptide können aufgrund von Ähnlichkeiten in ihren Aminosäuresequenzen in Familien eingeteilt werden (Tabellen I und II).
Tabelle I
Neuropeptidfamilien
Tachykinine: Substanz P, Bombesin, Substanz
Insuline: Insulin, insulinähnliche Wachstumsfaktoren
Somatostatine: Somatostatin, Pankreaspolypeptid
Gastrine: Gastrin, Cholecystokinin
Opioide: Opiocortine, Enkephaline, Dynorphin
Die Opiate werden beispielsweise aufgrund der identischen Aminosäuresequenz Tyr-Gly-Gly-Phe–(Tabelle II), die am N-Terminus jedes Opiats zu finden ist, zu einer Familie zusammengefasst.
| Tabelle II Opiatfamilie – Sequenzidentität in Kursivschrift |
|
| Name | Aminosäuresequenz |
| Leu-enkephalin | Tyr-Gly-Gly-Phe-Leu-OH |
| Met-enkephalin | Tyr-Gly-Gly-Phe-Met-OH |
| Beta-endorphin | Tyr-Gly-Gly-Phe-Met-Thr-Ser-Glu-Lys- Ser-Gln-Thr-Pro-Leu-Val-Thr-Leu- Phe-Lys-Asn-Ala-Ile-Val-Lys-Asn-Ala- His-Lys-Gly-Gln-His-OH |
| Dynorphin | Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile-Arg- Pro-Lys-Leu-Lys-Trp-Asp-Asn-Gln-OH |
14.4 Biosynthese und Regulation
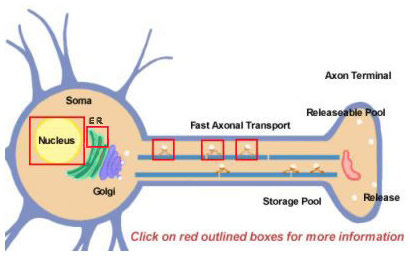
Abbildung 14.2
Neuropeptide werden aus größeren Vorläufern durch proteolytische Verarbeitung gewonnen. Sie werden alle zunächst im Soma synthetisiert (Abbildung 14.2). Die Vorstufen werden zunächst durch Translation an Polyribosomen gebildet, die am endoplasmatischen Retikulum in der Nähe des Zellkörpers befestigt sind. Von dort aus durchlaufen sie den Golgi-Apparat, wo weitere Modifikationen, einschließlich der Glykosylierung, stattfinden. Anschließend werden sie in sekretorische Granula verpackt, die durch schnellen axonalen Transport zu den Endigungen transportiert werden. Schnell ist jedoch ein relativer Begriff, da einige Neuropeptide relativ weite Strecken zurücklegen müssen. Die Wiederauffüllung des Pools freisetzbarer Neuropeptide kann viele Stunden dauern. Während des Transports zum Nerventerminal beginnen Proteasen, die im Vesikel verpackt sind, das Vorläufer-Neuropeptid in seine endgültige reife Form zu spalten. Diese Verarbeitung ist für die Aktivierung der Neuropeptide unerlässlich, da die Vorläufer biologisch inaktiv sind. In den Vesikeln finden mindestens drei Arten der Verarbeitung statt (Abbildung 14.2; für weitere Einzelheiten auf die Kästchen klicken). Zunächst spaltet eine Endopeptidase den Vorläufer, um zwei neue Produkte zu erzeugen (erster Kasten im Axon). Bei vielen Vorläufern erfolgt diese Spaltung nach basischen Resten (wie Lys und Arg) und wird von trypsinähnlichen Proteasen durchgeführt. Als nächstes, wenn auch nicht bei jedem Neuropeptid, spaltet eine Carboxypeptidase die basischen Reste vom C-Terminus des neuen Peptids ab (Zweiter Kasten im Axon). Schließlich wandelt ein drittes Enzym die COOH (Carboxy)-Gruppe eines Gly-Restes, der sich am C-Terminus vieler Neuropeptide befindet, in eine NH2 (Amid)-Gruppe um, um die reife, aktive Form des Neuropeptids herzustellen.
14.5 Mehrere Mechanismen werden genutzt, um die Vielfalt der Neuropeptide zu produzieren
Die meisten Proteine werden aus mRNA-Molekülen hergestellt, die im Zellkern von Vorläufer-RNAs in ihre endgültige Form gespleißt werden. Differenzielles Spleißen ist eine Möglichkeit, die ein Neuron nutzt, um die Produktion verschiedener Arten von Neuropeptiden zu diversifizieren. Ein bekanntes Beispiel ist die Substanz-P-mRNA, die normalerweise auch mRNA enthält, die für Substanz K kodiert. Der Substanz-K-Teil der mRNA kann differentiell abgespleißt werden, so dass die resultierende mRNA nur Substanz P produzieren kann (klicken Sie auf den Kasten über dem Kern in Abbildung 14.2)
Abbildung 14.3
Neuropeptide werden aus einem längeren Vorläuferprotein durch proteolytische Verarbeitung hergestellt. Ein hervorragendes Beispiel ist die Familie der Opioidpeptide (z. B. die Verarbeitung von Proopiomelanocorticotropin, POMC und Enkephalin; siehe Abbildung 14.3). Wie bereits erwähnt, findet die proteolytische Verarbeitung innerhalb der Transportvesikel statt und erfolgt meist durch Abspaltung des Vorläufers an der N-terminalen Seite der basischen Reste (Arginin und Lysin), obwohl auch andere Spaltstellen identifiziert worden sind. In einigen Fällen, wie z. B. beim Enkephalin-Vorläuferprotein, liegen mehrere Kopien desselben endgültigen bioaktiven Peptids vor. Das oben in Abbildung 14.3 dargestellte Vorläufermolekül enthält sechs Kopien von Met-Enkephalin (ME) und eine Kopie von Leu-Enkephalin (LE).
Vielfalt kann also dadurch erzeugt werden, dass die Sequenz der Spaltstellen durch differentielles Spleißen verändert wird, dass unterschiedliche Proteasen (die unterschiedliche Sequenzen für die Spaltung erkennen) produziert und/oder in die Transportvesikel verpackt werden, oder dass eine proteolytische Stelle durch posttranslationale Modifikationen versteckt wird. Ein Beispiel für Letzteres ist, dass eine spezifische Spaltstelle durch das Hinzufügen einer Kohlenhydrat-Seitenkette versteckt werden kann, die den Zugang der Protease zu dieser Stelle sterisch blockiert. Eine weitere häufige Erkenntnis ist, dass ein einziges Vorläufermolekül mehrere verschiedene Neuropeptide enthält (siehe Abbildung 14.3), so dass die Art der Verarbeitung letztlich bestimmt, welches Neuropeptid vom Neuron freigesetzt wird. Das POMC-Vorläuferprotein kann gespalten werden, um ACTH (orange) und β-Lipoprotein (hellblau) zu bilden, die jeweils weiter gespalten werden können, um zusätzliche bioaktive Neuropeptide zu erzeugen (Abbildung 14.3). Zum Beispiel kann das β-Lipoprotein (hellblau) weiter in γ-Lipoprotein (grüne Streifen) und β-Endorphin (dunkelblau) gespalten werden. Auch hier kann ein und dasselbe Vorläuferprotein je nach der stattfindenden Verarbeitung so modifiziert werden, dass Neuropeptide mit völlig unterschiedlichen biologischen Reaktionen entstehen.
14.6 Freisetzung
Abbildung 14.4
Peptide werden durch Calcium-abhängige Exozytose freigesetzt, wobei es einige wichtige Unterschiede zur Freisetzung klassischer Neurotransmitter gibt. Typischerweise sind die Vesikel, die Neuropeptide freisetzen, viel größer als diejenigen, die niedermolekulare Neurotransmitter (z. B. Glutamat) enthalten, und benötigen keine präsynaptische Spezialisierung für die Freisetzung (siehe die elektronenmikroskopische Aufnahme in Abbildung 14.4). Im Gegensatz zu den kleinen Vesikeln, die Glutamat enthalten, scheinen die großen Vesikel nicht an der Membran angedockt zu sein. Diese Beobachtung stimmt mit der Vorstellung überein, dass niedermolekulare Neurotransmitter kurze, lokale Wirkungen (an synaptischen Verbindungen) hervorrufen, während Neuropeptide langsame, lang anhaltende Wirkungen erzeugen, die oft ein großes Gebiet um den Ort der Freisetzung herum umfassen. Da Neuropeptide im Zellsoma und nicht lokal an der Synapse synthetisiert werden, kann es mehrere Stunden dauern, bis die freisetzbaren Pools wieder aufgefüllt sind, wenn ihr Vorrat durch anhaltende Freisetzung erschöpft ist. Ein Beispiel: Ein motorisches Neuron mit seinem Zellkörper im Rückenmark und der Synapse im Fuß hat ein Axon von bis zu einem Meter Länge. Bei schnellem axonalem Transport würde es möglicherweise mehr als einen Tag dauern, bis ein neu synthetisiertes Neuropeptid vom Soma zu dieser Synapse gelangt. Es sollte auch klar sein, dass körpereigene schmerzlindernde Neuropeptide wie Beta-Endorphin in Zeiten anhaltender Stimulation „verbraucht“ werden könnten, was zu Situationen führt, in denen Schmerzen nicht mehr durch körpereigene Mechanismen kontrolliert werden können.
Ein typisches reifes Neuron setzt oft einen niedermolekularen Neurotransmitter und ein oder mehrere Neuropeptide frei (wie in dem Beispiel in Abbildung 14.4). Wenn mehr als ein Neuropeptid freigesetzt wird, stammen sie meist von ein und demselben Vorläufermolekül. Ein Beispiel ist die gleichzeitige Freisetzung von ACh und Calcitonin-Gen-verwandtem Peptid aus spinalen Motoneuronen. CGRP aktiviert die Adenylatzyklase, wodurch der cAMP-Spiegel ansteigt und die durch die ACh-Aktivierung des nicotinischen ACh-Rezeptors erzeugte Kontraktionskraft verstärkt wird. In diesem Fall wirkt das Neuropeptid modulierend, wie in Abbildung 14.1 beschrieben. In diesem Fall potenziert die Wirkung jedoch die Muskelkontraktion, anstatt die Stärke der EPSP zu erhöhen. In beiden Beispielen ist die potenzierte Reaktion auf eine erhöhte Empfindlichkeit des Systems gegenüber einer konstanten Menge an freigesetztem Neurotransmitter zurückzuführen.
14.6 Beendigung der Wirkung
Neuropeptide werden langsam aus dem extrazellulären Raum entfernt; eine Eigenschaft, die auch zu ihrer relativ lang anhaltenden Wirkung beiträgt. Die Inaktivierung erfolgt sowohl durch Diffusion als auch durch Abbau durch extrazelluläre Proteasen. Es gibt keine Hinweise darauf, dass die Wiederaufnahme von Peptiden ein Mittel zur Beendigung ihrer Wirkung ist.
14.7 Rezeptoren sind alle G-Protein-verknüpft
Alle bekannten Neuropeptidrezeptoren erzeugen ihre Wirkungen, indem sie die Konzentration intrazellulärer Botenstoffe verändern. Bei diesen Rezeptoren handelt es sich um sieben Transmembranproteine, die über G-Proteine (GPCRs) verbunden sind und die Aktivierung anderer zellulärer Enzyme verändern. Diese Eigenschaft steht im Einklang mit der Tatsache, dass Neuropeptide eine langsamere Reaktion hervorrufen, und ist für eine modulierende Rolle gut geeignet. Ein wichtiger Unterschied zwischen niedermolekularen und neuropeptidischen Transmittern besteht darin, dass Neuropeptidrezeptoren eine hohe Bindungsaffinität (nanomolar) aufweisen, im Gegensatz zu mikro- oder millimolaren Affinitäten, die bei niedermolekularen Neurotransmittern (wie Glutamat) gemessen werden. Da Neuropeptide nicht gezielt in das begrenzte Volumen einer Synapse freigesetzt werden, erreichen ihre Konzentrationen keine sehr hohen Werte, und die Rezeptoren müssen dann eine hohe Affinität aufweisen, um auf diese geringen Konzentrationen zu reagieren. Diese hohe Affinität verlangsamt die Dissoziation des Neuropeptids von seinem Rezeptor und trägt auch zu den anhaltenden Wirkungen dieser Moleküle bei.
14.8 Stickstoffmonoxid (NO)
Stickstoffmonoxid hat als Gründungsmitglied einer neuen Klasse von gasförmigen Botenmolekülen große Aufmerksamkeit erlangt. NO ist das aktive Molekül, das das sublinguale Nitroglycerin produziert, um die Vasodilatation bei Angina pectoris zu erhöhen. Andere wichtige biologische Wirkungen von NO sind inzwischen anerkannt. Im Nervensystem beispielsweise ist NO wichtig für die Regulierung des zerebralen Blutflusses, für die Modulation der Neurotransmission und für die Toxizität in Verbindung mit verschiedenen pathologischen Zuständen.
14.9 Merkmale von NO
Zusammenfassung der Eigenschaften von NO
- Gas, das frei durch Membranen diffundiert
- Kurzlebig mit einer Halbwertszeit
- Kurzlebig mit einer in Sekunden gemessenen Halbwertszeit
- Hochreaktives freies Radikal
- Toxisch in hohen Konzentrationen
NO ist ein kurzlebiges Gas, nicht zu verwechseln mit dem relativ stabilen Narkosegas Distickstoffoxid (Lachgas). NO ist eigentlich ein freies Radikal und daher eine hochreaktive Verbindung. Einige seiner toxischen Wirkungen sind wahrscheinlich darauf zurückzuführen, dass NO mit Superoxid reagiert und das zerstörerische Radikal Peroxynitrat bildet. NO gilt als unkonventioneller Neurotransmitter, da es nicht durch Exozytose freigesetzt wird und seine Wirkung nicht über herkömmliche Rezeptormoleküle erfolgt.
Wie bereits erwähnt, geht die typische Beschreibung der neuronalen Kommunikation von einer unidirektionalen Übertragung aus. Ein präsynaptischer Neurotransmitter wird freigesetzt, der Veränderungen im postsynaptischen Neuron bewirkt. Mehrere Verbindungen (wie Neuropeptide und NO), die in postsynaptischen Neuronen produziert werden, diffundieren in die lokale Umgebung und beeinflussen die umliegenden Zellen. Da NO ein frei diffundierbares Gas ist, kann es sich von seinem Produktionsort aus schnell in alle Richtungen ausbreiten. Wenn es beispielsweise in einer postsynaptischen Zelle aufgrund einer Stimulation des Glutamatrezeptors gebildet wird, kann NO in die lokale Umgebung freigesetzt werden und ein Signal an das präsynaptische Neuron zurücksenden (Abbildung 14.5). Diese Art von Aktivität wird als retrograde Signalisierung bezeichnet, da das Signal in einer retrograden Richtung vom postsynaptischen zum präsynaptischen Neuron wandert.
Abbildung 14.5
Abbildung 14.6
Die Abbildungen 14.5, 14.6 und 14.7 fassen die wichtigsten Aspekte der NO-Synthese zusammen. In diesem Beispiel wird Glutamat aus dem präsynaptischen Terminal freigesetzt, das an NMDA-Rezeptoren auf der postsynaptischen Membran bindet, wodurch diese sich öffnen und einen Ca2+-Zufluss ermöglichen. Das Ca2+ aktiviert Calmodulin, das an das Enzym Stickstoffmonoxid-Synthase (NOS) bindet und es aktiviert. Unter Verwendung von Arginin als Substrat produziert die NOS NO und ein zweites Reaktionsprodukt, Citrullin. Das NO kann dann frei in die Umgebung diffundieren und mit dem präsynaptischen Terminal, der das Glutamat ursprünglich freigesetzt hat, oder einer anderen Zelle in der lokalen Umgebung interagieren. Jeder Prozess, der das intrazelluläre Ca2+ erhöht, aktiviert potenziell NOS. Die Glutamataktivierung von NMDA-Rezeptoren ist nur ein gut dokumentiertes Beispiel.
Abbildung 14.7
14.10 Synthese durch Stickstoffoxid-Synthase (NOS) und Freisetzung
NO wird durch das Enzym Stickstoffoxid-Synthase (NOS) produziert. Dieses Enzym findet sich in einer Unterpopulation von Neuronen (1-2 % der Neuronen im Kortex) und in den meisten Endothelzellen. Mindestens eine Form von NOS in diesen Zellen ist zur Aktivierung von Kalzium und Calmodulin abhängig, wie in den Abbildungen 14.5, 14.6 und 14.7 dargestellt. Sie enthält auch Kofaktoren, die dem Cytochrom P-450 ähnlich sind. Diese Kofaktoren sind NADPH (Nicotinamid-Adenin-Dinukleotid-Phosphat, FAD (Flavin-Adenin-Mononukleotid) und FMN (Flavin-Mononukleotid). Diese Kofaktoren sind für die Übertragung von Elektronen unerlässlich, durch die das instabile und kurzlebige Produkt NO entsteht. Das Substrat bei dieser Reaktion ist die gewöhnliche Aminosäure Arginin, und die Produkte sind Citrullin und NO (Abbildung 14.5). Aufgrund der kurzen Lebensdauer von NO ist es außerordentlich schwierig, es direkt zu messen. In experimentellen Präparaten besteht jedoch eine ausgezeichnete Korrelation zwischen der Verabreichung von NMDA, das intraneuronales Ca2+ erhöht und NOS aktiviert, und der Produktion des zusätzlichen Produkts der enzymatischen Aktivität von NOS, Citrullin (siehe Abbildung 14.8). Die Citrullinproduktion ist ein zuverlässiger Indikator für die NO-Produktion. Es ist auch möglich, die Produktion von Citrullin (und NO) zu blockieren, indem man den Zellen das nicht metabolisierbare Substrat für NOS, Methyl-Arginin, zuführt (Abbildung 14.9), und solche Verbindungen sind verwendet worden, um die Produktion von NO zu reduzieren und seine biologischen Wirkungen zu beenden.
|
Abbildung 14.8 |
Abbildung 14.9 |
14.11 „Rezeptoren“ für NO
Abbildung 14.10
Eines der Hauptziele für NO scheint das Enzym Guanylylcyclase zu sein. Diese Entdeckung wurde indirekt gemacht, indem die Anhäufung des NOS-Produkts Citrullin und gleichzeitig die Produktion von cGMP, dem Produkt des Enzyms Guanylylzyklase, überwacht wurde (Abbildungen 14.8 und 14.9). In diesem Experiment wurde NMDA zu einem neuronalen Präparat hinzugefügt, um NOS zu aktivieren. NOS verwendet Arginin als Substrat zur Produktion von NO, und wie bereits erwähnt, wurde festgestellt, dass die Akkumulation von Citrullin und cGMP in derselben dosisabhängigen Weise endet, wenn dem System ein nicht hydrolysierbares Analogon wie Methyl-Arginin zugesetzt wird. Diese starken Korrelationen führten zu der Entdeckung, dass die Guanylylcyclase ein Hauptziel von NO ist.
Die Guanylylcyclase ist ein ungewöhnliches Enzym, da es einen Häm-Ring mit einem assoziierten Eisenmolekül als Teil seiner Struktur besitzt. NO aktiviert dieses Enzym durch Bindung an das Eisen im Häm, wodurch die Produktion von zyklischem GMP aus GTP (Abbildung 14.10) durch Konformationsänderungen im Enzym ausgelöst wird. cGMP aktiviert dann eine cGMP-abhängige Proteinkinase und andere, weiter unten beschriebene Enzyme. Das Spektrum der Wirkungen, die durch die Aktivierung der cGMP-abhängigen Proteinkinase hervorgerufen werden, wird erst jetzt verstanden.
14.12 Biologische Wirkungen von NO
NO erzeugt eine Vielzahl von biologischen Wirkungen. Leider wissen wir vor allem nichts über die Rolle von NO bei der Modulation zellulärer Prozesse im Nervensystem. Die Rolle von NO bei der Regulierung des Gefäßsystems ist gut dokumentiert, und es scheint eine ähnlich wichtige Rolle im Nervensystem zu spielen.
14.13 Vasodilatator
Abbildung 14.11
Klicken Sie hier, um eine vergrößerte Ansicht dieses Bildes zu sehen.
Unter normalen Umständen trägt NO zur Kontrolle des Blutflusses durch das Hirngefäßsystem bei. Ein schneller Rückkopplungsmechanismus ist notwendig, um aktivere Bereiche des Gehirns mit den notwendigen Nährstoffen zu versorgen. Dieser Mechanismus ist notwendig, weil das Gehirn nur über schwache Energiereserven verfügt. NO wird in Neuronen produziert, die NOS enthalten und einer anhaltenden Aktivität unterliegen. Diese Bedingungen begünstigen die Aktivierung von NMDA-Rezeptoren, von denen bekannt ist, dass sie die NO-Produktion auslösen. NO diffundiert von diesen lokalisierten Bereichen hoher neuronaler Aktivität in die umgebende Mikrovaskulatur (Abbildung 14.11) und bewirkt eine Gefäßerweiterung und einen erhöhten Blutfluss.
Obwohl die genauen Mechanismen, durch die NO eine Gefäßerweiterung bewirkt, noch nicht definiert sind, ist bekannt, dass die Aktivierung der cGMP-abhängigen Proteinkinase in glatten Muskelzellen eine Entspannung der Gefäße bewirkt. Da eines der Hauptziele von NO die Guanylylzyklase ist (die cGMP produziert und die cGMP-abhängige Proteinkinase aktiviert), wird vermutet, dass einer der Hauptwege für die gefäßerweiternden Wirkungen von NO über die cGMP-abhängige Proteinkinase verläuft. Die Aktivierung dieser Kinase führt indirekt zu einer Verringerung des Ca2+-Spiegels in den glatten Muskelzellen und in der Folge zu einer Dephosphorylierung des kontraktilen Myosinapparats, die eine Entspannung bewirkt (Abbildung 14.12). In glatten Muskelzellen scheint NO die Zellen auch direkt zu hyperpolarisieren, möglicherweise durch Aktivierung von K+-Kanälen, was zu einem sekundären Verschluss von Ca2+-Kanälen führt, was ebenfalls eine Muskelentspannung bewirkt. Zusammenfassend lässt sich sagen, dass eine der Hauptfunktionen von NO darin zu bestehen scheint, das Niveau der neuronalen Aktivität mit lokalen Veränderungen des zerebralen Blutflusses zu verknüpfen, um eine angemessene Perfusion des metabolisch aktiven Gewebes aufrechtzuerhalten.
Abbildung 14.12
14.14 Neuromodulator
Es wird angenommen, dass NO auch als lokal diffundierbarer Botenstoff wirkt. Es wird durch jede Aktion produziert, die Ca2+ in Zellen, die NOS enthalten, erhöht, wie z.B. die Glutamatstimulation von NMDA-Rezeptoren. Durch die anschließende Aktivierung der Guanylylzyklase und die Produktion von cGMP beeinflusst die NO-Produktion eine Reihe von Sekundärprozessen. Dazu gehören die direkte Modulation von Ionenkanälen, die Stimulierung der cGMP-abhängigen Proteinkinase und die Auf- oder Abregulierung der cAMP-Phosphodiesterase. Die nachgeschalteten Wirkungen sind zahlreich und umfassen die Auf- und Abwärtsregulierung von Ca2+-Kanälen, eine erhöhte Erregbarkeit (Steigerung der neuronalen Feuerrate), eine erhöhte oder verringerte Freisetzung von Neurotransmittern und Veränderungen der Morphologie von Neuronen.
14.15 Toxizität
NO im Übermaß ist toxisch für Zellen. Für die Toxizität von NO gibt es jedoch ein Paradoxon. Zellen, die hohe Mengen an NO produzieren, sind resistent gegen seine toxischen Wirkungen. So wird die NO-Toxizität beispielsweise von Makrophagen und Neutrophilen als Mechanismus zur Abtötung von Tumorzellen und Bakterien genutzt. Keiner der beiden Zelltypen, die NO produzieren, ist jedoch anfällig für dessen schädigende Wirkung. Diese Feststellung gilt auch für Neuronen im zentralen Nervensystem. Überschüssiges Glutamat führt zu Neurotoxizität im Gehirn und gilt als Hauptursache für das Absterben von Neuronen bei Krankheiten wie Huntington oder Alzheimer oder nach einem akuten Schlaganfall oder Trauma. Es wird vermutet, dass eine übermäßige Produktion von NO eine gewisse Rolle bei diesem neuronalen Verlust spielt, da es toxisch ist, wenn es im Übermaß produziert wird. Interessanterweise werden Zellen, die positiv für das Enzym NOS färben, in den degenerierenden Bereichen des Gehirns, die von diesen Krankheiten betroffen sind, verschont. Die Resistenz dieser Zellen scheint der oben beschriebenen Resistenz der Immunzellen ähnlich zu sein.
Test dein Wissen
- Frage 1
- A
- B
- C
- D
- E
Neuropeptide sind in synaptischen Endigungen vorhanden, weil sie:
A. In der Endigung synthetisiert werden.
B. Durch schnellen axonalen Transport transportiert werden
C. Wird durch Diffusion transportiert
D. Transport durch langsamen axonalen Transport
E. Aufnahme aus dem extrazellulären Raum
Neuropeptide sind in synaptischen Endigungen vorhanden, weil sie:
A. In der Endigung synthetisiert werden. Diese Antwort ist FALSCH.
Die Synthesemaschinerie, die für die Synthese von Peptiden und Proteinen notwendig ist, befindet sich nicht in der Axonendigung.B. Wird durch schnellen axonalen Transport transportiert
C. Wird durch Diffusion transportiert
D. Transport durch langsamen axonalen Transport
E. Aufnahme aus dem extrazellulären Raum
Neuropeptide sind in synaptischen Endigungen vorhanden, weil sie:
A. In der Endigung synthetisiert werden.
B. Durch schnellen axonalen Transport transportiert Diese Antwort ist RICHTIG!
Neuropeptide werden im Zellkörper synthetisiert und in Vesikeln verarbeitet, die durch schnellen axonalen Transport entlang von Mikrotubuli zu den Axonendigungen transportiert werden.C. Durch Diffusion transportiert
D. Transport durch langsamen axonalen Transport
E. Aufnahme aus dem extrazellulären Raum
Neuropeptide sind in synaptischen Endigungen vorhanden, weil sie:
A. In der Endigung synthetisiert werden.
B. Werden durch schnellen axonalen Transport transportiert
C. Diese Antwort ist FALSCH.
Auch die Diffusion ist ein hervorragender Mechanismus, um Moleküle über kurze Entfernungen (einige Mikrometer) zu bewegen, aber sie ist ineffizient, wenn es darum geht, Moleküle über Entfernungen zu bewegen, die typischerweise das neuronale Soma von den Axonenden trennen.D. Wird durch langsamen axonalen Transport transportiert
E. Aufnahme aus dem extrazellulären Raum
Neuropeptide sind in synaptischen Terminals vorhanden, weil sie:
A. In der Endigung synthetisiert werden.
B. Durch schnellen axonalen Transport transportiert werden
C. Wird durch Diffusion transportiert
D. Transport durch langsamen axonalen Transport Diese Antwort ist FALSCH.
Außerdem ist es wichtig, die Versorgung der Terminals mit Neuropeptiden so schnell wie möglich wieder aufzufüllen. In diesem Fall ist schneller besser.E. Aufnahme aus dem extrazellulären Raum
Neuropeptide sind in synaptischen Terminals vorhanden, weil sie:
A. In der Endigung synthetisiert werden.
B. Durch schnellen axonalen Transport transportiert werden
C. Wird durch Diffusion transportiert
D. Transport durch langsamen axonalen Transport
E. Aufnahme aus dem Extrazellulärraum Diese Antwort ist FALSCH.
Es gibt keinen bekannten Aufnahmemechanismus, um Neuropeptide aus dem Extrazellulärraum zu entfernen. Ihr Wirkmechanismus wird durch Diffusion und durch enzymatischen Abbau durch extrazelluläre Proteasen beendet.
- Frage 2
- A
- B
- C
- D
- E
Nitric Oxide:
A. Hat eine lange Lebensdauer
B. Ist membrandurchlässig
C. Ist nicht reaktiv
D. Ist auch als Lachgas bekannt.
E. Ist nicht giftig für Zellen.
Stickstoffmonoxid:
A. Hat eine lange Lebensdauer Diese Antwort ist FALSCH.
NO hat eine in Sekunden gemessene Halbwertszeit und ist sehr instabil.B. Ist membrandurchlässig.
C. Ist nicht reaktiv
D. Ist auch als Lachgas bekannt.
E. Ist nicht giftig für Zellen.
Stickstoffmonoxid:
A. Hat eine lange Lebensdauer
B. Ist membrandurchlässig. Diese Antwort ist RICHTIG!
NO ist für Membranen frei durchlässig und wirkt auf alle Zellen in einem gewissen Umkreis von seinem Produktionsort.C. Ist nicht reaktiv
D. Ist auch als Lachgas bekannt.
E. Ist nicht giftig für Zellen.
Stickstoffmonoxid:
A. Hat eine lange Lebensdauer
B. Ist membrandurchlässig.
C. Ist nicht reaktiv Diese Antwort ist FALSCH.
NO ist ein hochreaktives freies Radikal. Es reagiert mit Proteinen, Lipiden und Nukleinsäuren und hat eine besonders hohe Affinität zu reduzierten Metallen (z. B. Fe2+ in der Häm-Gruppe der Guanylylcyclase).D. Ist auch als Lachgas bekannt.
E. Ist nicht giftig für Zellen.
Stickstoffmonoxid:
A. Hat eine lange Lebensdauer
B. Ist membrandurchlässig
C. Ist nicht reaktiv
D. Ist auch als Lachgas bekannt. Diese Antwort ist FALSCH.
Lachgas ist Distickstoffoxid, nicht Stickstoffoxid. Es ist nicht reaktiv und ungiftig, beeinträchtigt aber die Membraneigenschaften.E. Ist nicht giftig für Zellen.
Stickstoffoxid:
A. Hat eine lange Lebensdauer
B. Ist membrandurchlässig
C. Ist nicht reaktiv
D. Ist auch als Lachgas bekannt.
E. Ist nicht giftig für Zellen. Diese Antwort ist FALSCH.
NO ist hochgradig toxisch für Zellen, wenn es im Übermaß produziert wird. Es wird sogar angenommen, dass eine Überproduktion von NO bestimmte neurodegenerative Krankheiten verursacht. NO wird auch von Makrophagen als toxisches Produkt produziert, um eindringende Bakterien abzutöten.