Toll-like Receptors sind mikrobielle Erkennungsproteine, die ein breites Spektrum von Krankheitserregern erkennen. Sie sind ein entscheidendes Protein für den anfänglichen Schutz vor Infektionen und erzeugen eine sofortige, jedoch relativ unspezifische Reaktion. Diese Mini-Review beleuchtet die Rolle, die TLR in der angeborenen Immunität spielen, einschließlich Informationen über TLR-Signalwege und die mit ihnen verbundenen Moleküle.
Sehen Sie sich unser komplettes Angebot an TLR-Antikörpern an

Toll-like Receptors (TLRs) Mini-review
Als PDF herunterladen
TLRs and Innate Immunity
Toll-like Receptors (TLRs) sind wesentliche Bestandteile der angeborenen Immunantwort und damit einer der Schlüsselfaktoren bei der Erkennung und Abwehr eindringender Krankheitserreger. Sie sind Transmembranrezeptoren, die entweder auf der Zelloberfläche oder in endosomalen Vesikeln lokalisiert sein können. Sie gehören zusammen mit den Mannose- (CD206), NOD- und NALP-Rezeptoren zur Familie der Mustererkennungsrezeptoren (PRR). Da sie an der Identifizierung von Selbst und Nicht-Selbst beteiligt sind, wird vermutet, dass sie auch an Autoimmunkrankheiten beteiligt sind.
Toll-ähnliche Rezeptoren bilden eine Familie von Proteinen, die für das angeborene Immunsystem wichtig sind und von Pflanzen bis zu Säugetieren konserviert sind.
In den Jahren 1996 und 1997 zeigten Lamaitre und Kollegen, dass das Gen Toll, ein dorsoventraler Regulator der Drosophila-Entwicklung, auch an der angeborenen Immunantwort auf Pilze und gram-positive Bakterien beteiligt ist (1, 2). Diese Rolle stand im Einklang mit der strukturellen Ähnlichkeit der intrazellulären Domäne von Toll mit dem Interleukin-1B-Rezeptor.
Nahezu zeitgleich klonierte Janeways Gruppe eines der Säugetier-Homologe von Drosophila Toll, das später den Namen Toll-like receptor 4 (TLR4) erhielt. Sie beobachteten, dass eine dominante aktive Form von TLR4 in der Lage war, NFkB und NFkB-abhängige Entzündungsgene zu stimulieren, und dass TLR4 die Expression von CD80 induziert (3).
Die Expression des co-stimulatorischen Moleküls CD80 ist für die Aktivierung naiver T-Lymphozyten notwendig, und seine Induktion durch TLR4 war der erste Beweis dafür, dass das angeborene Immunsystem an der Polarisierung naiver T-Lymphozyten beteiligt sein und die adaptive Immunität aktivieren könnte (3).
TLR-Gene und Expression
Bislang wurden 11 TLR-Gene beim Menschen und 13 bei der Maus identifiziert. Sie lassen sich aufgrund ihrer Funktion und Sequenz in verschiedene Klassen einteilen. Obwohl es sich bei allen um Membranproteine handelt, sind einige TLRs in intrazellulären Vesikeln lokalisiert.
Die Expression von TLRs ist zwar sehr breit gefächert, wobei mehrere Gewebe mehr als einen Typ von TLRs exprimieren, aber das höchste Expressionsniveau und die größte Bandbreite an TLRs findet sich in den Geweben, die an der angeborenen Immunität beteiligt sind (4).
TLR-assoziierte Moleküle
Die intrazelluläre Domäne der TLRs wird aufgrund von Ähnlichkeiten mit dem IL-1-Rezeptor als Toll/IL-1 (TIR) bezeichnet, während der extrazelluläre Teil eine leucinreiche Wiederholungsdomäne (LRR) enthält. Es ist bekannt, dass die TIR-Domäne an der Signaltransduktion beteiligt ist, während die LRR-Domäne vermutlich direkt den kognitiven Liganden erkennt.
Nach der Ligandenbindung dimerisieren TLRs oder verbinden sich mit anderen Rezeptoren. Die TIR-Domäne interagiert mit anderen TIR-haltigen intrazellulären Proteinen.
Vier intrazelluläre Adaptorproteine, die eine TIR-Domäne enthalten, wurden beschrieben:
- MyD88
- TRIF (oder TICAM-1)
- TIRAP (oder MAL)
- TICAM-2 (oder TRAM)
MyD88 und TRIF definieren zwei unabhängige Signalwege, während MAL und TICAM als Brückenmoleküle wirken.
TLR-Signalweg
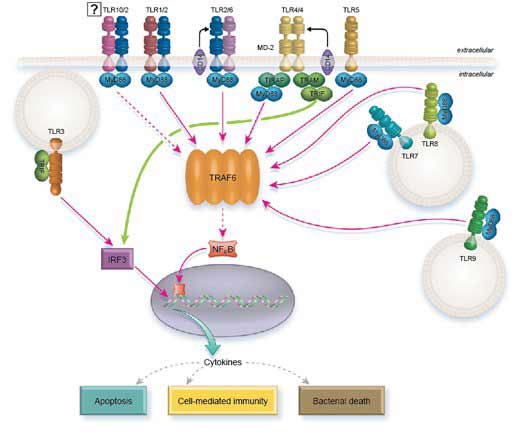
TLR-Signalweg
Alle TLRs, außer TLR3, können über MyD88 signalisieren. TLR2 und TLR4 benötigen jedoch TIRAP, um MyD88 zu rekrutieren. MyD88 wiederum rekrutiert IRAK1 und IRAK4, die sich nach der Phosphorylierung von MyD88 abspalten. Anschließend interagieren IRAK1 und IRAK4 mit TRAF6, das wiederum den NFkB-Stoffwechselweg, AP1 und IRF5 aktiviert und letztlich die Transkription von Entzündungszytokinen stimuliert.
Um diese Aufgabe zu erfüllen, phosphoryliert TRAF6 direkt IRF5 und aktiviert gleichzeitig AP1 über MAP-Kinasen. Die Freisetzung von NFkB aus seinem IKB-Inhibitor erfordert die Rekrutierung von TAK1- und TAB-Proteinen aus TRAF6, die auf die IKB-Kinase (IKKa/IKKB/NEMO) einwirken.
TLR7, TLR8 und TLR9 induzieren die Typ-I-IFN-Signalisierung über MyD88. In diesem Fall wird angenommen, dass MyD88 direkt IRF1 und indirekt IRF7 durch die Interaktion von TRAF6 mit TRAF3 aktiviert.
Anstatt über MyD88 zu wirken, signalisiert TLR3 über TRIF. Allerdings werden über diesen Weg die gleichen Effektoren aktiviert: NFkB, AP1, IRF3 und IRF7.
TLR4 ist insofern einzigartig, als er sowohl MyD88 als auch TRIF als intrazelluläre Adaptormoleküle verwendet. Außerdem benötigt er das Brückenmolekül TRAM, um TRIF zu rekrutieren, und TIRAP, um MyD88 zu rekrutieren.
Interessanterweise scheint TLR4 beide Wege nacheinander und nicht aus demselben Kompartiment zu nutzen (5). Wenn TLR4 an LPS bindet, wird TIRAP rekrutiert und rekrutiert seinerseits MyD88-Signale von der Plasmamembran, um die Transkription von Zytokinen zu aktivieren. LPS fördert auch die Internalisierung von TLR4 durch Endozytose, ein Vorgang, der die MyD88-Signalisierung ausschaltet. Zu diesem Zeitpunkt sendet der internalisierte TLR4 weiterhin Signale aus dem Endolysosomen-Kompartiment, wirkt nun aber über TRAM/TRIF und führt zur Transkription von Interferon-Genen.
Weitere Informationen zu Mustererkennungsrezeptoren, einschließlich TLRs, finden Sie auf unserer Webseite zu Mustererkennungsrezeptoren, wo Sie auch eine Übersicht über die verfügbaren Antikörper finden.
- Lemaitre, B. et al. (1996) The dorsoventral regulatory gene cassette spätzle/Toll/cactus controls the potent antifungal response in Drosophila adults.
Cell. 86:973-83 - Lemaitre, B. et al. (1997) Drosophila host defense: differential induction of antimicrobial peptide genes after infection by various classes of microorganisms.
Proc Natl Acad Sci U S A. 94:14614-9 - Medzhitov, R. et al. (1997) A human homologue of the Drosophila Toll protein signals activation of adaptive immunity.
Nature. 388:394-7 - Zarember, K.A. und Godowski, P.J. (2002) Tissue expression of human Toll-like receptors and differential regulation of Toll-like receptor mRNAs in leukocytes in response to microbes, their products, and cytokines.
J. Immunol. 168:554-561 - Barton, G.M. und Kagan, J.C. (2009) A cell biological view of Toll-like receptor function: regulation through compartmentalization.
Nat Rev Immunol. 9:535-42
Weiterlesen
- Montero Vega, M.T. und De Andrés Martín, A. (2009) The significance of toll-like receptors in human diseases.
Allergol Immunopathol(Madr). 37:252-63 - Montero Vega, M.T. and De Andrés Martín, A. (2008) Toll-like receptors: a family of innate sensors of danger that alert and drive immunity.
Allergol Immunopathol(Madr). 36:347-57 - Uematsu, S. and Akira, S. (2008) Toll-Like receptors (TLRs) and their ligands.
Handb Exp Pharmacol. :1-20 - Bauer, S. et al. (2009) Pattern recognition by Toll-like receptors.
Adv Exp Med Biol. 653:15-34 - Schmidt M. et al (2010) Crucial role for human Toll-like receptor 4 in the development of contact allergy to nickel.
Nat Immunol. 2010 Aug 15.