Cyclopentan Chemische Eigenschaften,Verwendungen,Herstellung
Physikalische und chemische Eigenschaften
Cyclopentan, auch bekannt als „Pentamethylen“, ist eine Art Cycloalkan mit der Formel C5H10. Es hat ein Molekulargewicht von 70,13. Es existiert als eine Art brennbare Flüssigkeit. Es hat einen Schmelzpunkt von 94,4 °C, einen Siedepunkt von 49,3 °C, eine relative Dichte von 0,7460 und einen Brechungsindex von 1,4068. Es ist löslich in Alkohol, Ether und Kohlenwasserstoffen und nicht löslich in Wasser. Cyclopentan ist kein planarer Ring und weist zwei Konformationen auf: die Hüllkonformation und die Halbsitzkonformation. Der Kohlenstoff-Kohlenstoff-Kohlenstoff-Bindungswinkel liegt bei 109 ° 28 ‚, die Molekularspannung ist nicht groß und der Ring ist relativ stabil. Es hat eine ähnliche chemische Eigenschaft wie Alkane. Die tödliche Konzentration in der Luft für Ratten betrug 3,8 × 10-2. Es zeigt eine rot-gelbe Farbe, wenn es mit rauchender Schwefelsäure reagiert, während es Nitrocyclopentan und Glutarsäure durch Reaktion mit Salpetersäure erzeugt. Verfahren: Es kann aus dem Petroletherdestillat durch Hochdruckspaltung von Cyclohexan in Gegenwart von Aluminium oder durch katalytische Hydrierung von Cyclopenten und Cyclopentadien gewonnen werden. Verwendungszwecke: hauptsächlich als Lösungsmittel verwendet.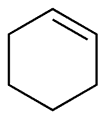
Abbildung 1: Die Cyclopentanstruktur.
Cycloalkan
Cycloalkane sind gesättigte Kohlenwasserstoffe, bei denen die Kohlenstoffatome im Molekül in einem Ring angeordnet sind und eine ausreichende Anzahl von Wasserstoffatomen verbunden ist. Bei den in Erdöl vorkommenden Cycloalkanen handelt es sich hauptsächlich um Cyclopentan und Cyclohexan.
Cycloalkane haben einen höheren Schmelzpunkt, Siedepunkt und eine höhere relative Dichte als die entsprechenden geradkettigen Alkane. Wir können naphthenisches aromatisches Rohöl zur Herstellung von hochoktanigem Straight-Run-Benzin verwenden, dessen Explosionsschutz besser ist als der von normalem Paraffin. Naphthenisches Rohöl mit niedrigem Schwefelgehalt ist nicht nur leicht zu verarbeiten, sondern auch ein ausgezeichneter Rohstoff für die Herstellung moderner Schmierstoffe. Erdöl, das relativ viele polyzyklische naphthenische Verbindungen mit langen Seitenketten enthält, ist ein ideales Material für hochwertige Schmierstoffe.
Bei Raumtemperatur und atmosphärischem Druck liegt Cycloalkan mit vier oder weniger Kohlenstoffatomen in Gasform vor, während Cycloalkane mit mehr als vier Kohlenstoffen in flüssiger Form vorliegen. Cyclopropan und Cyclobutan liegen gasförmig vor, Cyclopentan bis Cycloundecan liegen flüssig vor, Cyclododecan und höher liegen fest vor.
Die chemische Beschaffenheit des Cycloalkans hängt von der Anzahl der Kohlenstoffatome ab, die den Ring bilden. Man bezeichnet drei- und viergliedrige Ringe als kleine Ringe, fünf- bis siebengliedrige Ringe als normale Ringe, acht- bis elfgliedrige Ringe als normale Ringe und zwölfgliedrige Ringe und mehr als große Ringe. Die Kernlinien der Kohlenstoffkerne in kleinen Ringen stimmen nicht mit der Achse des Bindungsorbitals überein. In Cyclopropan ist der Ring, der von den Kernlinien der Kohlenstoffatome gebildet wird, ein gleichseitiges Dreieck mit einem Winkel von 60°, während der Winkel der Achse des sp3-Hybridorbitals der Kohlenstoff-Kohlenstoff-Einfachbindungen, die von jedem Kohlenstoff gebildet werden, 104° beträgt (siehe Abbildung 2 unten). Daher hat das Orbital nicht den größten Überlappungsgrad erreicht, was zu einer großen Winkelspannung führt. Cyclobutan weist ebenfalls eine Winkelspannung auf, die jedoch geringer ist. Dies führt zu einer geringen Stabilität des kleinen Rings, wodurch seine chemischen Eigenschaften denen von Olefinen ähneln, die mit vielen Reagenzien eine ringöffnende Additionsreaktion eingehen können. Der andere Ring hat weniger oder gar keine Winkelspannung. Cycloalkane und Alkane haben ähnliche chemische Eigenschaften und sind weniger anfällig für Ringöffnungsreaktionen, wie z. B. Reaktionen mit Wasserstoff. Cyclohexan und höhere Cycloalkane sind schwieriger zu hydrieren.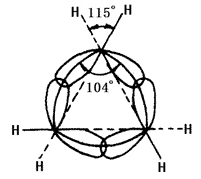
Abbildung 2 ist eine schematische Darstellung der Überlappung der sp3-Hybridisierungsorbitale in Cyclopropan.
Cyclopropan (bei Raumtemperatur) und Cyclobutan (bei Erwärmung) können Additionsreaktionen mit Halogen und Halogenwasserstoff eingehen.
Die offene Schleife tritt zwischen den beiden Atomen auf, die die meisten und die wenigsten Wasserstoffatome verbinden. Die Addition entspricht der Markovschen Regel. Während der normale Ring unter der Stimulation von Licht oder Wärme eine Substitutionsreaktion mit dem Halogen haben kann.
Bei Raumtemperatur kann Cycloalkan nicht durch Kaliumpermanganat oxidiert werden.
Cyclopentan, Cyclohexan und seine alkylsubstituierten Produkte sind in bestimmten Erdölen enthalten. Cycloalkane können auch durch geeignete Verfahren, wie Dihalogenalkan-Cyclisierung und Hydrierung von aromatischen Kohlenwasserstoffen, synthetisiert werden.
Diese Information wurde von Xiaonan aus Chemicalbook (2015-08-17) bearbeitet.
Gefahrensituation
Verschlucken und Einatmen sind mäßig giftig. (2) Da es entzündlich ist, besteht ein erhöhtes Risiko der Verbrennung. Die zulässige Konzentration in der Luft beträgt in den Vereinigten Staaten 600ppm (1720mg/m3).
Schädliche Wirkungen und Vergiftungssymptome
Das Einatmen hoher Konzentrationen von Cyclopentan kann zu einer Hemmung des zentralen Nervensystems führen, obwohl seine akute Toxizität gering ist. Zu den Symptomen einer akuten Exposition gehören zunächst Erregung, gefolgt von Gleichgewichtsstörungen, bis hin zu Stupor und Koma. Selten kommt es zum Tod durch Atemstillstand. Es wurde berichtet, dass Tiere, die mit dieser Ware gefüttert wurden, schweren Durchfall bekommen können, was zu einem Kollaps der Herz-, Lungen- und Lebergefäße und zu einer Degeneration des Gehirns führt.
Schutzmaßnahmen
Es kann zur Verbesserung der Produktionsanlagen verwendet werden. Verwenden Sie Hautschutzcremes oder Handschuhe, um die Haut zu schützen.
Medizinische Betreuung
Bei regelmäßiger ärztlicher Untersuchung auf mögliche Reizwirkungen auf Haut und Atemwege sowie auf Komplikationen von Niere und Leber achten.
Transportvorschriften
Entzündbare Flüssigkeit der Klasse I. Code of Hazard Regulations: 61013. Der Behälter muss bei der Beförderung mit der Kennzeichnung „entzündbare Flüssigkeit“ versehen sein.
Feuerlöschmittel
Siehe „Cyclohexan“.
Empfohlene Entsorgungsmethoden
Verbrennung;
Chemische Eigenschaften
Es erscheint als farblose Flüssigkeit mit einem Schmelzpunkt von-93,9 °C, dem Siedepunkt von 49,26 ° C, der relativen Dichte von 0,7460 (20/4 ° C), dem Brechungsindex von 1,4068 und dem Flammpunkt von-37 °C. Es ist mischbar mit Alkohol, Ether und anderen organischen Lösungsmitteln, wobei nicht leicht sein, in Wasser gelöst werden.
Verwendungen
(1) Es kann als Lösungsmittel für die Lösungspolymerisation von Polyisoprenkautschuk und Celluloseether verwendet werden. Es kann als Ersatz für Freon als Isoliermaterial in Kühl- und Gefrierschränken sowie als Schaumbildner für andere harte PU-Schäume und als Standard für chromatographische Analysen verwendet werden.
(2) Wird als Standardsubstanz für chromatographische Analysen, Lösungsmittel, Motorkraftstoffe und azeotrope Destillationsmittel verwendet.
Herstellungsmethode
Cyclopentan ist ein Bestandteil des Petrolether im Siedebereich von 30-60 °C, sein Gehalt beträgt im Allgemeinen 5-10 %. Atmosphärische Destillation bei einem Rückflussverhältnis von 60:1 in einem Turm von 8 m Höhe; zunächst werden Isopentan und n-Pentan abdestilliert; dann wird die Fraktionierung fortgesetzt, um ein Cyclopentan mit einer Reinheit von über 98 % zu erhalten. Cyclopentan kann auch durch Reduktion von Cyclopentanon oder katalytische Hydrierung von Cyclopentadien gewonnen werden.
Gefahren &Sicherheitsinformationen
Kategorie Entzündbare Flüssigkeiten
Toxizitätseinstufung: Geringe Toxizität
Akute Toxizität: oral – Ratte LD50: 11400 mg/kg; oral – Maus LD50: 12800 mg/kg
Gefährliche Eigenschaft von Explosivstoffen: explosiv bei Vermischung mit Luft
Entflammbarkeit und gefährliche Situationen: entflammbar im Brandfall, hohe Temperatur und Oxidationsmittel mit Verbrennung, die reizenden Rauch freisetzt
Lagereigenschaften: Lager: belüftet, bei niedriger Temperatur und trocken; mit Oxidationsmittel getrennt lagern
Löschmittel: Trockenpulver, Kohlendioxid, Schaum, 1211 Löschmittel
Arbeitsschutznorm: TWA 1720 mg/m3; STEL 2150 mg/kg
Chemische Eigenschaften
farblose Flüssigkeit mit benzinartigem Geruch
Chemische Eigenschaften
Cyclopentan ist eine farblose Flüssigkeit.
Physikalische Eigenschaften
Farblose, bewegliche, brennbare Flüssigkeit mit einem Geruch, der an Cyclohexan erinnert.
Verwendungen
Cyclopentan ist ein Erdölprodukt. Es entsteht durch katalytisches Cracken von Cyclohexan bei hohen Temperaturen oder durch Reduktion von Cyclopentadien. Es kommt in Petroletherfraktionen und in vielen handelsüblichen Lösungsmitteln vor und wird als Lösungsmittel für Farben, bei der Extraktion von Wachs und Fett sowie in der Schuhindustrie verwendet.
Verwendungen
Als Laborreagenz; bei der Herstellung von Arzneimitteln; in Lösemitteln und in Petrolether enthalten; Treibgas als Druckmittel.
Herstellungsmethoden
Cyclopentan kommt in Erdölätherfraktionen vor und wird durch Cracken von Cyclohexan in Gegenwart von Aluminiumoxid bei hoher Temperatur und hohem Druck oder durch Reduktion von Cyclopentadien hergestellt.
Definition
ChEBI: Ein Cycloalkan, das aus fünf Kohlenstoffen besteht, die jeweils mit zwei Wasserstoffatomen oberhalb und unterhalb der Ebene verbunden sind. Es ist der Stamm der Klasse der Cyclopentane.
Allgemeine Beschreibung
Klare farblose Flüssigkeit mit petroleumartigem Geruch. Flammpunkt von -35°F. Geringere Dichte als Wasser und unlöslich in Wasser. Die Dämpfe sind schwerer als Luft.
Luft &Wasser Reaktionen
Leicht entzündlich. Unlöslich in Wasser.
Reaktivitätsprofil
CYCLOPENTANE ist unverträglich mit starken Oxidationsmitteln wie Chlor, Brom, Fluor.
Gesundheitsgefährdung
Einatmen verursacht Schwindel, Übelkeit und Erbrechen; konzentrierte Dämpfe können Bewusstlosigkeit und Kollaps verursachen. Dämpfe verursachen leichtes Brennen der Augen. Kontakt mit der Flüssigkeit führt zu Augenreizungen und kann bei längerem Verbleib die Haut reizen. Verschlucken führt zu Magenreizungen. Einatmen führt zu schwerer Lungenreizung und sich rasch entwickelndem Lungenödem; Erregung des zentralen Nervensystems mit anschließender Depression.
Gesundheitsgefährdung
Cyclopentan ist ein schwach akut toxischer Stoff. In hohen Konzentrationen kann es zu einer Depression des zentralen Nervensystems mit Symptomen von Erregbarkeit, Gleichgewichtsverlust, Stupor und Koma führen. Bei Ratten kann es nach einer 30-60-minütigen Exposition gegenüber 100.000-120.000 ppm in der Luft zu Atemversagen kommen. Es ist reizend für die oberen Atemwege, die Haut und die Augen. In der Literatur gibt es keine Informationen über die chronischen Auswirkungen einer längeren Exposition gegenüber Cyclopentan.
Brandgefahr
Verhalten im Brandfall: Behälter können explodieren.
Chemische Reaktivität
Reaktivität mit Wasser Keine Reaktion; Reaktivität mit üblichen Materialien: Keine Reaktion; Stabilität beim Transport: Stabil; Neutralisationsmittel für Säuren und Ätzmittel: Nicht zutreffend; Polymerisation: Nicht zutreffend; Polymerisationsinhibitor: Nicht sachdienlich.
Sicherheitsprofil
Mild giftig bei Verschlucken und Einatmen. Hohe Konzentrationen haben narkotische Wirkung. Eine sehr gefährliche Brandgefahr, wenn es Hitze oder Flammen ausgesetzt wird; kann mit Oxidationsmitteln reagieren. Zur Brandbekämpfung Schaum, CO2, Trockenchemikalien verwenden. Wenn es bis zur Zersetzung erhitzt wird, entstehen beißender Rauch und Dämpfe.
Potenzielle Exposition
Cyclopentan wird als Lösungsmittel verwendet.
Quelle
Bestandteil von hochoktanigem Benzin (zitiert, Verschueren, 1983). Harley et al. (2000) analysierten die Headspace-Dämpfe von drei Sorten bleifreien Benzins, denen Ethanol als Ersatz für Methyl-tert.-butylether zugesetzt wurde. Cyclopentan wurde in einer identischen Konzentration von 1,4 Gew.-% in den Dämpfen von Normal-, Mittel- und Premiumbenzin nachgewiesen.
Schauer et al. (1999) wiesen Cyclopentan in den Abgasen eines dieselbetriebenen mittelschweren Lastkraftwagens mit einer Emissionsrate von 410 μg/km nach.
California Phase II reformulated gasoline enthielt Cyclopentan in einer Konzentration von 4,11 g/kg. Die Auspuffemissionen von benzinbetriebenen Kraftfahrzeugen mit und ohne Katalysator lagen bei 0,78 bzw. 85,4 mg/km (Schauer et al., 2002).
Environmental Fate
Biologisch. Cyclopentan kann von Mikroben zu Cyclopentanol oxidiert werden, das zu Cyclopentanon oxidiert werden kann (Dugan, 1972).
Photolytisch. Die folgenden Geschwindigkeitskonstanten wurden für die Reaktion von Oktan und OH-Radikalen in der Atmosphäre angegeben: 3,7 x 10-12 cm3/Molekül?s bei 300 K (Hendry und Kenley, 1979); 5,40x 10-12 cm3/Molekül?s (Atkinson, 1979); 4,83 x 10-12 cm3/Molekül?s bei 298 K (DeMore undBayes, 1999); 6,20 x 10-12, 5,24 x 10-12 und 4.43 x 10-12 cm3/Mol-Sekunde bei 298, 299 bzw. 300 K (Atkinson, 1985), 5,16 x 10-12 cm3/Mol-Sekunde bei 298 K (Atkinson, 1990) und 5,02 x 10-12 cm3/Mol-Sekunde bei 295 K (Droege und Tilly, 1987).
Chemisch/Physikalisch. Cyclopentan wird nicht hydrolysiert, da es keine hydrolysierbare funktionelle Gruppe hat. Bei der vollständigen Verbrennung an der Luft entstehen Kohlendioxid und Wasser.
Bei höheren Temperaturen bricht der Ring auf und bildet Ethylen und vermutlich Alken und Wasserstoff (Rice und Murphy, 1942).
Versand
UN1146 Cyclopentan, Gefahrenklasse: 3; Kennzeichnung: 3 – Entzündbare Flüssigkeit.
Reinigungsmethoden
Man befreit es von Cyclopenten durch zweimalige Passage durch eine Säule aus sorgfältig getrocknetem und entgastem aktiviertem Kieselgel. Es kommt in Erdöl vor und ist HÖCHST ENTZÜNDBAR.
Unverträglichkeiten
Kann mit Luft ein explosionsfähiges Gemisch bilden, sich statisch aufladen und eine Entzündung seiner Dämpfe verursachen. Kontakt mit starken Oxidationsmitteln kann Feuer und Explosion verursachen.
Abfallentsorgung
Das Material mit einem brennbaren Lösungsmittel auflösen oder mischen und in einer chemischen Verbrennungsanlage mit Nachbrenner und Wäscher verbrennen. Alle bundes-, landes- und ortsüblichen Umweltvorschriften müssen beachtet werden.