Wie wir gesehen haben, enthält unsere Ernährung viele Kohlenhydrate, und Sie fragen sich vielleicht, ob es eine Möglichkeit gibt, eine Probe zu analysieren, um festzustellen, ob es sich um Saccharose oder einen der synthetischen Süßstoffe wie Sorbit oder Maissirup mit hohem Fruchtzuckergehalt handelt, oder sogar um eine Verbindung wie Vitamin C, das aus Zuckern synthetisiert wird und wie diese nur C, H und O enthält. Es gibt eine solche Methode, und sie ist eine der grundlegendsten Formen der Analyse, die so genannte Elementaranalyse. Sie ist eine der ersten Methoden, die Forscher anwenden, um eine neue Verbindung zu identifizieren.
Bis zu diesem Punkt haben wir alle stöchiometrischen Verhältnisse aus den Koeffizienten ausgeglichener chemischer Gleichungen erhalten. Chemische Formeln geben jedoch auch relative Stoffmengen an, und stöchiometrische Verhältnisse lassen sich auch aus ihnen ableiten. Die Formel CO2 besagt zum Beispiel, dass unabhängig von der Größe der Kohlendioxidprobe immer 2 Mol Sauerstoffatome auf ein Mol Kohlenstoffatome entfallen. Das heißt, aus der Formel CO2 ergibt sich das stöchiometrische Verhältnis
\
Wir können auch feststellen, dass für CO2
\
\
(Die Kehrwerte dieser stöchiometrischen Verhältnisse sind auch für CO2 gültig.)
Stöchiometrische Verhältnisse, die aus Formeln und nicht aus Gleichungen abgeleitet werden, werden bei dem gebräuchlichsten Verfahren zur Bestimmung der empirischen Formeln von Verbindungen verwendet, die nur C, H und O enthalten. Das gesamte H in der Verbindung wird in H2O(g) umgewandelt, das selektiv in einem zuvor gewogenen Absorptionsrohr aufgefangen wird. Das gesamte C wird in CO2(g) umgewandelt und dieses wird selektiv in einem zweiten Rohr absorbiert. Die Massenzunahme jedes Röhrchens gibt an, wie viel H2O bzw. CO2 bei der Verbrennung der Probe entstanden ist
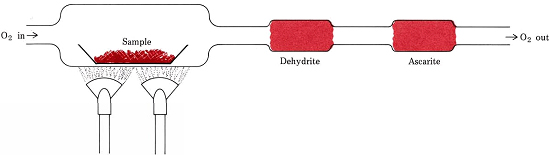
Abbildung \(\PageIndex{1}\) Ein Verbrennungszug. H2O und CO2, die durch die Kombination von O2 mit H und C in der Probe entstehen, werden selektiv von Röhren absorbiert, die Dehydrit und Ascarit (NaOH auf Asbest) enthalten.
Beispiel \(\PageIndex{1}\): Empirische Formel von Ascorbinsäure
Eine 6,49-mg-Probe von Ascorbinsäure (Vitamin C) wurde in einem Verbrennungszug verbrannt. Es bildeten sich 9,74 mg CO2 und 2,64 mg H2O. Bestimmen Sie die Summenformel der Ascorbinsäure.
Lösung Wir müssen die Menge an C, die Menge an H und die Menge an O in der Probe kennen. Das Verhältnis dieser Werte ergibt die Indizes in der Formel. Die ersten beiden können aus den Massen von CO2 und H2O mit Hilfe der molaren Massen und der stöchiometrischen Verhältnisse ermittelt werden
\
Daher
Die Verbindung kann auch Sauerstoff enthalten haben. Um dies festzustellen, berechnet man die Massen von C und H und subtrahiert sie von der Gesamtmasse der Probe
\
Damit erhält man
\
und
\
Die Mengenverhältnisse der Elemente in der Ascorbinsäure sind also
\
\
Da nC:nH:nO 3 mol C:4 mol H:3 mol O ist, lautet die Summenformel C3H4O3.
Hier ist eine Zeichnung eines Ascorbinsäuremoleküls abgebildet. Durch Auszählen der Atome kann man feststellen, dass die Summenformel C6H8O6 lautet – genau das Doppelte der Summenformel. Es ist auch klar, dass es mehr über ein Molekül zu wissen gibt als nur die Anzahl der Atome jeder Art, die vorhanden sind. Bei Ascorbinsäure, wie auch bei anderen Molekülen, sind die Art und Weise, wie die Atome miteinander verbunden sind, und ihre Anordnung im dreidimensionalen Raum von großer Bedeutung. Ein Bild, das zeigt, welche Atome mit welchen verbunden sind, wird als Strukturformel bezeichnet. Empirische Formeln können aus der prozentualen Zusammensetzung oder aus Verbrennungsversuchen gewonnen werden, und wenn das Molekulargewicht bekannt ist, können Molekularformeln aus denselben Daten bestimmt werden. Um Strukturformeln zu ermitteln, sind kompliziertere Experimente erforderlich. In Beispiel 2 haben wir die Masse von O durch Subtraktion der Massen von C und H von der Gesamtmasse der Probe erhalten. Dabei wurde angenommen, dass nur C, H und O vorhanden sind. Manchmal kann eine solche Annahme falsch sein. Als Penicillin zum ersten Mal isoliert und analysiert wurde, übersah man die Tatsache, dass es Schwefel enthält. Dieser Fehler wurde erst nach einiger Zeit entdeckt, weil das Atomgewicht von Schwefel fast genau doppelt so hoch ist wie das von Sauerstoff. Zwei Sauerstoffatome wurden anstelle eines Schwefelatoms in der Formel ersetzt.
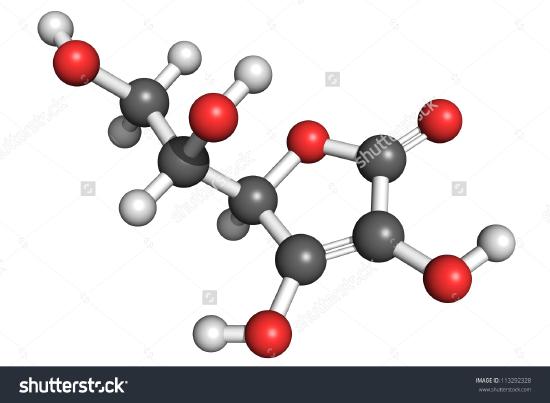
Abbildung \(\PageIndex{2}\) Eine 3D-Darstellung von L-Ascorbinsäure 1
Aus ChemPRIME: 3.4: Analyse von Verbindungen