Einleitung
Der erste Hinweis in der Geschichte der Menschheit auf die Aufnahme von Eisen und Alkohol stammt vielleicht aus dem Jahr 1200 v. Chr. Eine Legende aus Thessalien erzählt, wie Apolodorus von Iphycus, der auf einem Feld stand und seinem Vater beim Kastrieren von Lämmern zusah, von der gleichen Strafe bedroht wurde; als er erwachsen wurde, war Apolodorus impotent. Ein Zauberer namens Melampus, der von einem Geier inspiriert wurde, heilte Apolodorus, indem er ihm in einem Glas Wein den Rost des Messers zu trinken gab, mit dem sein Vater die Lämmer kastriert hatte und mit dem er bedroht worden war.
Zahlreich ist die Population der alkoholkranken Patienten, die in unserem Krankenhaus behandelt werden, ebenso wie die derjenigen, die stationär aufgenommen werden müssen, wenn man alle krankhaften Erscheinungen berücksichtigt, die damit einhergehen.
Mit dieser Mitteilung möchten wir an eine der hämatologischen Pathologien erinnern, die bei Alkoholismus auftreten und die sich oft allein durch Abstinenz zurückbilden können: die sideroblastische Anämie und die Hämosiderose.
Bjorkman beschrieb 1956 vier Patienten mit chronisch refraktären Anämien und sideroblastischen Ringen mit Preußischblau-Färbung der Knochenmarkzellen.
Der erste Nachweis, dass diese Sideroblastenringe mit Alkohol in Verbindung stehen, wurde 1965 von Mac Gibbon und Mollin erbracht; seither ist Alkoholismus die häufigste Ursache für diese Pathologie.
1969 beschrieb Hines (er ersetzte das i durch eine 1) bei chronischem Alkoholismus das Auftreten einer reversiblen sideroblastischen Anämie aufgrund von Abstinenz.
Wirkungen des Alkohols
Die vielfältigen pathologischen Wirkungen des Alkohols (ersetzen durch 2) auf das blutbildende Gewebe lassen sich unterteilen in:
Diejenigen, die aus der direkten Wirkung des Alkohols resultieren
Diejenigen, die aus sekundären Effekten von Ernährungsmängeln resultieren
Diejenigen, die durch Lebererkrankungen verursacht werden
Anämie ist eine häufige Ursache bei Alkoholikern.(durch 3 ersetzen) Die häufigsten sind die megaloblastische Anämie und die sideroblastische Anämie.
Letzteres würde mit Ernährungsfaktoren und Störungen des Vitamin-B6-Stoffwechsels zusammenhängen.
Eine Abnahme der Fähigkeit von Pyridoxin, sich in Pyridoxalphosphat, die aktive Form von Vitamin B6, umzuwandeln, wurde als Folge einer Hemmung der Pyridoxalphosphokinase-Aktivität der Erythrozyten nachgewiesen.
Es wurde auch vermutet, dass Ethanol als Stimulans der alkalischen Membranphosphatase wirken kann, indem es den Abbau von zellulärem Pyridoxalphosphat beschleunigt (ersetzen durch 4). Diese Veränderung des Pyridoxin-Stoffwechsels wird durch einen Rückgang der Urinausscheidung von Pyridoxin-4-Pyridoxinsäure, einem Metaboliten von Pyridoxin, und einen Rückgang des Pyridoxalphosphats im Serum untermauert.
Pyridoxalphosphat wirkt auch als Hilfsfaktor bei der Synthese von Delta-Aminolävulinsäure, die eine der Vorstufen der eisenhaltigen Hämoglobinfraktion, d.h. Hämo, ist.
Andere Studien haben gezeigt, dass Ethanol nicht nur direkt, sondern auch über seinen Metaboliten Acetaldehyd wirkt. Acetaldehyd wird auch zugeschrieben, den Abbau von Pyridoxalphosphat zu verstärken, was zu einem Rückgang des Pyridoxalphosphats im Serum führt und die Bildung von Pyridoxalphosphat in den roten Blutkörperchen des Menschen in vitro verschlechtert, indem es den Abbau von phosphorylierten Vitamin B6-Verbindungen beschleunigt.
Wenn Eisenfärbemethoden (Preußischblau und Perlenfärbung) verwendet werden, neigen eisenhaltige Nicht-Häm-Granulate, vermutlich in Form von Hämosiderin oder Ferritin, dazu, einen Ring um den Kern der Erythroblasten zu bilden. Diese werden als Sideroblastenringe oder Ringsideroblasten bezeichnet.
Die Elektronenmikroskopie hat gezeigt, dass diese Sideroblasten die Eisenablagerungen auf der Ebene der Mitochondrien oder der zytoplasmatischen Körper haben.
Diese morphologischen Anomalien sind mit allen Merkmalen einer ineffektiven Erythropoese verbunden: erythroide Hyperplasie, erhöhte Eisenaufnahme durch erythroide Vorläufer des Knochenmarks, subnormaler Einbau von Eisen in das zirkulierende Hämoglobin mit Rückfluss von Eisen in den Kreislauf, was zu Hyperferremie, Zerstörung von Normoblasten innerhalb des Knochenmarks, Anämie und Retikulozytopenie führt.
Die Häufigkeit von sideroblastischen Ringen im erythroiden Knochenmark ist bei chronisch kranken Patienten und bei unterernährten alkoholkranken Patienten höher.
Klinische und experimentelle Hinweise deuten darauf hin, dass ein Ernährungsfaktor bei der Pathogenese der sideroblastischen Anämie bei alkoholkranken Patienten eine wichtige Rolle spielt.
Die experimentelle chronische Verabreichung von Alkohol an menschliche Probanden hat zu sideroblastischen Veränderungen im Knochenmark geführt.
Wurde Alkohol in Verbindung mit einer pyridoxin- und folatarmen Ernährung verabreicht, entwickelten sich bei den meisten untersuchten Personen nach einigen Wochen Ringe von
Sideroblasten.
Im Jahr 1970 erwähnen Hines und Cowan eine Veränderung der Phosphorylierung von Pyridoxin zu Pyridoxalphosphat und bestätigen damit die Störung des Pyridoxinstoffwechsels durch drei Untersuchungslinien:
Bei 2 von 3 Probanden, die eine folatarme Diät mit Alkoholsupplementierung erhielten, wurden vermindertes Pyridoxalphosphat und sideroblastische Ringe festgestellt. Sie zeigten dann eine hämatologische Reaktion auf die Verabreichung von Pyridoxalphosphat, aber nicht auf Folsäure oder Pyridoxintherapeutika.
Nach der Verabreichung von Pyridoxin bei chronisch kranken Alkoholikern kommt es im Vergleich zu Kontrollen zu einem Mangel an Pyridoxalphosphatbildung.
Sie beschreiben eine Verringerung der Umwandlung von Pyridoxin in Pyridoxalphosphat durch ein Erythrozytenenzym in vitro bei alkoholisierten Personen. Dies führt zur Annahme einer direkten Unterdrückung der Pyridoxinphosphorylase in Erythrozyten durch Alkohol. Eine alternative Erklärung für den Rückgang von Pyridoxalphosphat deutet jedoch darauf hin, dass Acetaldehyd, der Hauptmetabolit von Alkohol, die Membranphosphataseaktivität stimuliert und auch die Menge an Pyridoxalphosphat verringert, die von den roten Blutkörperchen in das Plasmakompartiment übertragen wird.
Unabhängig vom Mechanismus ist das Ergebnis jedoch dasselbe: Es kommt zu einem Anstieg des Fe-Gehalts in den Erythroblasten (Sideroblasten)
Bei der Sideroblastose kommt es zu einem mangelhaften Einbau von Eisen in die roten Blutkörperchen, was zu Hypochromie, ineffektiver Erythropoese und erhöhter Siderämie führt.
Hämosiderose bei Alkoholikern (ersetzen durch 5) Eine Vielzahl von Ursachen für eine Eisenüberladung bei Alkoholikern wurde einzeln oder gemeinsam in Betracht gezogen, darunter auch die signifikante Erhöhung des Eisengehalts einiger alkoholischer Getränke (insbesondere von Wein), erhöhte ethanolinduzierte Salzsäuresekretion im Magen, Hämolyse, gastrointestinaler Blutverlust, Folsäuremangel, erhöhte Darmabsorption aufgrund von Leberschäden und Bauchspeicheldrüsenschäden, was die Sideremie weiter verstärkt und zu Hämosiderose führt.
Verschiedene Studien belegen erhöhte Serumferritinwerte bei alkoholkranken Patienten, was auf erhöhte Eisenspeicher hinweist.
Nach Verabreichung von Eisenchelatoren wie Desferroxamin und anschließender Messung der Siderurie können die Eisenspeicher semiquantitativ bewertet werden. Bei Alkoholikern ist die Eisenausscheidung nach diesen Chelatbildnern im Vergleich zu Kontrollen ebenfalls erhöht.
Andere Studien zeigen jedoch bei hospitalisierten Alkoholikern, dass sowohl die Serum-Eisen- als auch die Ferritin-Konzentrationen innerhalb normaler Grenzen oder seltener erhöht sind. Diese Unterschiede können auf die Auswahl der in die Studie einbezogenen Patienten zurückzuführen sein; wenn Patienten aufgrund von Ösophagusvarizen gastrointestinale Blutungen haben, können ihre Eisenspeicher erschöpft sein, selbst wenn sie vor der Blutung über dem Normalwert lagen.
Schließlich ist anzumerken, dass in den meisten Studien, die zur Messung des Serumeisens durchgeführt wurden, dieses bei Alkoholikern stets erhöht war, wobei eine Korrelation zwischen den Eisenablagerungen und der Menge des konsumierten Alkohols bestand, was darauf schließen lässt, dass dieses Element die Ursache der Siderose ist.
Eisenabsorption
Bei einer täglichen Aufnahme von etwa 5 bis 15 mg Eisen werden nur 10 % absorbiert.
Faktoren, die die Eisenabsorption beeinflussen, können auf drei Ebenen wirken: intraluminal, über die Schleimhäute und allgemein.
Auf intraluminaler Ebene hängt die Eisenabsorption bekanntermaßen von der Wechselwirkung verschiedener Nahrungsmittel ab, so dass einige, wie z. B. Aminosäuren, die Absorption erleichtern und andere sie verringern können. Das Fehlen von Verdauungssekreten kann ein Faktor sein, der die Absorption verändert.
Bei einem Versuch, die Hämosiderose zu erklären, wurde zunächst angenommen, dass die Ernährung von Alkoholikern sehr reich an diesem Element ist. Diese Beobachtung beruht auf der so genannten Bantushämosiderose oder Bantushämosiderose. Von Südafrikanern durchgeführte Studien über diese Stämme ergaben, dass ein von ihnen zubereitetes Getränk namens Kefir, eine Art Bier, in Eisengefäßen gebraut wurde und einen Eisengehalt von 30 bis 100 mg pro Liter aufwies. Der Alkoholgehalt des Getränks war sehr gering, und sie nahmen große Mengen davon zu sich, bis zu 1000 mg Eisen täglich. Die Herstellung von Kefir wird nicht mehr praktiziert, so dass die Hämosiderose bei diesem Stamm verschwunden ist.
Die in den verschiedenen alkoholischen Getränken enthaltenen Eisenmengen sind sehr unterschiedlich und erreichen in einigen Fällen bis zu 350 mg pro Liter (Rumänien), obwohl im Allgemeinen davon ausgegangen werden kann, dass Wein (Weiß-, Rot- oder Rotwein) reich an diesem Metall ist.
Es gibt aber auch viele Alkoholiker, deren Hauptgetränk nicht Wein, sondern Whisky, Bier oder andere Getränke sind, die nur geringe Mengen Eisen enthalten.
Andererseits ist trotz der Studie über Bantus ein Überschuss an Eisen in der Ernährung kein ausreichender Grund für die Entwicklung einer Hämosiderose. So besteht in Äthiopien die Grundlage der Ernährung aus Teff, einem Saatgut, das viel Eisen enthält, mit einer täglichen Aufnahme von 300 bis 500 mg dieses Metalls. Trotz dieser Einnahme sind die Ablagerungen nicht erhöht und die Häufigkeit der Eisenmangelanämie unterscheidet sich nicht von der allgemeinen Bevölkerung.
Es ist also offensichtlich, dass die Eisenmenge in der Nahrung keinen Wert hat.
So weit scheint es, dass Alkohol auf intraluminaler Ebene keine Rolle bei der Absorption von Eisen spielt.
Allgemein ist bekannt, dass der Zustand der Eisenspeicher die Absorption beeinflusst; wenn sie vermindert sind, steigt die Absorption und umgekehrt. Auch die Erythropoese ist auf dieser Ebene involviert und erhöht die Aufnahme, wenn sie zunimmt. Alkohol scheint die Umwandlung von Plasmaeisen nicht zu beschleunigen, was den Anstieg seiner Absorption erklären könnte.
Auf der Ebene der Schleimhäute kann die Menge des in den Schleimhäuten enthaltenen Eisens ebenso wie der Grad der Proteinsynthese die Eisenabsorption beeinflussen. Es hat sich gezeigt, dass ein Folsäuremangel nach Alkoholkonsum für eine erhöhte Eisenabsorption und eine anschließende Siderose verantwortlich sein kann, die die schädlichen Auswirkungen des Alkohols auf das Parenchym und insbesondere auf die Leber verschlimmert.
In Tierversuchen wurde gezeigt, dass eine chronische Alkoholverabreichung mit einer erhöhten intestinalen Eisenabsorption einhergehen kann, deren Mechanismus unbekannt ist.
In den letzten zehn Jahren wurden mindestens drei Mechanismen nachgewiesen, die an der Eisenverlagerung durch die Duodenalschleimhaut beteiligt sind:
Transporter-vermittelt (reguliert)
Passiver Mechanismus, der durch nicht veresterte Fettsäuren vermittelt wird
(Unregulierter) parazellulärer Eintritt
In vivo und in vitro Studien haben eine erhöhte intestinale Permeabilität bei chronischen Alkoholikern gezeigt, die einen möglichen Mechanismus für die intestinale Eisenabsorption darstellt.
Andere Studien deuten darauf hin, dass die intrinsische Fähigkeit der Darmschleimhaut alkoholkranker Patienten, Eisen aufzunehmen, erhöht sein könnte.
Es wurde beobachtet, dass bei Patienten mit erhöhtem Serumeisen die Eisenwerte in der ersten Woche des Krankenhausaufenthalts mit der Entwicklung von Retikulozyten abnahmen. Es wurde auch festgestellt, dass die sideroblastischen Veränderungen in Übereinstimmung mit anderen Autoren reversibel waren. Die charakteristischen Ringe im Knochenmark verschwanden in der ersten Woche des Krankenhausaufenthalts, obwohl einige davon zwölf Tage lang bestehen blieben.
In jüngster Zeit (ersetzen durch 6) wurden bei Patienten mit chronischem Alkoholismus erhöhte Serum-Asialotransferrin-Spiegel festgestellt; dies deutet auf eine erhöhte Fähigkeit hin, Eisen an das Gewebe, insbesondere an die Hepatozyten, abzugeben, verglichen mit normalen Transferrin-Varianten.
Es wurde darauf hingewiesen, dass möglicherweise auch ein enger Zusammenhang zwischen sideroblastischen Veränderungen und Folatmangel besteht. Es wird vermutet, dass dieser Mangel die notwendige Voraussetzung für die Ausprägung sideroblastischer Veränderungen bei Alkoholikern sein könnte, obwohl andere Autoren anderer Meinung sind, da sie trotz ausgeprägter Anämie keine megaloblastischen Veränderungen im Knochenmark und keine Makrozytose oder neutrophile Hypersegmentierung im peripheren Blut aufwiesen und die Folatkonzentrationen im Serum und in den Erythrozyten normal waren.
Es ist wichtig, darauf hinzuweisen, dass bei alkoholkranken Patienten die Anämie chronischer Erkrankungen aufgrund von Tuberkulose, bösartigen Erkrankungen oder Nierenversagen oft mit einer sideroblastischen Anämie einhergeht, die in dieser Bevölkerungsgruppe sehr häufig ist.
Zusammenfassend lässt sich sagen, dass Alkoholkonsum in Verbindung mit einer unzureichenden Ernährung wahrscheinlich zur Entwicklung einer sideroblastischen Anämie und einer Hämosiderose führt, deren Pathogenese noch nicht geklärt ist; zu den wahrscheinlichen Faktoren gehören:
Toxische Wirkung von Alkohol auf einen oder mehrere Schritte der Häm-Synthese.
Assoziation mit einem schlechten Ernährungszustand, der zu einer Pyridoxalphosphatverarmung und einem beschleunigten Katabolismus führt, der durch Acetaldehyd, eine Lebererkrankung oder beides verursacht wird
Verstärkter Folsäuremangel, bei dem Nahrungsentzug und -ersatz eine wichtige Rolle spielen.
Klinischer Fall:
Ein 55-jähriger männlicher Patient wurde mit Ödemen der unteren Gliedmaßen (1/6 suprapatellar, 2/6 infrapatellar) und des Kreuzbeins von weicher Konsistenz, abdominaler Distension, Hautblässe der Schleimhäute, Asthenie und progressiver Adynamie von drei Monaten Dauer aufgenommen.
Anamnese:
Chronischer Alkoholismus (2 bis 3 Liter Wein und/oder Bier pro Tag) und Rauchen (40 Zigaretten pro Tag), beides seit 30 Jahren.
Ergebnisse der auf der Station durchgeführten Untersuchungen:
Röntgenaufnahme des Brustkorbs: Verengung des rechten Sinus costodiaphragma. Cardiothorakaler Index leicht erhöht.
Parazentese: exsudative Merkmale.
Transfusionen: Aufgrund von HTO ist die Transfusion von 2 Einheiten deplasmatisierter roter Blutkörperchen angezeigt.
Präumptive Diagnose:
Etiologisch: Chronische Äthylismus. Rauchen.
Pathophysiologisch: Aszitisch-ödematöses Syndrom. Aszitisch-ödematöses Syndrom. Aszitisch-ödematöser Schleim. Anämie. Pleuraerguss. Leberversagen.
Anatomopathologisch: Hepatomegalie. Kardiomegalie.
Ergebnisse der während des Krankenhausaufenthalts durchgeführten Untersuchungen:
FEDA: Chronische Gastritis.
Doppelkontrasteinlauf Dickdarm: Intestinaler Transit erhalten.
Echokardiogramm: Mäßiger Perikarderguss.
Echopleural: Pleuraerguss rechts.
Echoabdominal: Leber kompatibel mit Fettleber.
Serologie: negativ für VDRL, Chagas, Hepatitis B und C.
PAMO und BMO: Knochenmark mit schwerer Dyspoiesis der roten Serie.
Perls: Es werden vermehrt intra- und extrazelluläre Eisenkörnchen beobachtet.
PBH: Das gewonnene Material war für eine diagnostische Aussage wenig repräsentativ.
Labor
Hämatokrit (%): schwankte von 11.8 bis 19
Rote Blutkörperchen (x10E12/l): mit einer Schwankung von 1,1 bis 1,94
Weiße Blutkörperchen (x10E9/l): mit einer Schwankung von 7,7 bis 9.2
Hämoglobin (g/dL): reichte von 4,4 bis 6.8
Plättchen (x10E9/l): zwischen102 und 346
Ferremia (mg/dl): zwischen248 und 75
Ferritin (ng/dl): 594
TIBC (Gesamt-Eisenbindungskapazität) (mg/dl): 360
Transferrin-Sättigungsprozentsatz: Schwankung von 95 bis 24
Gesamtbilirubin (mg/dl): Schwankung von 1.6 bis 0,51
Direktes Bilirubin (mg/dl): zeigte eine Schwankung von 1,92 bis 0,18
Indirektes Bilirubin (mg/dl): zeigte eine Schwankung von 2,99 bis 0,33
Medizinische Behandlung:
Hyponatrium und eiweißarme Ernährung. Wasserrestriktion.
PHP bei 21 Tropfen pro Minute abwechselnd. Eine Ampulle Albumin parallel alle 8 Stunden, gefolgt von einer Ampulle Furosemid. Spironolacton eine Tablette alle 12 Stunden. Phytomenadion (Konakion) eine Ampulle alle 12 Stunden.
Lactulose (Lactulon) ein Esslöffel alle 6 Stunden. Vitamin-B-Komplex eine Tablette alle 12 Stunden.
Da der Patient gut anspricht, wird die orale medikamentöse Behandlung mit Diuretika und B-Komplex fortgesetzt. Lactulose und Phytomenadion wurden abgesetzt.
Der Patient wies eine günstige klinische Entwicklung seines ödematösen Aszites auf, weshalb er mit einer Vitamin-B-Behandlung und dem Rat, keinen Alkohol zu trinken, entlassen wurde.
Weiterführung seiner medizinischen Kontrolle durch die Ambulanzen der Medizinischen Klinik unseres Krankenhauses und durch den hämatologischen Dienst des Krankenhauses Álvarez..
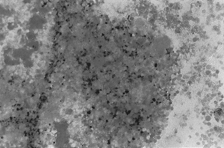
PAMO X 100
– Perls-Färbung. Ein Markklumpen mit starker extrazellulärer Eisenablagerung fällt auf.
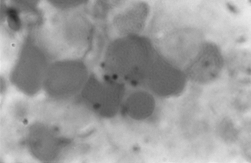
PAMO X 1000
– Perls-Färbung. Intraerythroblastische Eisenablagerungen werden beobachtet.
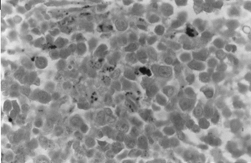
BMOX100
– Perls-Färbung. Wo dichte intra- und extra-erythroblastische Eisenanhäufungen zu beobachten sind.
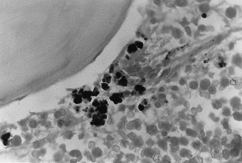
BMO X 1000
– Peris-Färbung. Wo dichte intra- und extraitroblastische Eisenanhäufungen zu beobachten sind.
Der Patient hatte eine gute Entwicklung nach der Internierung. Nach sechzig Tagen wurde eine Blutuntersuchung mit folgenden Ergebnissen durchgeführt: HTO 43%, GR 5,1 X 10E12/L, GB 8,7 X10E9/L, HB 13,9 g/di, Plaq.354 X10E9/L, wobei nur die Behandlung eingehalten wurde.
Nach 120 Tagen wurde er erneut mit den gleichen Ergebnissen der Blutuntersuchung überwacht.
Nach 120 Tagen wurde er erneut mit den gleichen Ergebnissen der Blutuntersuchung überwacht.
Nach sechzig Tagen wurde er erneut mit den gleichen Ergebnissen der Blutuntersuchung überwacht.