Das allgemeinste Prinzip, das die Säurestärke bestimmt, lautet: Starke Säuren haben relativ stabile konjugierte Basen. Im Allgemeinen gilt: Je stabiler die konjugierte Base ist, desto stärker ist die Säure. Es ist wichtig, sich daran zu erinnern, dass Stabilität und Reaktivität entgegengesetzt sind. Je stabiler ein Stoff ist, desto weniger reaktiv ist er, und umgekehrt. Daher kann man die obige Regel auch so ausdrücken, dass starke Säuren schwache konjugierte Basen haben. HCl und H3O+ sind starke Säuren. Dementsprechend sind die entsprechenden konjugierten Basen, Cl- und H2O, schwach (sehr stabil). Das Chloridion ist stabil, weil die negative Ladung an einem sehr elektronegativen Atom sitzt. Das Wassermolekül ist eine der stabilsten Substanzen, die man kennt.
Woher weiß man, welches Proton in einem Molekül (z. B. Essigsäure), das mehr als eine Art von Protonen enthält, das sauerste ist? Je höher der Grad des positiven Charakters des Protons ist, desto saurer ist es. Die Untersuchung einer pKa-Tabelle zeigt einige Tendenzen für saure Protonen. Die folgenden Richtlinien können zur Vorhersage des Säuregrads herangezogen werden.
1. Wasserstoff, der direkt an sehr elektronegative Atome wie Sauerstoff, Schwefel und die Halogene gebunden ist, ist in hohem Maße sauer.
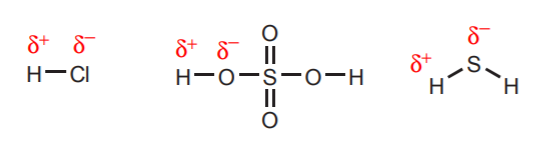
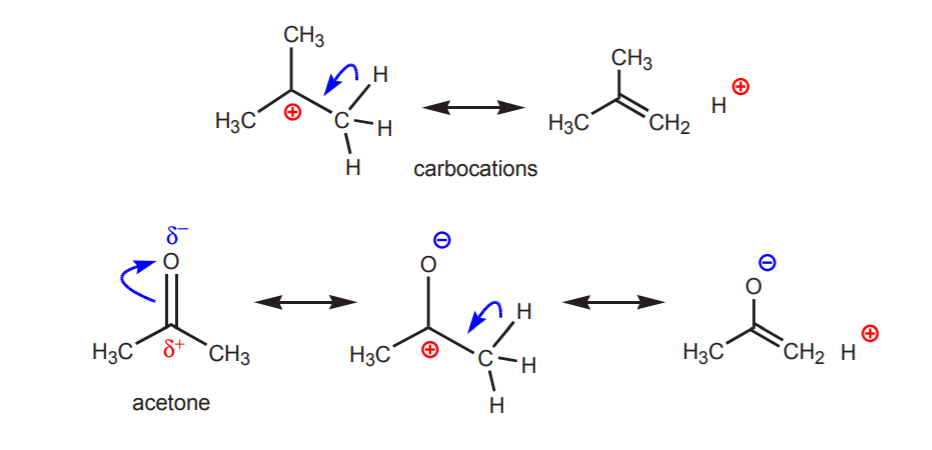
2. Wasserstoff, der an einen positiv geladenen Stickstoff, Sauerstoff oder Schwefel gebunden ist, ist sauer. Die hohe Elektronegativität dieser Atome führt dazu, dass sie sich mit der positiven Ladung nicht wohl fühlen. Sie versuchen, die Ladung auf die benachbarten Atome zu verteilen, indem sie ihnen die Elektronendichte entziehen. Dies lässt sich durch das Zeichnen von Resonanzstrukturen wie in der Abbildung zeigen.
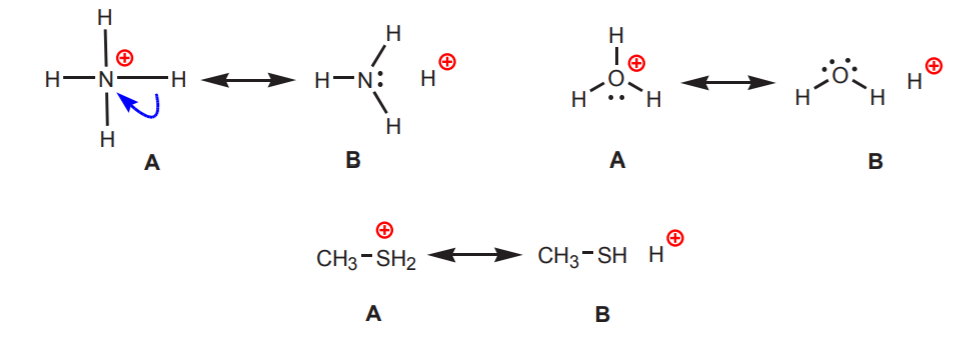
In allen Fällen zeigt die Struktur B den positiven Charakter des Wasserstoffs und damit seine saure Natur.
3. Wie die pKa-Werte von Alkanen und Alkenen zeigen, sind an Kohlenstoff gebundene Wasserstoffe von sehr geringer Acidität. Solche Stoffe werden normalerweise nicht als Säuren betrachtet. Einige Kohlenwasserstoffe können jedoch schwach sauer sein, wenn ihre konjugierten Basen stabile Ionen sind. Dies kann in den folgenden Fällen der Fall sein:
a) In der Nähe des betrachteten Protons befinden sich ein oder mehrere elektronegative Atome. Durch die induktive Wirkung dieser elektronegativen Atome wird den Wasserstoffatomen in der Nähe die Elektronendichte entzogen, so dass sie teilweise positiven Charakter haben.
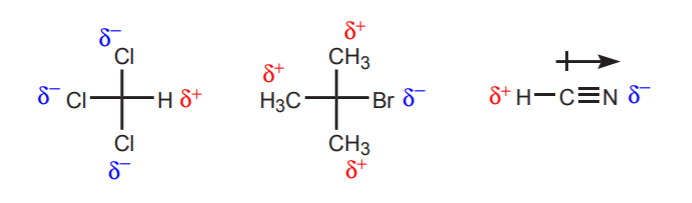
b) Ein Wasserstoffatom, das an ein Kohlenstoffatom gebunden ist, das wiederum an ein anderes Kohlenstoffatom gebunden ist, das eine teilweise oder vollständige positive Ladung trägt, ist sauer.
Die Azidität der gezeigten Protonen wird bei Eliminierungsreaktionen (Kapitel 6) und in der Chemie der Enole (Kapitel 22) deutlich, wenn die Anwesenheit einer Base zur Bildung von Alkenen oder Enolat-Ionen durch einen Schritt führt, der einen Protonentransfer beinhaltet.
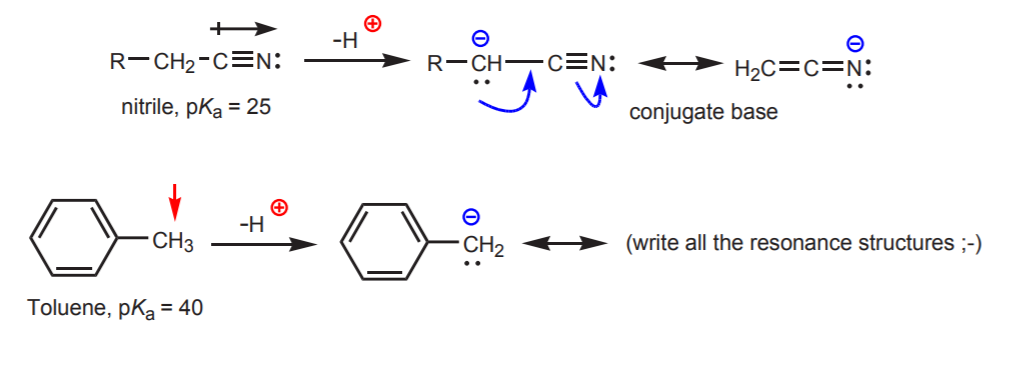
c) Die konjugierte Base ist resonanzstabilisiert. Dieser Effekt ist besonders wichtig, wenn ein weiterer Faktor die Acidität verstärkt, wie z. B. das Vorhandensein eines Dipols oder eines elektronegativen Atoms (wie bei der Nitrilfunktion, -CN). Andernfalls reicht die Resonanzstabilisierung allein nicht aus, um die Acidität eines an Kohlenstoff gebundenen Wasserstoffs drastisch zu erhöhen (wie in Toluol, wo der pKa nur 40 beträgt).
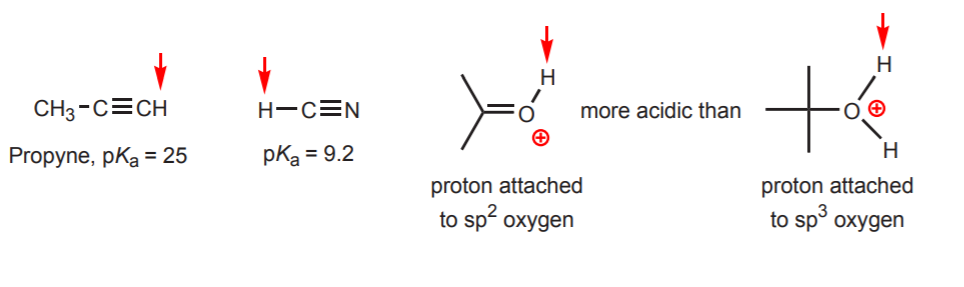
d) Der Wasserstoff ist an einen sp-hybridisierten Kohlenstoff gebunden. Die Auswirkungen der Hybridisierung auf den Säuregrad werden in Kapitel 9 behandelt. Die Hybridisierungstendenzen lassen sich neben Kohlenstoff auch auf Sauerstoff und Stickstoff übertragen, wie im Beispiel rechts zu sehen ist.